Innovationen in der Protonentherapie standen im Mittelpunkt der ASTRO-Jahrestagung, zusammen mit Fortschritten bei anderen hochmodernen Modalitäten – darunter MR-gesteuerte adaptive Strahlentherapie, kombinierte Immuntherapie-Strahlentherapie-Ansätze und stereotaktische Behandlungen für oligometatastische Erkrankungen. Joe McEntee Berichten.
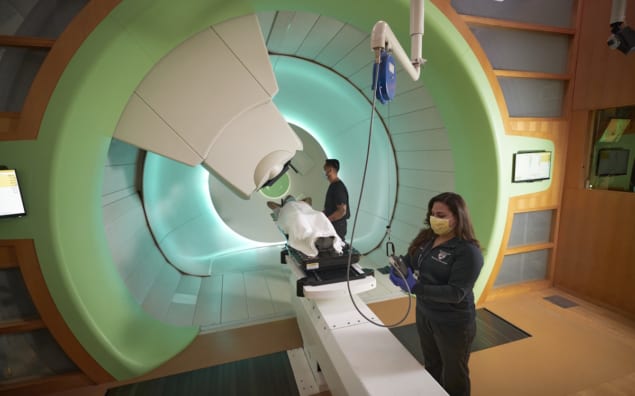
Während die Protonentherapie in der Radioonkologie längst zu einer gängigen Behandlungsoption geworden ist – derzeit sind in den USA 42 Protonenanlagen in Betrieb und weitere 13 Zentren im Bau – ist es offensichtlich, dass die klinische Innovation gerade erst am Anfang steht Groß angelegter Einsatz von Protonen zur Behandlung von Krebs. Das ist eine der wichtigsten Erkenntnisse aus einer speziellen Konferenzsitzung zum Thema „Innovative Strahlentherapieansätze: Vorteile, Herausforderungen, globale Perspektive“ im ASTRO-Jahrestagung in San Diego, Kalifornien, Anfang dieses Monats.
Im Hinblick auf die Zielpräzision sind die Argumente für die Protonentherapie im Vergleich zur konventionellen Strahlentherapie klar genug. Denken Sie an ähnliche tumortötende Eigenschaften wie Photonen, jedoch mit deutlich geringerer Dosis für normales Gewebe. All dies hilft dem Team der Radioonkologie bei der Behandlung von Tumoren in der Nähe von gefährdeten Organen (Organs-at-Risk, OARs), mit dem Potenzial für geringere Nebenwirkungen und Komplikationen auf dem Weg.
„Protonen geben irgendwann ihre gesamte Energie ab und hören dann auf“, erklärte James Metz, Vorsitzender von Radioonkologie an der University of Pennsylvania (UPenn) und Geschäftsführer der OncoLink Krebsaufklärungsdienst. Das bedeutet, dass es keine Strahlendosis über das Ziel hinaus gibt und im Vergleich zur Photonen- und Elektronenbestrahlung eine weitaus geringere Dosis vor dem Ziel deponiert.

Auf diese Weise sind Ärzte in der Lage, den Tumor Schicht für Schicht mit der Protonenabgabe per Bleistiftstrahl zu bekämpfen. „Wir nehmen einen Tumor und teilen ihn Voxel für Voxel in 5 mm auf3 Volumen und nehmen Sie diesen Bleistiftstrahl und behandeln Sie [komplexe Strukturen] Punkt für Punkt, ohne jegliche Austrittsdosis“, bemerkte Metz. „Protonen geben uns die Möglichkeit, die Dosis auf normale Strukturen zu reduzieren, sie mit Chemotherapie und Immuntherapie zu kombinieren und die [Strahlungs-]Dosen in Zukunft zu erhöhen.“
Ungeachtet der laufenden Einführung von Protonentherapiesystemen in der entwickelten Welt – die klinische Akzeptanz ist in den USA, Europa und Asien ähnlich, obwohl es derzeit nur ein Protonenbehandlungszentrum in Subsahara-Afrika gibt – ist es offensichtlich, dass es sich um „Goldstandard“-Beweise handelt Die klinische Wirksamkeit von Protonen ist noch nicht abgeschlossen. „Wir müssen das klinische Potenzial systematisch bewerten und es durch strenge wissenschaftliche Erkenntnisse definieren – indem wir den Nutzen gegenüber den Investitionen quantifizieren“, argumentierte Metz. „Schließlich sind erhebliche Ressourcen und Infrastruktur erforderlich, um ein Protonentherapiezentrum zu unterstützen.“
Die Beweise kommen – und zwar früher als später. Eine Reihe randomisierter klinischer Phase-III-Studien sammeln Daten für verschiedene Krebsindikationen (einschließlich Lunge, Speiseröhre, Leber, Kopf und Hals und Gehirn) oder wurden kürzlich abgeschlossen. Mittlerweile gibt es auch pragmatische Studien, die Protonenbehandlungen in der klinischen Routinepraxis für Patienten mit Brustkrebs und Prostatakrebs evaluieren.
FLASH den Disruptor
Metz seinerseits ist einer der klinischen Pioniere der Protonentherapie und leitete das Entwicklungsprogramm dafür Roberts Protonentherapiezentrum in Philadelphia – eine Einrichtung, die seit ihrer Eröffnung im Jahr 2010 Tausende von Krebspatienten mit Protonen behandelt hat. Klinische Innovation ist zwar das, was sie ist, doch die Aufmerksamkeit richtet sich bereits auf das, was als „nächstes großes Ding“ in der Partikeltherapie angepriesen wird: FLASH-Protonentherapie.
Zum Vergleich: FLASH ist eine experimentelle Behandlungsmethode, bei der ionisierende Strahlung (Elektron, Photon oder Proton) mit ultrahoher Dosisleistung (über 60–80 Gy/s) über sehr kurze Zeiträume (weniger als 1 s) abgegeben wird. Präklinische Studien haben gezeigt, dass die FLASH-Strahlentherapie für normales Gewebe weniger toxisch und bei der Zerstörung von Tumoren genauso wirksam ist wie die herkömmliche Strahlentherapie. Bei umfassender Validierung haben FLASH-Behandlungsschemata daher das Potenzial, die Strahlentherapie zu revolutionieren – so dass höhere Dosen sicher an Tumoren verabreicht werden könnten oder etablierte Dosen mit geringerer Toxizität für OARs verabreicht werden könnten.
Kurz gesagt, die FLASH-Protonentherapie entwickelt sich zu einem zukünftigen Disruptor in der Radioonkologie, argumentierte Metz, „indem sie Biologie und Technologie auf neue Weise zusammenbringt … und die Radiobiologie ein wenig auf den Kopf stellt“. Die Vorteile zeichnen sich bereits ab. Zunächst einmal könnte die FLASH-Protonentherapie die Bestrahlungsdauer erheblich verkürzen, sodass die Strahlentherapie eher einem chirurgischen Eingriff ähnelt.

Werden ultrahohe Dosisraten die Strahlentherapie in einen FLASH verwandeln?
Das ist in mehrfacher Hinsicht eine gute Nachricht für den Patienten – es ebnet den Weg zu einer verbesserten Lebensqualität, einer geringeren Toxizität und Nebenwirkungen sowie zu einem viel kürzeren Zeitaufwand in der Klinik. Auf einer grundlegenderen Ebene kann die FLASH-Bestrahlung auch verschiedene Immunwege und die Genexpression auslösen und so neue Möglichkeiten für Medikamenten- und Strahlenkombinationen schaffen.
Doch während FLASH das Potenzial hat, Behandlungsparadigmen und viele aktuelle Annahmen über die Strahlenabgabe auf den Kopf zu stellen, schloss Metz mit einer warnenden Bemerkung: „Ich würde sagen, dass die FLASH-Protonentherapie noch nicht für die Hauptsendezeit bereit ist … [und] nicht bereit für einen weiteren Einsatz.“ als ein paar hoch ausgestattete Zentren, die die entsprechende Forschung und klinische Studien durchführen können.“
Klinische Innovation: Es kommt auf die Ergebnisse an
Neben den klinischen Möglichkeiten, die die Protonentherapie bietet, wurden in der ASTRO-Sitzung zu innovativen Strahlentherapieansätzen zahlreiche weitere Grundlagen behandelt. Tamer Refaat, Professor für Radioonkologie an der Loyola University in Chicago, Illinois, startete mit einem Statusbericht zur MR-gesteuerten Strahlentherapie (MRgRT).
„Die große Sache [mit MRgRT] ist die Echtzeitanpassung“, sagte Refaat den Delegierten. Mit anderen Worten: eine personalisierte, täglich angepasste Strahlentherapie, die auf der Echtzeit-Anatomie des Patienten am Tisch basiert und es dem klinischen Team ermöglicht, die Dosis für das Zielvolumen zu maximieren und die Dosis für OARs zu minimieren.
Was die MRgRT-Innovationen betrifft, die es zu beobachten gilt, hob Refaat die kommerzielle und klinische Einführung der Cine-Gating-Funktionalität hervor, um die Behandlung von Tumoren im Oberbauch in einer einzigen Atemphase zu verbessern. „Der Strahlungsstrahl schaltet sich ein, wenn sich das Ziel innerhalb der Verfolgungsgrenze befindet, und schaltet sich aus, wenn es sich außerhalb befindet“, erklärte er (und fügte hinzu, dass der Nachteil darin besteht, dass der Patient länger auf dem Behandlungstisch verweilt).

Auch die Integration der funktionellen MRgRT in den MR-Linac-Workflow stand im Rampenlicht, wobei Refaat Forscher von zitierte MD Anderson Cancer Center (Houston, Texas) gehört zu den ersten Anwendern, die strahlenresistente Tumor-Subvolumina identifizieren und die Dosis auf diese Subvolumina entsprechend steigern wollen.
Ein weiteres heißes Thema konzentrierte sich auf die Synergien kombinierter Modalitäten durch die Integration von Immuntherapie und Strahlentherapie bei Krebsbehandlungen. Die Rednerin ist Silvia Formenti, Radioonkologin bei Weill Cornell Medizin in New York ist eine der Haupttreibenden eines Paradigmenwechsels in der Strahlenbiologie. Ihre Bemühungen klärten die Rolle ionisierender Strahlung auf das Immunsystem auf und demonstrierten gleichzeitig die Wirksamkeit kombinierter Strahlentherapie-Immuntherapie-Regime bei soliden Tumoren.
Formenti betonte die entscheidende Rolle, die in dieser Hinsicht das ImmunoRad Radiation Oncology-Biology Integration Network spielt (ROBIN). ROBIN ist eine multidisziplinäre Forschungs- und Entwicklungskooperation zwischen US-amerikanischen und europäischen Krebszentren und versucht, die Wechselwirkung von Strahlentherapie und Immunantwort besser zu verstehen – und die Talente von Nachwuchswissenschaftlern auf diesem Gebiet zu fördern. Derzeit, so Formenti, werde das Gesamtbild durch „finanzielle Toxizität“ getrübt, da sich die Kosten der Immuntherapie für die meisten Länder mit niedrigem und mittlerem Einkommen – sowie für viele Amerikaner – als unerschwinglich erweisen.
Der Fokus auf kollaborativer klinischer Forschung wurde von Stephen Harrow, einem beratenden klinischen Onkologen am, bestätigt Edinburgh Krebszentrum in Schottland. Im Abschlussvortrag der Sitzung erörterte er die Anwendung der stereotaktischen Körperstrahlentherapie (SBRT) bei oligometastasierten Erkrankungen.
Nach der Pandemie betonte Harrow, wie das Scottish Oligomet SABR Network (SOSN), unterstützt durch 1 Million Pfund an Fördermitteln der schottischen Regierung, es den fünf Krebszentren Schottlands ermöglicht hat, Patienten im ganzen Land (nicht nur in den USA) einen gemeinsamen SBRT-Behandlungsdienst anzubieten dicht besiedelter Zentralgürtel, der Glasgow und Edinburgh umfasst).
Das Ziel von SOSN sei es, erklärte er, „ein Netzwerk von Ärzten, Physikern und Radiologen aufzubauen, damit wir uns alle über die Patientenauswahl [Kriterien für SBRT] einig sind und wir im ganzen Land Chancengleichheit für Patienten haben“. Darüber hinaus fügte er hinzu: „Die Beweise verdichten sich definitiv, dass man mit SBRT bei der Oligomet-Erkrankung die Patientenergebnisse beeinflussen kann.“
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- Quelle: https://physicsworld.com/a/proton-therapy-on-an-upward-trajectory-while-flash-treatment-schemes-get-ready-to-shine/



