Das Glioblastom (GBM) ist die tödlichste und aggressivste Form von Hirntumor. Fast alle Tumoren treten nach der Behandlung erneut auf, da sich überlebende Zellen im Laufe der Zeit in widerstandsfähigere Formen verwandeln, um weiteren Therapien zu widerstehen. Um dieser Herausforderung zu begegnen, haben Wissenschaftler am University of Leeds haben eine neuartige Doppelrohr-Nanopipette entwickelt und damit die Flugbahnen einzelner lebender GBM-Zellen untersucht, während sie sich als Reaktion auf die Behandlung verändern.
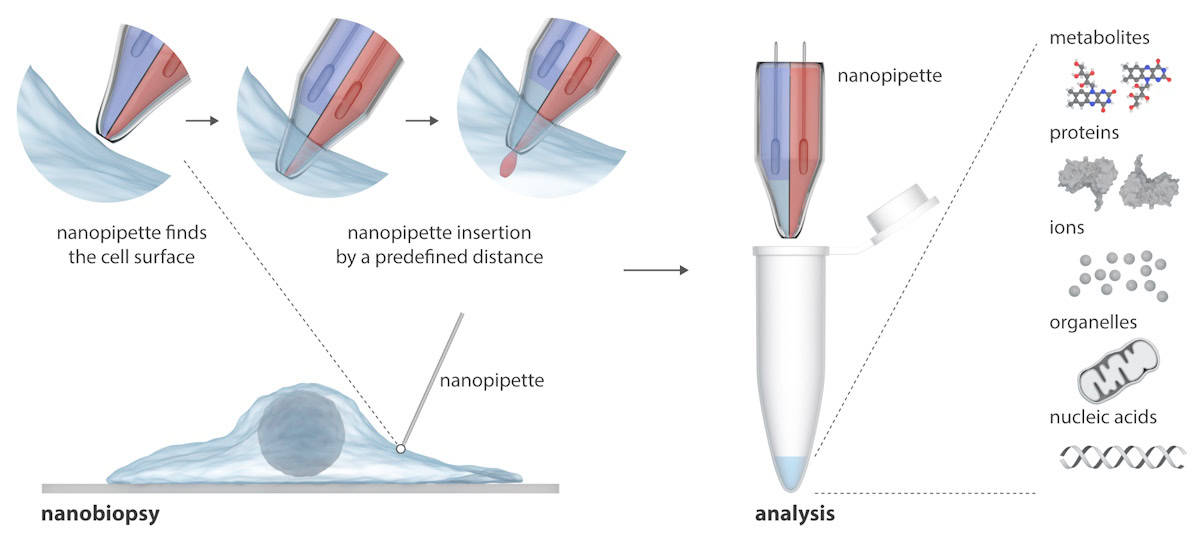
Die Nanopipette besteht aus zwei nanoskopischen Nadeln, die gleichzeitig exogene Moleküle in eine Zelle injizieren und Zytoplasmaproben daraus entnehmen können. Die Nanopipette wird in ein Rasterionenleitfähigkeitsmikroskop (SICM) integriert, um Nanobiopsien lebender Zellen in Kultur durchzuführen. Im Gegensatz zu bestehenden Techniken zur Untersuchung einzelner Zellen, die normalerweise die Zelle zerstören, kann die Nanopipette wiederholt Biopsien einer lebenden Zelle entnehmen, ohne sie abzutöten, was Längsschnittstudien des Verhaltens einer einzelnen Zelle über einen längeren Zeitraum hinweg ermöglicht.
Schreiben in Wissenschaft Fortschritte, erklären die Forscher, dass SICM funktioniert, indem es den Ionenstrom zwischen einer in einer Glas-Nanopipette eingesetzten Elektrode und einer Referenzelektrode misst, die in eine Elektrolytlösung mit den Zellen eingetaucht ist. Eine Nanobiopsie wird durchgeführt, wenn ein Ionenstrom durch die Nanopore an der Spitze der Nanopipette fließt, nachdem eine Spannung zwischen den beiden Elektroden angelegt wurde. Bei ihrer Doppelzylinder-Nanopipette fungiert ein Zylinder als elektrochemische Spritze zur Durchführung zytoplasmatischer Extraktionen; Die zweite enthält eine wässrige Elektrolytlösung, die einen stabilen Ionenstrom für eine präzise Positionierung und Nanoinjektion vor der Nanobiopsie liefert.
Die halbautomatische Plattform ermöglicht die Extraktion von Zytoplasmavolumina im Femtoliterbereich und die gleichzeitige Injektion in einzelne Zellen. Die Plattform ermöglicht eine automatisierte Positionierung der Nanopipette mithilfe einer Rückkopplungssteuerung (der Ionenstrom sinkt, wenn sich die Nanopipette der Probe nähert), während die Erkennung bestimmter Stromsignaturen die erfolgreiche Membranpenetration einer einzelnen Zelle anzeigt.
Langzeitstudien
Als Proof-of-Concept für die Leistungsfähigkeit der Plattform führten die Forscher eine longitudinale Nanobiopsie einer GBM-Zelle (und ihrer Nachkommen) durch und profilierten die Veränderungen der Genexpression über einen Zeitraum von 72 Stunden. Sie führten eine Nanobiopsie vor der Therapie, während der Behandlung mit Strahlentherapie und Chemotherapie sowie nach der Behandlung durch.
„Unsere Methode ist robust und reproduzierbar und ermöglicht die Membranpenetration und Nanoinjektion über verschiedene Zelltypen mit unterschiedlichen mechanischen Eigenschaften“, schreiben die Co-Hauptforscher Lucy Stead und Paolo Actis. „Die durchschnittliche Erfolgsquote der Nanoinjektion beträgt 0.89 ± 0.07. Anschließend wird intrazelluläre mRNA extrahiert.“
Die Forscher untersuchten die Reaktion von GBM-Zellen auf die Standardbehandlung mit 2 Gy Strahlung und 30 µM Temozolomid. Sie verfolgten einzelne Zellen und ihre Nachkommen visuell über 72 Stunden hinweg, wobei 98 % in diesem Zeitraum im Sichtfeld des Mikroskops blieben – ein wichtiger Faktor bei der Durchführung einer Längsschnittanalyse.

Am ersten Tag führten die Forscher eine Biopsie durch, injizierten ihnen einen fluoreszierenden Farbstoff und bildeten jede Zelle ab. Am zweiten Tag erhielt die Hälfte der Zellen Bestrahlung und Chemotherapie, während die anderen als Kontrollen dienten. Alle Zellen wurden am 1. und 2. Tag abgebildet und am 2. Tag erneut biopsiert und injiziert.
In Zellen, die am ersten Tag einer Nanobiopsie unterzogen wurden, war die Überlebensrate zwischen behandelten und unbehandelten Zellen ähnlich, und die Zellteilungsraten waren in beiden Gruppen vergleichbar. Nach 1 Stunden überlebten 72 % der unbehandelten Kontrollzellen (nicht biopsiert), verglichen mit 63 % der behandelten biopsierten Zellen. Unabhängig von der Behandlung gab es am ersten Tag keinen Unterschied in den nachfolgenden Sterberaten der Zellsubtypen. Allerdings wechselte ein viel größerer Anteil der unbehandelten Zellen im Laufe der Zeit den Subtyp oder produzierte Nachkommen mit einem anderen Subtyp als die behandelten Zellen.
„Dies deutet darauf hin, dass unbehandelte Zellen über den Zeitraum von drei Tagen deutlich plastischer sind als behandelte Zellen“, schreiben die Forscher. „Die Zellphänotyp-Scores von gepaarten Tag-1- und Längsschnittproben zeigten, dass behandelte Zellen dazu neigen, während der Therapie denselben Phänotyp beizubehalten, während unbehandelte Zellen eher dazu neigen, ihren Transkriptionszustand über 72 Stunden zu ändern, was darauf hindeutet, dass die Behandlung entweder eine hohe Transkriptionsstabilität induziert oder selektiert.“ in dieser etablierten GBM-Zelllinie.“
„Das ist ein bedeutender Durchbruch“, sagt Stead. „Es ist das erste Mal, dass wir über eine Technologie verfügen, mit der wir die Veränderungen nach der Behandlung tatsächlich überwachen können, anstatt sie nur anzunehmen. Diese Art von Technologie wird eine Ebene des Verständnisses ermöglichen, die wir einfach nie zuvor hatten. Und dieses neue Verständnis und diese neuen Erkenntnisse werden zu neuen Waffen in unserem Arsenal gegen alle Arten von Krebs führen.“
Mechanische Nanochirurgie bekämpft aggressiven Hirntumor
Das Team ist davon überzeugt, dass die Fähigkeit dieser vielseitigen Nanosonden, mit minimaler Störung auf die intrazelluläre Umgebung zuzugreifen, das Potenzial birgt, „die molekulare Diagnostik sowie Gen- und Zelltherapien zu revolutionieren“.
„Unsere zukünftige Arbeit wird sich darauf konzentrieren, den Durchsatz der Technologie zu erhöhen, damit mehr Zellen analysiert werden können“, sagt Actis Physik-Welt. „Wir arbeiten daran, die Protokolle zur Analyse der aus Zellen extrahierten RNA zu verbessern, damit mehr biologische Informationen gesammelt werden können. Wir sind auch sehr daran interessiert, fortgeschrittenere biologische Modelle von Hirntumoren zu untersuchen, die auf von Patienten stammenden Zellen und Organoiden basieren.“
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- Quelle: https://physicsworld.com/a/single-cell-nanobiopsy-explores-how-brain-cancer-cells-adapt-to-resist-treatment/



