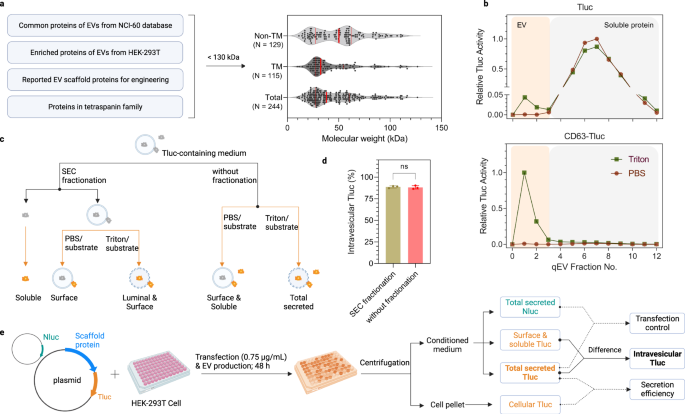
Ein einfacher Assay zum Screening von EV-sortierenden Proteinen
Auf der Suche nach effizienten EV-Sortierungsproteinen wurde eine Kandidatenliste basierend auf Literaturrecherchen und Proteomik-Datenbanken zusammengestellt. Potenzielle Kandidaten wurden von einem der beiden (1) Proteine abgeleitet, von denen festgestellt wurde, dass sie in den NCI-60-Zellen mit EVs angereichert sind29, (2) Proteine, die in EVs reichlich vorhanden sind und von menschlichen embryonalen Nierenepithelzellen (HEK)-293T produziert werden34, (3) berichteten über EV-sortierende Proteine als Referenz auf frühere Studien32,33und (4) alle Proteine in der Tetraspanin-Superfamilie. Proteine, die größer als 130 kDa waren, wurden ausgeschlossen, um eine Überexpression/Engineering zu erleichtern. Insgesamt wurden 244 Kandidaten mit einer mittleren Größe von 38 kDa eingeschlossen, davon 129 Nicht- und 115 Transmembranproteine (Abb. 1a; Eine vollständige Liste finden Sie in der Datenquellendatei.
a Auswahlkriterien und Übersicht über EV-sortierende Proteinkandidaten. Die roten durchgezogenen Linien geben die Perzentilwerte von 25 %, 50 % und 75 % an. b SEC-Elutionsprofile von konditionierten Medien aus HEK-293T-Zellen, die Tluc oder CD63-Tluc exprimieren. Die Tluc-Aktivität in jeder Fraktion wurde direkt (Gruppe PBS) oder nach Membranlyse (Gruppe Triton) quantifiziert und auf die Fraktion mit dem höchsten Signal normalisiert. EVs und lösliche Proteine wurden in den Fraktionen 0–3 bzw. 4–12 gewonnen. c Schema zur Differenzierung von Tluc-Formen in konditionierten Medien. d Prozentsatz des intravesikulären Tluc für CD63-Tluc unter Verwendung fraktionierter und unfraktionierter Medien. Die Ergebnisse werden als Mittelwert ± Standardabweichung von drei biologischen Replikaten angezeigt. Zweiseitiger Student t Prüfung (P > 0.9999). ns: nicht signifikant. e Überblick über das Screening-Verfahren und die Datenanalysen. HEK-293T-Zellen wurden in Mikrotiterplatten mit 96 Vertiefungen gezüchtet und mit Tluc-Fusionsplasmid und Nluc-Plasmid co-transfiziert. Zellkulturen wurden zentrifugiert und die Tluc-Aktivität im Zellpellet und im konditionierten Medium gemessen. Die Nluc-Aktivität wurde nur in den konditionierten Medien quantifiziert. c, e Erstellt mit BioRender.com. Quelldaten werden als Quelldatendatei bereitgestellt. SEC-Größenausschlusschromatographie.
Um die Lumenladefähigkeit der Kandidaten in Elektrofahrzeugen zu beurteilen, haben wir einen Assay entwickelt, der auf dem Luciferase-Reporter ThermoLuc (Tluc; 60.5 kDa) basiert.18. Kurz gesagt, Tluc wurde an die C-Termini aller Kandidaten fusioniert, wobei zu berücksichtigen ist, dass die N-Termini normalerweise die Stelle für Signalpeptide und posttranslationale Modifikationen sind. Die für die Fusionsproteine kodierenden Plasmide wurden in HEK-293T-Zellen transfiziert. Nach 48 Stunden wurden die konditionierten Medien gesammelt und vor den Biolumineszenzmessungen weiterverarbeitet. Um die Durchführbarkeit dieses Assays zu bewerten, wurden zunächst die konditionierten Medien von Zellen analysiert, die Tluc allein und CD63-Tluc exprimierten. Beide wurden mit Größenausschlusschromatographie-Säulen (SEC) fraktioniert, um Vesikel von freien Proteinen zu trennen (Abb. 1b)35. Die Fraktionen wurden entweder mit PBS behandelt, um lösliches/oberflächenassoziiertes Tluc zu bestimmen, oder mit dem Detergens Triton X-100, um das gesamte sezernierte Tluc nachzuweisen (Abb. 1c). Im Vergleich zu Tluc allein führte die Fusion mit CD63 zu einer deutlichen Verschiebung von Tluc in Richtung der EV-Fraktion (Abb. 1b). Bemerkenswert ist, dass die Tluc-Aktivität in den EV-Fraktionen erst bei Membranlyse nachgewiesen wurde, was darauf hindeutet, dass das Tluc-Substrat nicht in der Lage ist, die EV-Membran zu passieren und mit luminaler Luciferase zu reagieren. Dies impliziert, dass eine SEC-Fraktionierung zur Quantifizierung luminaler Proteine entbehrlich ist. Dies wird durch den Vergleich unfraktionierter und fraktionierter Medien von CD63-Tluc-exprimierenden Zellen weiter gestützt, der keine signifikanten Unterschiede im Prozentsatz an intravesikulärem Tluc zeigte (Abb. 1d). Zusammengenommen zeigen diese Daten, dass dieser Assay in einem Hochdurchsatzformat verwendet werden kann, um potenzielle EV-Ladegerüste zu identifizieren.
Auch in Zukunft galt für die Prüfung aller 244 Kandidaten das gleiche Prinzip wie oben. Für nachgelagerte Analysen wurden die Proteine in erster Linie anhand der absoluten Menge an intravesikulärem Tluc bewertet, abgeleitet aus der Differenz des Tluc-Signals, das mit und ohne Membranlyse detektiert wurde, oder anhand des relativen Prozentsatzes davon (Abb. 1e). Informationen zur Fusionsproteinexpression wurden durch Messung von Tluc in den EV-produzierenden Zellen erhalten. Darüber hinaus wurden die Daten, sofern angegeben, auf eine Transfektionskontrolle in Form eines Plasmids normalisiert, das für NanoLuc (Nluc)-Luciferase kodiert und dem Transfektionsgemisch zugesetzt wurde, um mögliche Transfektionsvariationen zu berücksichtigen.
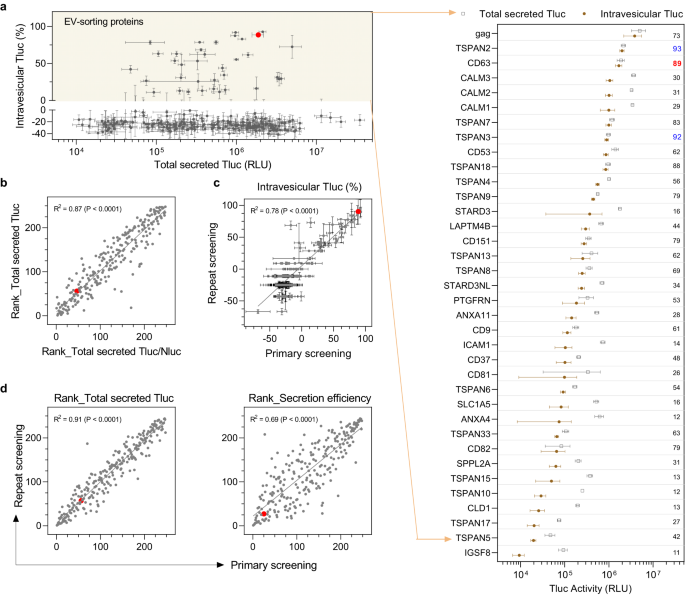
Beim Screening werden Dutzende EV-sortierende Proteine identifiziert
Das Screening der 244 Kandidaten in HEK-293T-Zellen ergab keine offensichtliche Korrelation zwischen intravesikulärem Tluc und zellulärem oder vollständig sezerniertem Tluc (ergänzende Abbildung). 1a, b), was darauf hinweist, dass weder die Zellexpression noch die Gesamtsekretion die Fähigkeit zur EV-Sortierung vollständig vorhersagen. Bei den meisten Kandidaten lag der Prozentsatz an intravesikulärem Tluc unter Null, was unerwartet ist, aber möglicherweise auf eine verminderte Enzymaktivität und/oder Photonenlebensdauer in Gegenwart des Detergens Triton zurückzuführen ist. Dennoch lieferte es einen vernünftigen und praktischen Grenzwert für Proteine mit der Fähigkeit zur EV-Sortierung. Gemäß dieser Definition wurde festgestellt, dass insgesamt 36 Proteine die Fähigkeit zur EV-Sortierung in HEK-293T-Zellen aufweisen (Abb. 2a). Darunter befanden sich fünf bekannte EV-Sortierungsproteine, darunter drei EV-Marker (CD9, CD63, CD81), ein kürzlich identifiziertes Protein (PTGFRN).32und das virale Glykoprotein gag, was die Gültigkeit unseres Screening-Protokolls untermauert. Nach unserem besten Wissen ist dies das erste Mal, dass von den verbleibenden 31 Proteinen berichtet wurde, dass sie luminale Ladung in Elektrofahrzeuge laden können.
a Überblick über alle 244 Kandidaten, Auftragung des gesamten sekretierten Tluc gegen den Prozentsatz des intravesikulären Tluc. Es wurde definiert, dass EV-Sortierungsproteine einen Prozentsatz an intravesikulärem Tluc über Null (gelber Bereich) aufweisen und im gruppierten Punktdiagramm angezeigt werden. Der Wert bezieht sich auf den Prozentsatz an intravesikulärem Tluc. Proteine sind mit Gennamen gekennzeichnet. b Korrelation zwischen dem Rang bezüglich des gesamten sezernierten Tluc und dem Rang bezüglich des gesamten sezernierten Tluc/Nluc-Verhältnisses. c Korrelation des Prozentsatzes an intravesikulärem Tluc, der aus dem primären und wiederholten Screening erhalten wurde. d Korrelation des Rangs bezüglich sekretiertem Tluc oder der Sekretionseffizienz zwischen dem primären und dem wiederholten Screening. Ergebnisse in (a, b) stammten aus dem primären Screening und werden als Mittelwert ± Standardabweichung von fünf biologischen Replikaten angezeigt. Die Daten aus dem Wiederholungsscreening werden als Mittelwert ± Standardabweichung von drei biologischen Replikaten angezeigt. In den Streudiagrammen bezieht sich jeder Punkt auf einen Kandidaten und der rote Punkt gibt den Benchmark CD63 an. Der Grad der Korrelation wurde mit linearer Regression analysiert und wird als Anpassungsgüte angezeigt (R2) und Bedeutung der Steigung ungleich Null (P). Quelldaten werden als Quelldatendatei bereitgestellt.
Von den vier bekannten nicht-viralen EV-Sortierungsproteinen wies CD63 den höchsten Prozentsatz an intravesikulärem Tluc auf, wobei 89 % des gesamten sekretierten Tluc in EVs lokalisiert waren. Bemerkenswerterweise übertraf TSPAN2 CD63 nicht nur hinsichtlich des relativen intravesikulären Tluc (93 % gegenüber 89 %), sondern auch hinsichtlich der absoluten Menge (2.0e6 gegenüber 1.7e6; detaillierte Informationen finden Sie in der Quelldatendatei). Darüber hinaus sortierten drei Calmodulin-Proteine (CALM1, CALM2, CALM3) beträchtliche Mengen an Tluc in EVs, jedoch mit moderaten Anteilen an intravesikulärem Tluc (29–31 %).
Um auszuschließen, dass unerwünschte Faktoren die Tluc-Sekretion beeinträchtigen, wurden geeignete Qualitätskontrollen durchgeführt. Zunächst wurden alle Kandidaten nach dem gesamten sezernierten Tluc und dem Verhältnis des gesamten sezernierten Tluc zu Nluc eingestuft. Die Normalisierung gegenüber dem Nluc-Signal hatte keinen Einfluss auf die Tluc-Sekretion (Abb. 2b), wodurch eine verwirrende Rolle des Transfektionsverfahrens verworfen wird. Zweitens ergab eine Wiederholung des Screenings konsistente Ergebnisse für den Prozentsatz an intravesikulärem Tluc (Abb. 2c) sowie die Ränge des gesamten sezernierten Tluc und der Sekretionseffizienz (Abb. 2d). Schließlich zeigten die Ränge des gesamten sekretierten Tluc und der Sekretionseffizienz einen hohen Grad an linearer Korrelation zwischen zwei verschiedenen Plasmiddosen (0.75 µg/ml vs. 1 µg/ml; ergänzende Abb. 1c). Zusammengenommen untermauern diese Ergebnisse die Zuverlässigkeit der mit unserer Screening-Methode gewonnenen Erkenntnisse.
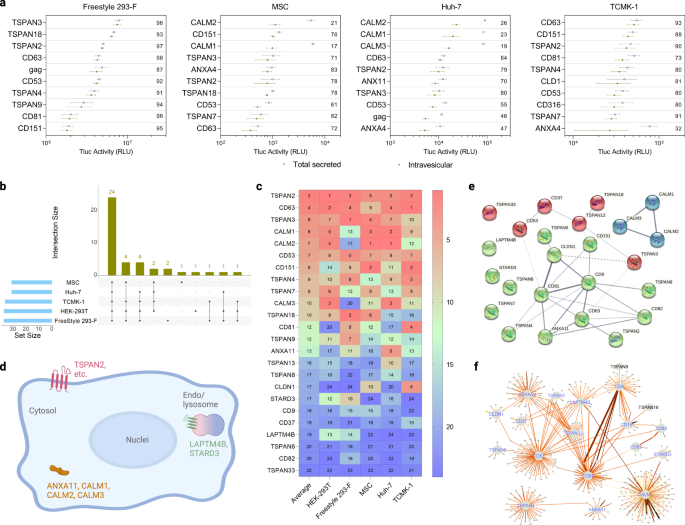
EV-Sortierungsproteine sind in verschiedenen Zelltypen weitgehend konserviert
Neben HEK-293T werden regelmäßig andere Zelltypen als EV-Quellen verwendet, was uns dazu veranlasst, die EV-Sortierungsfähigkeit unserer Kandidaten in (1) suspendierten HEK-Zellen (Freestyle 293-F) und (2) aus menschlichem Nabelschnurblut zu untersuchen mesenchymale Stammzellen (MSCs), (3) aus menschlichen Hepatozyten gewonnene Karzinomzellen (Huh-7) und (4) Nierenepithelzellen der Maus (TCMK-1). Zu diesem Zweck wurden 95 Kandidaten, die sich beim ersten Screening in einer dieser Kategorien als vielversprechend erwiesen hatten: Prozentsatz des intravesikulären Tluc, insgesamt sezerniertes Tluc und Sekretionseffizienz (siehe Quelldatendatei für detaillierte Informationen), wie oben gescreent.
In Freestyle 293-F war TSPAN3 das Protein mit der höchsten EV-Sortierfähigkeit in Bezug auf den Prozentsatz an intravesikulärem Tluc. In MSCs und Huh-7 belegte CALM2 den höchsten Rang und in TCMK-1 war CD63 (Abb. 3a). Während sich herausstellte, dass das Transfektionsverfahren die Tluc-Sekretion in allen getesteten adhärenten Zellen nicht wesentlich beeinflusste, schien Freestyle 293-F anfälliger für Variationen zu sein (ergänzende Abb. 2). Für jeden Zelltyp wurden zwischen 30 und 37 Proteine mit der Fähigkeit zur EV-Sortierung (Prozentsatz des intravesikulären Tluc über Null) identifiziert (Abb. 3b). Davon waren 24 Proteine in allen fünf Zelltypen konserviert, was auf ihre robuste Sortierfähigkeit in verschiedenen zellulären Kontexten hinweist (eine vollständige Liste finden Sie in der Quelldatendatei). Die Proteine in der konservierten Untergruppe wurden nach ihrer absoluten intravesikulären Tluc-Aktivität eingestuft (Abb. 3c). Im Durchschnitt zeigten TSPAN2, CD63 und TSPAN3 die besten Sortierfähigkeiten über verschiedene Zelltypen hinweg.
a Die zehn wichtigsten Gerüstproteine für intravesikuläres Tluc in verschiedenen Produzentenzelltypen. Der Wert im Diagramm bezieht sich auf den Prozentsatz an intravesikulärem Tluc. Die Ergebnisse werden als Mittelwert ± Standardabweichung von drei biologischen Replikaten angezeigt. b Anzahl der für jeden Produzentenzelltyp identifizierten EV-Sortierungsproteine und Überlappung zwischen Zelltypen. c Rang der 24 konservierten EV-Sortierungsproteine in Bezug auf intravesikuläres Tluc in jedem Zelltyp. Der Wert gibt den Rang in jedem Zelltyp sowie dessen Durchschnitt an. d Topologie und subzelluläre Lage der 24 konservierten EV-Sortierungsproteine. Erstellt mit BioRender.com. (ef) Interaktionsnetzwerk der 24 konservierten EV-Sortierungsproteine, die aus STRING gewonnen wurden (e) und IntAct (f) Datenbanken. Linienstärke in Tafeln (e, f) gibt die Stärke der Datenunterstützung an, wobei eine dickere Linie für stärkere Beweise steht. Proteine sind mit Gennamen gekennzeichnet. Quelldaten werden als Quelldatendatei bereitgestellt.
Um ein tiefergehendes Verständnis potenzieller Mechanismen zu erhalten, die die EV-Sortierungsfähigkeit der konservierten Teilmenge steuern, wurden bioinformatische Studien durchgeführt. Laut der auf UniProtKB verfügbaren Anmerkung sind nur die drei Calmodulin-Proteine und ANXA11 zytosolisch, während die übrigen Proteine alle Mitglieder der Tetraspanin-Superfamilie sind und sich entweder auf der Plasma- oder Endosomen-/Lysosomenmembran befinden (Abb. 3d). Als nächstes untersuchten wir mögliche Wechselwirkungen zwischen den 24 EV-Sortierungsproteinen. Das in der STRING-Datenbank verfügbare experimentelle und vorhergesagte Interaktom zeigte schwache Hinweise auf die Wechselwirkung von TSPAN2/TSPAN3 mit CD63, und Calmodulin-Proteine scheinen unabhängig vom Rest zu funktionieren (Abb. 3e). In ähnlicher Weise legen die Ergebnisse der IntAct-Datenbank, die sowohl direkte als auch indirekte Interaktionen umfasst, nahe, dass das Interaktom von TSPAN2 kaum mit dem der drei gut charakterisierten Tetraspanine CD9/CD63/CD81 überlappt (Abb. 3f). Diese Vorhersagen deuten darauf hin, dass TSPAN2 und TSPAN3 weitgehend unabhängig voneinander und anderen Tetraspaninen funktionieren.
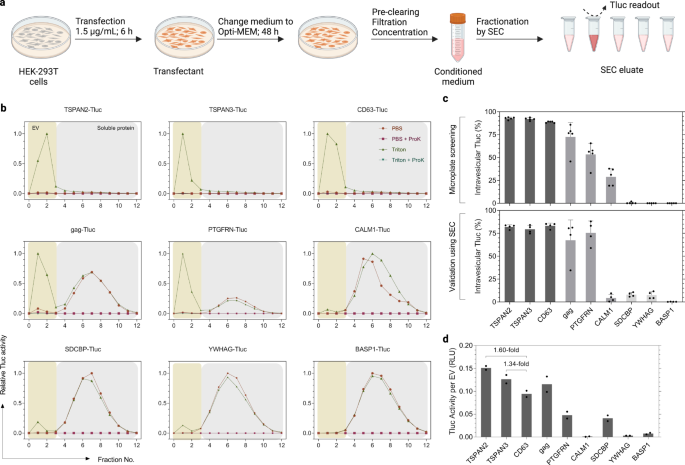
Kandidaten für die Sortierung von Elektrofahrzeugen erweisen sich bei der standardisierten Elektrofahrzeugproduktion als robust
Beim Screening wurden HEK-293T-Zellen gezüchtet und in 96-Well-Mikrotiterplatten transfiziert, um einen höheren Durchsatz zu erzielen. Ein solcher Maßstab ist jedoch für zukünftige Anwendungen, die die Produktion größerer Mengen technischer Elektrofahrzeuge anstreben, nicht praktikabel. Darüber hinaus wurden die konditionierten Medien im Screening direkt nach der Zentrifugation ohne definierte Trenntechniken analysiert. Hier waren wir aufgrund ihres therapeutischen Potenzials bei vielen Krankheiten besonders an kleinen EVs (sEVs, ≤ 200 nm) interessiert36,37. Vor diesem Hintergrund haben wir Elektrofahrzeuge nach einem standardisierten Protokoll hergestellt, das kürzlich von unserer Gruppe erstellt wurde38. Die Hauptunterschiede zum ursprünglichen Screening-Protokoll waren (1) eine höhere Plasmiddosis und eine kürzere Transfektionsdauer, (2) die anschließende Beibehaltung in Opti-MEM und (3) die Filtration konditionierter Medien durch eine 200-nm-Membran, gefolgt von einer Konzentration Schritt (Abb. 4a). Zusätzlich wurden sEVs durch SEC von löslichen Proteinen getrennt, bevor die Tluc-Aktivität und die Vesikelzahl gemessen wurden (Abb. 4b). Bemerkenswert ist, dass Tluc im Eluat durch Proteinase K vollständig deaktiviert wurde, was darauf hindeutet, dass resistente Proteinaggregate kein Grund zur Sorge darstellten (Abb. 4b).
a Arbeitsablauf der EV-Produktion und SEC-Fraktionierungsprotokoll. Erstellt mit BioRender.com. b SEC-Elutionsprofile konditionierter Medien aus transfizierten HEK-293T-Zellen. EVs und lösliche Proteine wurden in den Fraktionen 0–3 bzw. 4–12 gewonnen. Die Tluc-Aktivität in jeder Fraktion wurde mit und ohne Triton und ProK gemessen und auf die Fraktion mit dem höchsten Signal normiert. c Prozentsatz des intravesikulären Tluc unter Verwendung der Screening-Protokolle (oberes Feld; fünf biologische Replikate) und standardisierten Protokolle (unteres Feld; vier biologische Replikate). Mittelwert ± Standardabweichung. d Berechnete Tluc-Aktivität pro Vesikel für gereinigte EV-Präparate. Die Ergebnisse werden als Durchschnitt von zwei biologischen Replikaten angezeigt. Proteine sind mit Gennamen gekennzeichnet. Quelldaten werden als Quelldatendatei bereitgestellt. SEC-Größenausschlusschromatographie.
Um einen Einblick in die Fähigkeit zur sEV-Sortierung zu erhalten, wurden neun repräsentative Kandidaten basierend auf ihrer Leistung im Screening ausgewählt (Abb. 4c). Der Prozentsatz an intravesikulärem Tluc stimmte im Allgemeinen mit dem Screening überein und zeigte eine hohe (>80 %; TSPAN2, TSPAN3 und CD63) und niedrige (<15 %; SDCBP, YWHAG, BASP1) sEV-Sortierfähigkeit (Abb. 4c). Interessanterweise sortierte CALM1 nur 3.7 % Tluc in sEVs, verglichen mit 28.9 % im Screening (P < 0.01, Zweiseitiger Student t prüfen). Unter Berücksichtigung der Vesikelzahlen beobachteten wir, dass TSPAN2 und TSPAN3 CD63 hinsichtlich der Tluc-Aktivität pro EV übertrafen (1.60-fach bzw. 1.34-fach; Abb. 4d). Insgesamt zeigen diese Ergebnisse, dass die Sortierfähigkeit dieser neun Kandidaten bei Befolgung eines standardisierten sEV-Produktionsprotokolls weitgehend unverändert blieb.
Kandidaten für die Sortierung von Elektrofahrzeugen erweisen sich als vielseitig für unterschiedliche Ladungen
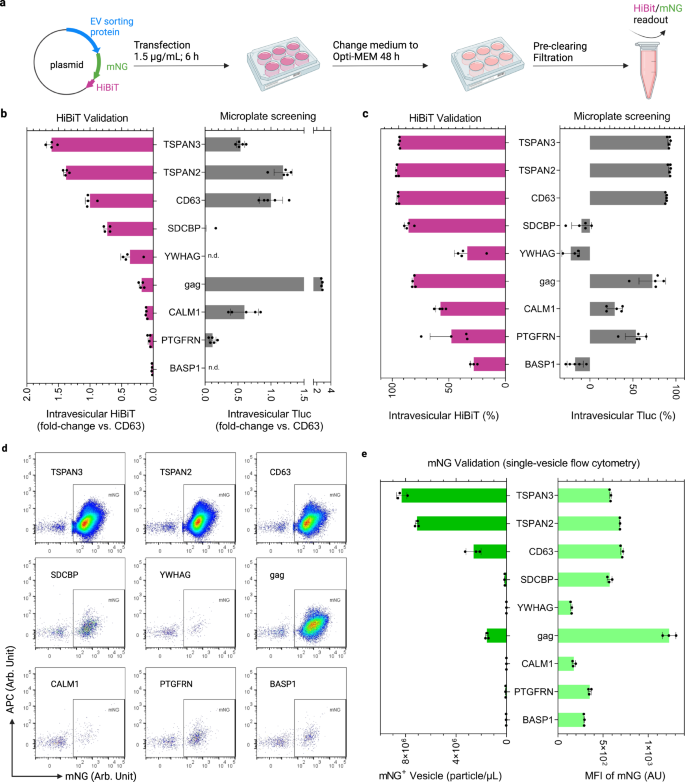
Luciferase ist ein einfacher Reporter zur Quantifizierung manipulierter Elektrofahrzeuge in großen Mengen. Um jedoch mehr Informationen über die Anzahl der manipulierten Elektrofahrzeuge und die Häufigkeit von Frachtproteinen pro Elektrofahrzeug zu erhalten, ist die Einzelvesikel-Bildgebungs-Durchflusszytometrie die Methode der Wahl39,40. Daher wurde Tluc für die neun oben untersuchten Kandidatenproteine durch einen Hybridreporter ersetzt, der aus dem fluoreszierenden Protein mNeonGreen (mNG; 26.6 kDa) besteht, das an HiBiT fusioniert ist41, ein 11-mer-Peptid aus gespaltener Nluc-Luciferase (Abb. 5a).
a Arbeitsablauf der EV-Produktion und -Analyse. Erstellt mit BioRender.com. b Intravesikuläres HiBiT im Vergleich zum Benchmark CD63. und nicht erkannt. c Prozentsatz des intravesikulären HiBiT. In b, cDie Ergebnisse werden als Mittelwert ± Standardabweichung von vier biologischen Replikaten angezeigt. Die Screening-Ergebnisse von HEK-293T-Zellen wurden als Referenz erneut grafisch dargestellt. d Einzelvesikel-Durchflusszytometrie-Punktdiagramme von mNG-HiBiT-markierten EVs. e Konzentration und mittlere Fluoreszenzintensität (MFI) mNG-positiver EVs. Die Ergebnisse werden als Mittelwert ± Standardabweichung von drei biologischen Replikaten angezeigt. Proteine sind mit Gennamen gekennzeichnet. Quelldaten werden als Quelldatendatei bereitgestellt.
Der Vergleich der intravesikulären Luciferase-Aktivitäten von HiBiT und Tluc ergab hinsichtlich der Menge vergleichbare technische Effizienzen für TSPAN3, TSPAN2 und CD63 (Abb. 5b) und Prozentsatz (Abb. 5c). Unter Verwendung von mNG zur Betrachtung der Ebene einzelner Vesikel produzierten TSPAN3 und TSPAN2 die höchste Anzahl an manipulierten Elektrofahrzeugen und übertrafen CD63 um etwa das Dreifache, während sie ähnliche mNG-Werte pro manipuliertem Elektrofahrzeug erreichten (Abb. 5d, e). Darüber hinaus haben wir gezeigt, dass mNG nach der Antikörperfärbung mit den entsprechenden Sortierproteinen auf den EVs kolokalisiert ist, was auf intakte Fusionsproteine hinweist (ergänzende Abb. 3). Überraschenderweise unterschieden sich die HiBiT- und Tluc-basierten Messungen für Gag stark (Abb. 5b, c); die mNG-Werte zeigten jedoch keine solche Diskrepanz (Abb. 5d, e). Dies führte uns zu der Annahme, dass die sterische Konfiguration von gag-mNG-HiBiT verhindert, dass HiBiT mit seiner Partneruntereinheit einen Komplex bildet, um funktionelle Luciferase zu bilden. Darüber hinaus zeigte CALM1 geringe Mengen an vesikulärem HiBiT und mNG, was dem Trend entspricht, der für CALM1-Tluc in SEC-Validierungsexperimenten beobachtet wurde (Abb. 4c). Diese Ergebnisse legen nahe, dass CALM1 vorzugsweise in größere Vesikel (>200 nm) sortiert, die während des Filtrationsschritts entfernt werden (ergänzende Abbildung). 4).
Darüber hinaus haben wir die Leistung dieser ausgewählten Proteine in Freestyle 293-F-Zellen bewertet, die aufgrund eines weniger langwierigen Vermehrungsverfahrens eine wichtige Quelle für die EV-Produktion darstellen. Auch hier übertrafen TSPAN3 und TSPAN2 CD63 um 82 % bzw. 50 % im Hinblick auf intravesikuläres HiBiT (ergänzende Abbildung). 5a). Auf Einzelvesikelebene wurde die höchste Konzentration an mNG-positiven Vesikeln von TSPAN3- und TSPAN2-manipulierten Freestyle 293-F-Zellen produziert (ergänzende Abbildung). 5b). Insgesamt verstärken die auf mNG-HiBiT- und Tluc-Reportern basierenden Vergleichsergebnisse die Zuverlässigkeit des Screening-Protokolls und unterstreichen die robuste EV-Sortierungsfähigkeit der Kandidatenproteine für verschiedene Ladungen.
Deutliche molekulare Signaturen bei mit Tetraspanin hergestellten Elektrofahrzeugen
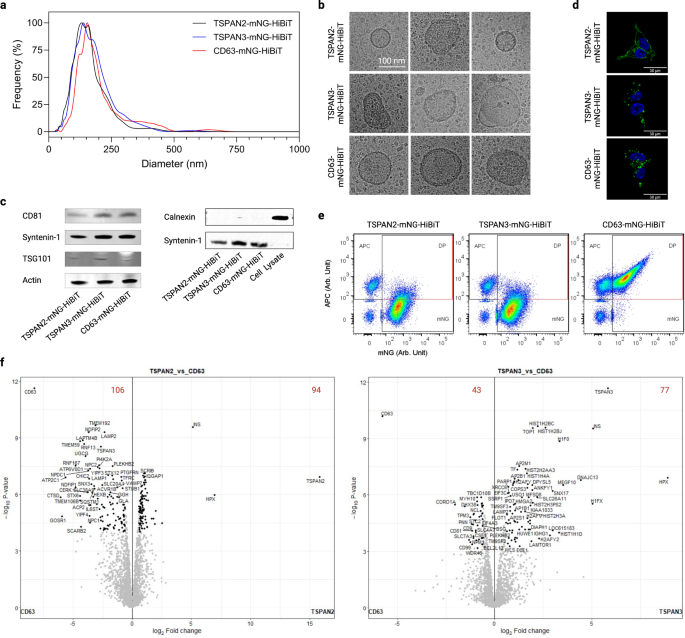
In allen Experimenten gehörten TSPAN2 und TSPAN3 zu den besten EV-Sortierungsproteinen und wiesen offenbar eine bessere Leistung als das gut charakterisierte Tetraspanin CD63 auf. Bemerkenswerterweise konnten verschiedene Spleißisoformen von TSPAN2 und TSPAN3 die Fähigkeit zur EV-Sortierung in HEK293-T-Zellen nicht beibehalten (ergänzende Abb. 6). Da dies unseres Wissens der erste Bericht über diese Proteine für die endogene Entwicklung von Elektrofahrzeugen ist, haben wir die physiochemischen Merkmale von TSPAN2- und TSPAN3-technisch hergestellten Elektrofahrzeugen im Vergleich zu CD63-technisch hergestellten Elektrofahrzeugen detaillierter charakterisiert.
Die Nanopartikel-Tracking-Analyse von EV-Präparaten aus transfizierten HEK-293T-Zellen ergab eine enge Größenverteilung mit mittleren hydrodynamischen Durchmessern von etwa 120 nm (Abb. 6a). Auch ihr morphologisches Erscheinungsbild war typisch für Elektrofahrzeuge, was sich anhand der Membranstruktur und -größe zeigt (Abb. 6b). Darüber hinaus wurden in den EVs häufige EV-Marker wie CD81, Syntenin-1 und TSG101, jedoch nicht der negative Marker Calnexin, nachgewiesen (Abb. 6c). Darüber hinaus untersuchten wir die Lage der drei Tetraspanin-Proteine in transfizierten Zellen, um Einblicke in die EV-Biogenese zu gewinnen. Während TSPAN2 sowohl in der Plasmamembran als auch im Zytosol der produzierenden Zellen lokalisiert war, wurden TSPAN3 und CD63 hauptsächlich als punktförmige Signale innerhalb der Zellen nachgewiesen (Abb. 6d). Darüber hinaus war die Produktion aller Arten von manipulierten Elektrofahrzeugen resistent gegen die Hemmung von Ceramid (ergänzende Abbildung). 7a), der ein Treiber eines anerkannten Exosomenproduktionswegs ist1,42.
a Größenverteilung von Elektrofahrzeugen aus transfizierten HEK-293T-Zellen. b Repräsentative Kryo-Elektronenmikroskop-Bilder von Elektrofahrzeugen. c Western Blots positiver und negativer Marker von Elektrofahrzeugen. d Zelluläre Lokalisierung von Tetraspaninen in transfizierten HEK-293T-Zellen. e Einzelvesikel-Durchflusszytometrie-Punktdiagramme von EVs nach Färbung mit APC-konjugierten CD9/CD63/CD81-Tetraspanin-Antikörpern. f Vulkandiagramme, die unterschiedlich angereicherte Proteine in Elektrofahrzeugen zeigen. Die roten Ziffern geben die Anzahl der unterschiedlich angereicherten Proteine an. Die Ergebnisse stammten von drei biologischen Replikaten. Quelldaten werden als Quelldatendatei bereitgestellt. Die Massenspektrometrie-Proteomikdaten wurden über das PRIDE-Partner-Repository mit der Datensatzkennung PXD043840 beim ProteomeXchange-Konsortium hinterlegt.
Um ein Verständnis ihrer Proteinsignaturen zu erhalten, wurden EVs mit den klassischen Pan-Oberflächenmarkern CD9/CD63/CD81 angefärbt und auf Einzelvesikelebene analysiert. Die Überexpression der Tetraspanine wirkte sich unterschiedlich auf die Ausbeute an Gesamt-EVs aus (definiert als alle Fluoreszenzereignisse, ergänzende Abb. 7b) und technische Elektrofahrzeuge (definiert als mNG).+ Ereignisse, ergänzende Abb. 7c). Interessanter ist, dass nur ein kleiner Teil der mit TSPAN2 und TSPAN3 entwickelten Elektrofahrzeuge die drei klassischen EV-Marker auf der Oberfläche aufwies (Abb. 6e). Darüber hinaus wurde die EV-Oberflächenexpressionsanalyse von 39 Proteinen mittels Multiplex-Bead-basierter Durchflusszytometrie durchgeführt43 ergab, dass sich die Oberflächenepitopzusammensetzung von TSPAN2-positiven EVs von der von CD9/CD63/CD81-positiven EVs unterschied (ergänzende Abb. 7d). Neben Oberflächenproteinen zeigten eingehende proteomische Analysen von Elektrofahrzeugen eine Fülle unterschiedlich angereicherter Proteine für TSPAN2 (106 entenreichert und 94 angereichert) und TSPAN3 (43 entenreichert und 77 angereichert) im Vergleich zu CD63-manipulierten Elektrofahrzeugen. CD9/CD63/CD81 gehörten zu den Proteinen, die in TSPAN2/TSPAN3-technisch hergestellten EVs signifikant herunterreguliert wurden, was mit den Ergebnissen der Einzelvesikel- und Bead-basierten Durchflusszytometrie übereinstimmt. Basierend auf einer Analyse der Genontologie waren im Vergleich zu Wildtyp-EVs aus HEK293T-Zellen alle drei Arten von manipulierten EVs (CD63, TSPAN2 und TSPAN3) mit Metaboliten-Interkonvertierungsenzymen, proteinmodifizierenden Enzymen und RNA-Metabolismusproteinen angereichert (>10 %). , aber abgereichert (>10 %) an extrazellulären Matrixproteinen (ergänzende Abb. 8). Als nächstes verglichen wir die Gesamtproteinzusammensetzung mit einem Principal Clustering Analysis-Tool und stellten fest, dass sich gentechnisch veränderte EVs von Wildtyp-EVs und in geringerem Maße auch voneinander unterschieden (ergänzende Abbildung). 7e). Interessanterweise wirkte sich die Überexpression von TSPAN2 im Vergleich zu WT-EVs negativ auf die CD63- und TSPAN3-Spiegel aus, was auf eine Konkurrenzbeziehung hinweisen könnte. Die Überexpression von TSPAN3 führte andererseits zu einem leichten Anstieg der CD63-Spiegel, was auf eine positive Regulation hindeutet (ergänzende Abb. 7f). Insgesamt veranschaulichen diese Ergebnisse, dass TSPAN2/TSPAN3-basiertes Engineering zu EV-Subpopulationen führt, die sich von CD63 unterscheiden.
Von TSPAN2 und TSPAN3 entwickelte Elektrofahrzeuge als Liefermodalitäten
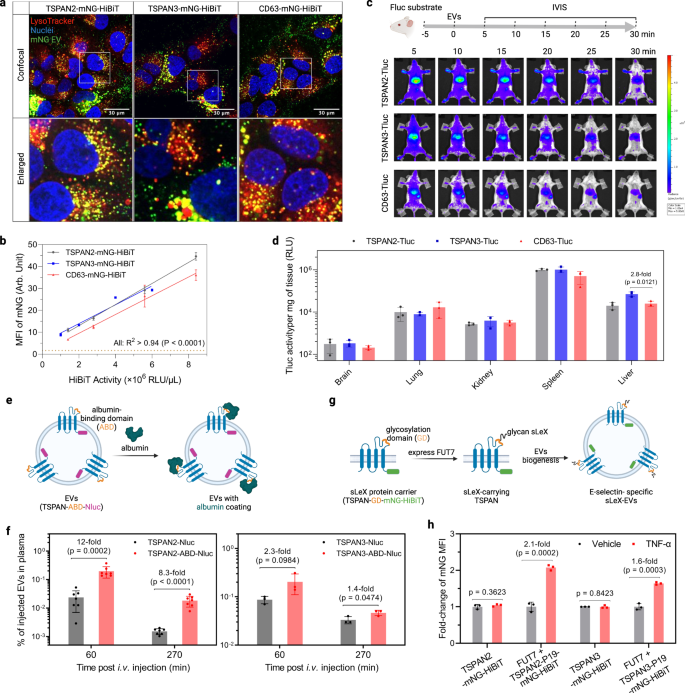
Um herauszufinden, ob TSPAN2/TSPAN3-konstruierte Elektrofahrzeuge für die zelluläre Abgabe geeignet sind, haben wir ihr Abgabepotenzial in vitro und in vivo untersucht. Zunächst wurden Huh-7-Zellen mit mNG-markierten EVs behandelt, um ihre subzelluläre Position in den Empfängerzellen zu untersuchen. Das starke punktförmige gelbe Signal deutete eindeutig auf eine effiziente Internalisierung und den Transport zu Lysosomen hin (Abb. 7a). Die Quantifizierung des zellulären MFI mithilfe der Durchflusszytometrie ergab eine etwas bessere Aufnahmeeffizienz für mit TSPAN2/TSPAN3 hergestellte Elektrofahrzeuge im Vergleich zu mit CD63 hergestellten Elektrofahrzeugen (Abb. 7b). Für EV-Verteilungsstudien an Mäusen wurden gleiche Mengen manipulierter EVs (basierend auf der Tluc-Aktivität) intravenös verabreicht und in Echtzeit mit einem In-vivo-Bildgebungssystem verfolgt (ergänzende Abbildung). 9a und Abb. 7c). Bei allen drei Arten von manipulierten Elektrofahrzeugen beobachteten wir eine schnelle Verteilung in Leber und Milz innerhalb von 5 Minuten (Abb. 7c) und ein deutlicher Rückgang der Ganzkörperaktivität über 30 Minuten (ergänzende Abbildung). 9c, P = 0.0006, Kruskal-Wallis-Test). TSPAN2- und TSPAN3-konstruierte Elektrofahrzeuge schienen eine etwas höhere Ganzkörperretention zu verleihen als CD63-konstruierte Elektrofahrzeuge (ergänzende Abbildung). 9b). Ergebnisse nachfolgender Ex-vivo-Messungen stützten die überwiegende Anreicherung manipulierter Elektrofahrzeuge in Leber und Milz (Abb. 7d). Zusammengenommen werden TSPAN63- und TSPAN2-technisch hergestellte Elektrofahrzeuge wie CD3-technisch hergestellte Elektrofahrzeuge in vitro und in vivo effizient von Zellen aufgenommen.
a Huh-7-Zellen wurden 4 Stunden lang mit EVs behandelt und mit LysoTracker angefärbt, um Lysosomen sichtbar zu machen. Gezeigt werden konfokale Mikroskopiebilder repräsentativer Regionen des gesamten Bohrlochs. Der Versuch wurde einmal durchgeführt. b Huh-7-Zellen wurden 8 Stunden lang mit Elektrofahrzeugen behandelt. Der zelluläre mNG-MFI wurde mittels Durchflusszytometrie quantifiziert. Die Daten werden als Mittelwert ± Standardabweichung von drei biologischen Replikaten angezeigt. Der Grad der Korrelation wurde mit linearer Regression analysiert und wird als Anpassungsgüte angezeigt (R2) und Bedeutung der Steigung ungleich Null (P). c Bioverteilung von Elektrofahrzeugen bei Mäusen. NMRI-Mäusen wurde intraperitoneal injiziert d-Luciferin-Substrat. Fünf Minuten später wurde den Mäusen die gleiche Menge manipulierter EVs (basierend auf der Tluc-Aktivität) intravenös injiziert und mit IVIS abgebildet. Anschließend wurden wichtige Organe für Ex-vivo-Biolumineszenzmessungen gesammelt. Es werden repräsentative IVIS-Bilder angezeigt. N = 3. d Tluc-Aktivität in Organen ex vivo nach IVIS. Die Ergebnisse werden als Mittelwert ± Standardabweichung von drei Mäusen angezeigt. e Schema zur Erzeugung albuminbindender EVs. EVs wurden aus HEK-293T-Zellen gesammelt, die die Fusionsproteine stabil exprimierten. f Albuminbindende EVs wurden intravenös injiziert und ihre Konzentration im Plasma bestimmt. Die Daten werden als Mittelwert ± Standardabweichung angezeigt. N = 7 (für TSPAN2-bezogen) oder 3 (für TSPAN3-bezogen). g Schema der sLeX-Anzeige auf Elektrofahrzeugen. EVs wurden aus HEK-293T-Zellen gesammelt, die die Komponenten stabil exprimierten. h HUVEC-Zellen wurden 2 Stunden lang durch TNF-α aktiviert und 6 Stunden lang mit EVs behandelt. Der zelluläre mNG-MFI wurde mittels Durchflusszytometrie quantifiziert und wird als Faltungsänderung gegenüber nicht aktivierten Zellen angezeigt. c, e, g Erstellt mit BioRender.com. Die Daten werden als Mittelwert ± Standardabweichung von drei biologischen Replikaten angezeigt. Zweiseitiger Student t prüfen. Quelldaten werden als Quelldatendatei bereitgestellt.
Nachdem wir die Lade- und Lieferkapazität von TSPAN2 und TSPAN3 für luminale Fracht ausführlich vorgestellt hatten, untersuchten wir als nächstes ihr Potenzial für EV-Oberflächenanzeigeanwendungen. Die großen extrazellulären Schleifen (LELs) einiger Tetraspanine wurden bereits für solche Anwendungen genutzt und angesichts der topologischen Ähnlichkeiten von Tetraspanin-Proteinen versuchten wir, die LELs von TSPAN2 und TSPAN3 zu entwickeln. Es hat sich gezeigt, dass die Insertion einer Albumin-bindenden Domäne (ABD) in die UEG von CD63, CD9 und CD81 die Plasmazirkulationszeit von Elektrofahrzeugen drastisch verlängert44. Mit der gleichen Strategie wurde ein ABD zur Quantifizierung in die UEG von TSPAN2 und TSPAN3 mit Nluc am C-Terminus kloniert (Abb. 7e). EVs wurden aus HEK-293T-Zellen gesammelt, die TSPAN-ABD-Nluc-Fusionsproteine stabil exprimieren (ergänzende Abb. 9c) und auf ihre Albumin-Bindungsfähigkeit untersucht. Wie erwartet banden nur ABD-anzeigende EVs an Albumin (ergänzende Abbildung). 9d). Als nächstes wurden diese EVs Mäusen intravenös injiziert und die EV-Konzentrationen im Plasma wurden auf der Grundlage von Nluc zu verschiedenen Zeitpunkten gemessen. Im Vergleich zu mit Tetraspanin hergestellten Wildtyp-EVs wiesen ABD-enthaltende EVs eine deutlich höhere Konzentration im Plasma auf, insbesondere wenn TSPAN2 als Gerüstprotein verwendet wurde (Abb. 7f).
In einem anderen Beispiel wollten wir ein aktiviertes endothelzellspezifisches Targeting durch Oberflächenpräsentation des Glykanliganden Sialyl Lewis X (sLeX) erreichen.45. Daher wurde ein 19-mer sLeX-Peptidträger (P19) in die LEL jedes Tetraspanin-Proteins mit mNG-HiBiT am C-Terminus eingefügt. In Gegenwart von Fucosyltransferase VII (FUT7) wird P19 glykosyliert, um sLeX anzuzeigen (Abb. 7g). Basierend auf dieser Überlegung wurden sLeX-EVs aus HEK-293T-Zellen hergestellt, die FUT7 und TSPAN-P19-mNG-HiBiT stabil exprimieren (ergänzende Abbildung). 9c). Ihre Aufnahme wurde in TNF-α-aktivierten Endothelzellen untersucht, die E-Selectin, den Hauptrezeptor für sLeX, exprimieren. Mit Tetraspanin hergestellte Wildtyp-EVs wurden in ähnlicher Weise in nicht aktivierten und aktivierten Endothelzellen aufgenommen, während sLeX-EVs, die entweder TSPAN2 oder TSPAN3 als Gerüst verwendeten, eine bevorzugte Aufnahme durch aktivierte Endothelzellen zeigten (Abb. 7h). Insgesamt zeigt dies die Machbarkeit von TSPAN2 und TSPAN3 im Hinblick auf die gleichzeitige Konstruktion des LEL für die Oberflächendarstellung und des C-Terminus für die luminale Ladungsbeladung und unterstreicht damit ihr Potenzial für therapeutische Anwendungen.
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Automobil / Elektrofahrzeuge, Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- BlockOffsets. Modernisierung des Eigentums an Umweltkompensationen. Hier zugreifen.
- Quelle: https://www.nature.com/articles/s41467-023-40453-0