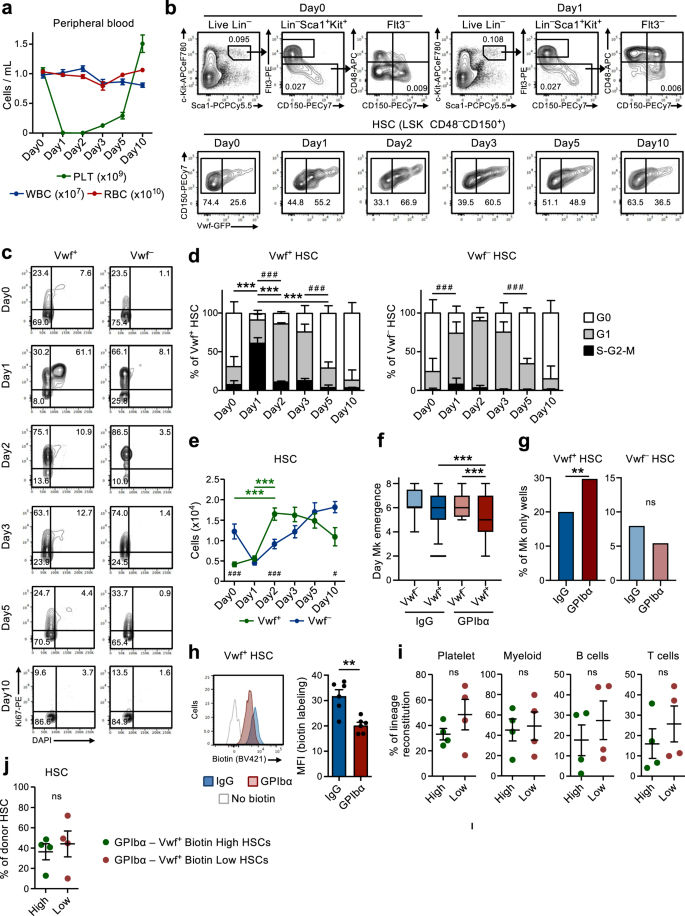
Akuter Blutplättchenmangel regt ruhende HSCs schnell zur Proliferation an
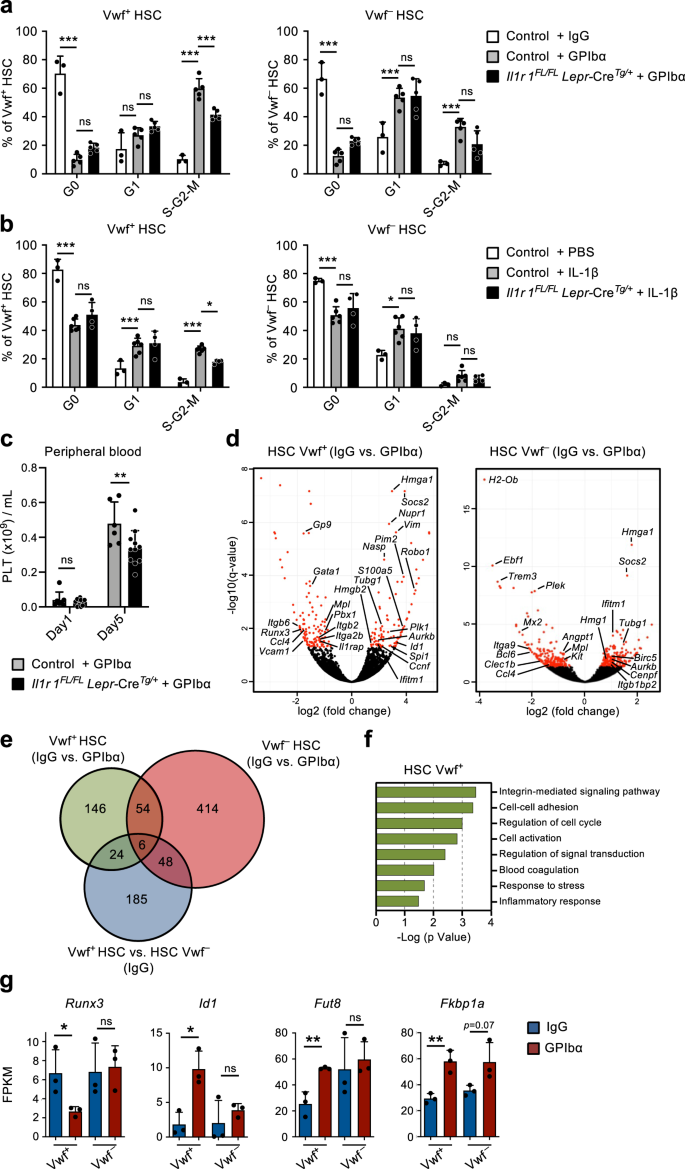
In Übereinstimmung mit früheren Studien9, Verabreichung einer Einzeldosis Anti-GPIbα-Antikörper gegen Vwf-GFP-Mäuse haben, um die bei Patienten mit Immunthrombozytopenie purpura (ITP) beobachtete Thrombozytopenie nachzuahmen, innerhalb eines Tages schnell und effizient Blutplättchen abgebaut, ohne andere Blutzelllinien wesentlich zu beeinträchtigen (Abb. 1a). Dies ging mit einer schnellen (innerhalb eines Tages) Zellzyklusaktivierung von Lin einher-Sca1+c-Kit+ (LSK) Flt3-CD48-CD150+ HSCs. Die Rekrutierung in den aktiven Zellzyklus wurde bevorzugt innerhalb beobachtet Vwf-GFP+ (Vwf+) HSC-Fach (Abb. 1b–d), das an plättchenabhängigen HSCs angereichert ist, aber überwiegend multilinienrekonstituierende HSCs enthält9,18. Während über 60 % von Vwf+ LSKFlt3-CD48-CD150+ HSCs traten nur zu einem kleinen Teil in die S-G2-M-Phase des Zellzyklus ein Vwf-GFP- (Vwf-) HSCs traten in S-G2-M ein. Dennoch sind die meisten Vwf- HSCs wechselten von einem Ruhestadium (G0) zu einem stärker aktivierten G1-Stadium (Abb. 1c, d).
(Bezogen auf ergänzende Abbildungen. 1 machen 2). a Kinetische Analyse der Parameter peripherer Blutzellen nach Verabreichung von Anti-GPIbα-Antikörpern. Mäuse vom Tag 0 wurden mit IgG-Isotyp-Kontrollantikörper behandelt. Die Daten stellen den Mittelwert ± SEM von 10 (Tag 0), 13 (Tag 1), 10 (Tag 2), 9 (Tag 3), 8 (Tag 5) und 7 (Tag 10) Mäusen aus 14 unabhängigen Experimenten dar. PLT-Blutplättchen, weiße WBC-Blutkörperchen, rote RBC-Blutkörperchen. b Repräsentative FACS-Profile und Gating-Strategie von Vwf-GFP+ (Vwf+) und Vwf-GFP- (Vwf-) LSKFlt3-CD150+CD48- HSCs zu den angegebenen Zeitpunkten nach der Erschöpfung der Blutplättchen. Die Zahlen in Gates/Quadranten geben die Häufigkeit (Durchschnitt aller analysierten Mäuse) der Gated-Zellpopulation unter den gesamten lebenden Zellen (obere Felder) oder unter den HSCs (untere Felder) an. c, d Zellzyklusanalyse von Vwf+ und Vwf- LSKFlt3-CD150+CD48- HSCs zu den angegebenen Zeitpunkten nach der Erschöpfung der Blutplättchen. c Repräsentative Zellzyklus-FACS-Profile von Vwf+ (links) und Vwf- (rechts) HSCs in G0 (DAPI-Ki67-) G1 (DAPI-Ki67+) oder S-G2-M (DAPI+Ki67+) Phasen des Zellzyklus. Die Zahlen in den Toren stellen die Häufigkeiten (Durchschnitt aller analysierten Mäuse) der gesamten HSCs dar. d Mittelwert ± SD-Zellzyklusphasenverteilung von Vwf+ (links) und Vwf- (rechts) HSCs. Daten von 5 (Tag0), 5 (Tag1), 3 (Tag2), 5 (Tag3), 5 (Tag5) und 4 (Tag10) Mäusen aus 6 unabhängigen Experimenten. ***p <0.001; ** **.p < 0.01 für die S-G2-M-Zellzyklusfraktion; # # #p < 0.001 für die G1-Zellzyklusfraktion (beide unter Verwendung einer 2-Wege-ANOVA mit Tukey-Mehrfachvergleichen); e Absolute Zahlen von Vwf+ und Vwf- HSCs (pro 2 Beine, siehe Methoden). Mittelwert ± SEM-Daten von 8 (Tag0), 8 (Tag1), 7 (Tag2), 5 (Tag3), 6 (Tag5) und 5 (Tag10) Mäusen aus 9 unabhängigen Experimenten. ***p < 0.001 für Vwf+ HSC (2-Wege-ANOVA mit Tukey-Mehrfachvergleichen); #p <0.05 und ###p < 0.001 für den Vergleich von Vwf+ vs. Vwf- HSCs (2-Wege-ANOVA mit Sidaks Mehrfachvergleichen). Zeitpunkt des Erscheinens des ersten Mk (f) und Häufigkeit von Kolonien mit nur Mk-Zellen (g) in kultiviertem Einzel-Vwf-oder Vwf+ HSCs, die 16 Stunden nach der IgG- oder GPIbα-Behandlung aus Mäusen isoliert wurden. Daten von 138, 364, 147 und 451 Einzelzellkolonien, analysiert aus jeweils 5 biologischen Replikaten in 4 unabhängigen Experimenten. f Die mittlere Linie stellt den Median dar, die Kästchengrenzen stellen die 25–75-Perzentile dar, die Whiskers markieren die 5–95-Perzentile. Zellen außerhalb der 5–95-Perzentile werden als Ausreißer markiert. P Werte berechnet mit dem Kruskal-Wallis-Test mit Dunns Mehrfachvergleichen. g P Wert berechnet mit zweiseitigem exakten Fisher-Test. ***p <0.001; ** **.p < 0.01; *p < 0.05; ns, nicht signifikant (p > 0.05). h Biotin-Proliferationsanalyse von Vwf-GFP+ HSCs 2 Tage nach der IgG- oder GPIbα-Behandlung. Repräsentatives Diagramm (links) und mittlerer ± SD-MFI (normalisiert für den MFI der Kontrolle ohne Biotinmarkierung; rechts) von 6 Mäusen pro Gruppe in 3 unabhängigen Experimenten. **p < 0.01; berechnet mit zweiseitigem t-Test. Langzeitrekonstitution (16 Wochen) der Blutplättchen-, myeloischen und lymphoiden Zelllinien im Blut (i) und des BM HSC-Fachs (j) durch Biotin hoch und Biotin niedrig Vwf-GFP+ HSC-Fraktionen 2 Tage nach der Erschöpfung der Blutplättchen. Pro Maus werden 50 Zellen transplantiert. Die Daten stellen den Mittelwert ± SEM von 4 Spendern in 2 unabhängigen Experimenten dar. Jeder Punkt stellt den Mittelwert von 2 transplantierten Empfängermäusen pro Spender dar. ns, nicht signifikant (p > 0.05); berechnet mit zweiseitigen t-Tests. Siehe auch Ergänzende Abbildungen. 1 machen 2.
Als nächstes versuchten wir, die mechanistische Grundlage für die HSC-Aktivierung, die nach der Erschöpfung der Blutplättchen beobachtet wurde, weiter zu untersuchen. Der Anti-GPIbα-Antikörper bindet an GPIbα (CD42b), den Rezeptor für Thrombin und VWF19Dies führt unabhängig vom Fc-Rezeptor zur Thrombozytenaktivierung, Desialylierung und anschließenden Clearance20. GPIbα wird spezifisch in der Megakaryozytose (Mk)-Blutplättchenlinie exprimiert, auch auf MkPs, ist jedoch für unsere Studien wichtig und wurde bereits von anderen berichtet21Die GPIbα-Expression ist auf HSCs praktisch nicht nachweisbar (ergänzende Abb. 1a). Nach der anfänglichen Erschöpfung der Blutplättchen erholte sich die Zahl der Blutplättchen langsam, wobei die normale Zahl der Blutplättchen zwischen dem 5. und 10. Tag nach der Erschöpfung wiederhergestellt wurde (Abb. 1a). Bemerkenswerterweise führte dieser Blutplättchenabbau zu einem vierfachen Anstieg der Vwf-Zahl+ LSKFlt3-CD48-CD150+ HSCs um 2 Tage, während Vwf- Die HSCs stiegen nach einer anfänglichen Reduktion mit langsamerer Kinetik an (Abb. 1e). Anschließend wurde der Vwf+/Vwf- Das HSC-Verhältnis und die absoluten Zahlen normalisierten sich allmählich wieder, gleichzeitig mit der Normalisierung der Thrombozytenzahl (Abb. 1a, z). Der Anstieg des Vwf+ HSCs gingen auch mit einem selektiven Anstieg der Anzahl der LSK Flt3 einher-CD48+CD150+ Teilmenge der MPPs (Abb. 1b und ergänzende Abb. 1b) hat sich als Mk-voreingenommen erwiesen22. Darüber hinaus MkPs23 wurden wenige Tage nach der Erhöhung des Vwf ebenfalls deutlich erhöht+ HSCs, wohingegen erythroide (Pre-CFU-E) und myeloische (GMP) Vorläufer nicht signifikant betroffen waren (ergänzende Abb. 1c, d). Bemerkenswert, trotz ihrer robusten GPIbα-Expression und in Übereinstimmung mit dem Fc-unabhängigen Mechanismus, durch den der Antikörper zur Blutplättchenverarmung führt20, MkPs waren anfänglich leicht (wenn auch nicht signifikant) reduziert, wohingegen Mks im BM durch die Verabreichung von Antikörpern nicht abgereichert wurden (ergänzende Abbildung). 1d–g). Nach der schnellen anfänglichen Aktivierung kehrten die HSCs schnell wieder in den Ruhezustand zurück, wobei bereits 5 Tage nach der Blutplättchenverarmung eine normalisierte Phasenverteilung des Zellzyklus beobachtet wurde (Abb. 1c, d). Ein alternativer monoklonaler Antikörper (NIT E)20 erschöpfte Blutplättchen und aktiviertes Vwf+ und Vwf- Der HSC-Zellzyklus verläuft auf ähnliche Weise wie der Anti-GPIbα-Antikörper (ergänzende Abb. 2a, b). Die Behandlung mit GPIbα-Antikörpern ging mit einer leichten und vorübergehenden Splenomegalie mit erhöhten Vwf-Zahlen einher+ aber nicht Vwf- HSCs in der Milz (Ergänzende Abb. 2c, d).
Die Rekrutierung von ruhendem LSKFlt3-CD48-CD150+ Die Proliferation von BM-Zellen bei akuter Thrombozytenaktivierung und -depletion impliziert die Existenz eines Rückkopplungsmechanismus, durch den ruhende HSCs rekrutiert werden, um die Mk- und Thrombozytenhomöostase wiederherzustellen. Um zu untersuchen, ob HSCs von Mäusen mit Blutplättchenmangel bei der Erzeugung von Mks effizienter sind, verwendeten wir einen Einzelzell-Mk/GM-In-vitro-Differenzierungstest. Klonogenität eines einzelnen Vwf+ oder Vwf- LSKFlt3-CD48-CD150+ HSCs, die aus Mäusen in Homöostase (IgG) oder nach Thrombozytendepletion (GPIbα) isoliert wurden, waren ähnlich (~80 %; ergänzende Abb. 2e). Allerdings Single Vwf+ Aus Mäusen mit Blutplättchenmangel isolierte HSCs differenzierten schneller zu Mks als zu Vwf- HSCs von Mäusen mit Blutplättchenmangel oder Vwf+ HSCs, die aus Mäusen in Homöostase isoliert wurden (Abb. 1f) und erzeugte auch eine höhere Anzahl von Kolonien, die ausschließlich aus Mks bestanden (Abb. 1g und ergänzende Abb. 2f, g). Es wurde zuvor gezeigt, dass sich stammähnliche Mk-gebundene Vorläufer, die phänotypisch HSCs ähneln, als Reaktion auf Poly(I:C)-induzierte Thrombozytopenie vermehren24. Um daher definitiver festzustellen, dass LSKFlt3-CD48-CD150+ Zu den BM-Zellen, die als Reaktion auf die Anti-GPIbα-induzierte Thrombozytendepletion zur Proliferation induziert wurden, gehören echte, sich langfristig repopulierende HSCs. Wir verwendeten Doxycyclin-induzierbare (tet-ON) H2B-mCherry-Mäuse6,25. In diesem System führt ein Impuls einer Doxycyclin-Behandlung zum Einbau von mCherry-markierten Histonen in Nukleosomen, die sich bei der Zellproliferation gleichmäßig auf die Tochterzellen verteilen. In Übereinstimmung mit der Zellzyklusanalyse (Abb. 1c, d), führte die Anti-GPIbα-induzierte Thrombozytenverarmung zu einer erhöhten Proliferation von HSCs, was durch die erhöhte Verdünnung der mCherry-Markierung nach 3 Tagen belegt wurde (ergänzende Abb. 2h). Wichtig ist, dass FACS mCherry sortiert hatlo (proliferativ) LSKFlt3-CD48-CD150+ Aus Mäusen mit Blutplättchenmangel sortierte Zellen hatten in vivo ein langfristiges (LT; 16 Wochen) Multilinien-Rekonstitutionspotential (ergänzende Abb. 2i), was zeigt, dass durch Anti-GPIbα induzierter Blutplättchenabbau potente LT-HSCs zur Proliferation rekrutiert. Um Vwf direkter zu vergleichen+ Für HSCs, die aktiviert werden oder die nach der Erschöpfung der Blutplättchen in einem nicht-proliferierenden Zustand bleiben, verwendeten wir eine nicht-invasive Markierungsmethode, die auf der Injektion des N-Hydroxylsulfosuccinimid-Biotin-Derivats (Biotin) basiert, das die Membranproteine aller BM-Zellen effizient markiert26. Bei der Zellteilung werden markierte Membranproteine gleichmäßig auf die Tochterzellen verteilt, was die Analyse der Zellteilungsgeschichte in vivo ermöglicht. Ähnlich wie beim H2B-mCherry-Modell führte die Erschöpfung der Blutplättchen zu einer verringerten Biotinmarkierung von Vwf+ HSCs (Abb. 1h) und auch von Vwf- HSCs (ergänzende Abb. 2j). Die in den Zellzyklus- und Proliferationsanalysen von Vwf beobachteten Unterschiede- HSCs könnten möglicherweise die zuvor beschriebene hierarchische Beziehung zwischen Vwf widerspiegeln+ und Vwf- HSCs9. Dadurch vermehrt sich Vwf+ HSCs können sich in Vwf differenzieren- HCS, die die Geschichte der Biotin-Markierungsverdünnung fortführen. Wichtig ist, dass FACS Vwf sortiert hat+Biotinlo (proliferativ) LSKFlt3-CD48-CD150+ Zellen, sortiert von Mäusen mit Blutplättchenmangel (ergänzende Abb. 2k, l) hatte in vivo ein langfristiges (LT; 16 Wochen) Multilinien-Rekonstitutionspotenzial (Abb. 1i), was zeigt, dass durch Anti-GPIbα induzierter Blutplättchenabbau potente LT-HSCs zur Proliferation rekrutiert. Während die Blutplättchen wirksam wieder aufgefüllt wurden, wurde beim Vwf kein signifikanter Blutplättchen-Bias beobachtet+ HSCs, die sich als Reaktion auf die Erschöpfung der Blutplättchen vermehren, im Vergleich zu nicht-proliferativen (Biotin).Hi) Vwf+ HSCs (Abb. 1i). Unabhängig davon sind beide Biotinfraktionen von Vwf+ HSCs zeigten eine ähnliche LT-HSC-Rekonstitution (Abb. 1j) und waren insgesamt gleichermaßen effizient bei der Erzeugung des Vwf+ und Vwf- HSC-Kompartimente (Ergänzende Abb. 2m). Dies steht im Einklang mit der Rekrutierung funktionell definierter LT-HSCs für die Proliferation und mit der Tatsache, dass die relativen Anteile von Vwf+ und Vwf- HSCs normalisieren sich größtenteils wieder, sobald die Homöostase wiederhergestellt ist (Abb. 1b, z).
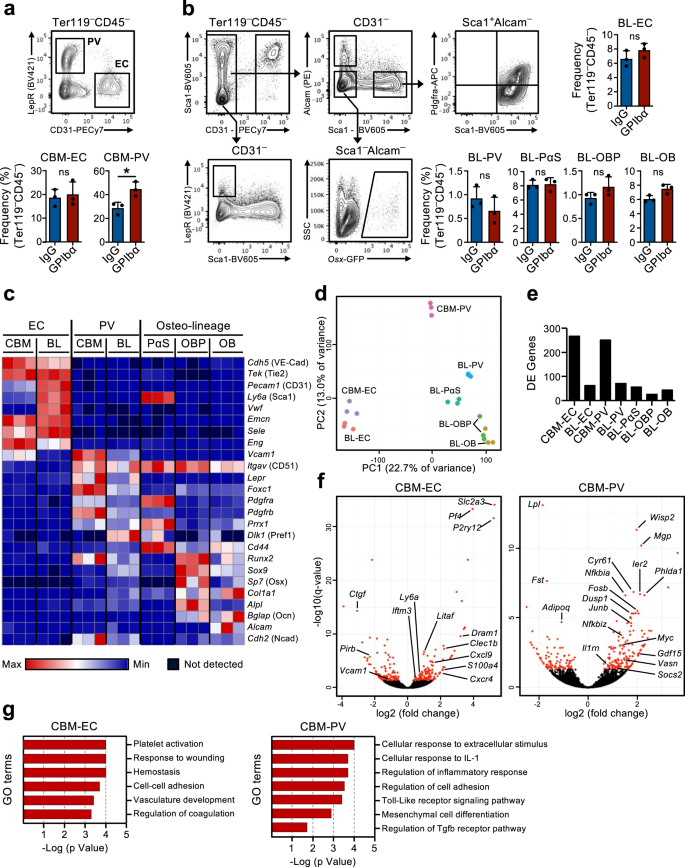
Transkriptionelle Neuprogrammierung der HSC-Nische als Reaktion auf akuten Blutplättchenmangel
Das Vorhandensein eines Rückkopplungsmechanismus, durch den ruhende HSCs als Reaktion auf die Erschöpfung der Blutplättchen zur Proliferation rekrutiert werden, impliziert, dass HSCs im BM in der Lage sein müssen, den Bedarf an Blutplättchenproduktion zu erkennen. Wir vermuteten, dass stromale Nischenzellen im Knochenmark an diesem Prozess beteiligt sein könnten. Tatsächlich wurden bereits früher Veränderungen in der BM-Nische nach der Erschöpfung der Blutplättchen vermutet16,17 Die Beteiligung spezifischer Nischenzellen an der Regulierung der HSC-Funktion in diesem Zusammenhang wurde jedoch nicht direkt nachgewiesen. Daher verwendeten wir eine globale RNA-Sequenzierungsanalyse zuvor charakterisierter BM-Nischenzellpopulationen sowie HSCs, um mögliche molekulare Wechselwirkungen zwischen diesen Zellen zu untersuchen, die an der HSC-Reaktion auf den Blutplättchenmangel beteiligt sind. Hierzu wurden aus zwei beschriebenen nicht-hämatopoetischen Zellen isoliert27,28,29 unterschiedliche anatomische Regionen in BM: die zentralen BM-Zellen (CBM) und die Knochenauskleidungszellen (BL-Zellen) (ergänzende Abb. 3a). Innerhalb der CD45-Ter119- Nicht-hämatopoetische Zellen sowohl in der BL- als auch in der CBM-Fraktion; unterschiedliche Nischenzellpopulationen werden als CD31 definiertHi Endothelzellen (EC) und CD31-Lepr+ perivaskuläre Zellen (PV). In der BL-Fraktion haben wir CD31 weiter definiert-Alcam-Pdgfrα+Sca1+ (PαS) mesenchymale Vorläufer sowie CD31-Alcam-Sca1-osx-GFP+ Osteoblasten-Vorläufer (OBP) und CD31-Alcam+Sca1- Osteoblasten (OB) (Abb. 2a, b). Die durchflusszytometrische Analyse dieser Zellen, die aus Mäusen in Homöostase und einen Tag nach der Blutplättchenverarmung isoliert wurden, ergab keine größeren Veränderungen in der Zellzusammensetzung, abgesehen von einem kleinen, aber signifikanten Anstieg der CBM-PV-Zellen (Abb. 2a, b). Die RNA-Sequenzierungsanalyse zeigte eine deutliche Häufung der verschiedenen Endothel-, Mesenchym- und HSC-Populationen (ergänzende Abbildung). 3b). Die Expression bekannter Marker, die die unterschiedlichen Nischenzellpopulationen definieren (Abb. 2c und ergänzende Daten 1) und verschiedener hämatopoetischer Regulatoren, gruppiert nach Muster der Genexpression (ergänzende Abb. 3c und ergänzende Daten 1), bestätigten weiter ihre unterschiedlichen Zellidentitäten. Darüber hinaus zeigte die Hauptkomponentenanalyse (PCA) der Nischenzellpopulationen die Trennung der endothelialen und mesenchymalen Abstammungszellen entlang der Hauptkomponentenachse (PC)1 und eine weitere Trennung der mesenchymalen Populationen entlang der PC2-Achse basierend auf dem Differenzierungsstadium (Abb. 2d). Die Analyse der differentiellen Genexpression, bei der Nischenzellen verglichen wurden, die aus Mäusen in der Homöostase und einen Tag nach der Blutplättchenverarmung isoliert wurden, zeigte eine hohe Anzahl differentiell exprimierter (DE) Gene in CBM-EC-Zellen (1 Gene) und CBM-PV-Zellen (266 Gene) (Abb . 2e, f und ergänzende Daten 2, 3). Im Gegensatz dazu wurde in anderen Nischenpopulationen, einschließlich der entsprechenden knochenassoziierten BL-EC und BL-PV, eine viel geringere Anzahl von DE-Genen nachgewiesen (Abb. 2e, f, Ergänzende Abb. 3d, e und ergänzende Daten 2-4), was auf eine bevorzugte Beteiligung der CBM-Nische an der Reaktion auf Thrombozytopenie hindeutet. Die Analyse der Genontologie (GO), die an den DE-Genen von CBM-EC durchgeführt wurde, zeigte biologische Prozesse auf, die mit der Aktivierung/Koagulation von Blutplättchen verbunden sind (Pf4, Clec1b, P2ry12), Reaktion auf Stress (Iftm3, Litaf, S100a4) und Zelladhäsion (Vcam1, Ctgf) (Feige. 2g und ergänzende Daten 5). Die GO-Analyse der CBM-PV-DE-Gene ergab biologische Prozesse, die mit Entzündungen und insbesondere mit der zellulären Reaktion auf das entzündungsfördernde Interleukin-1 (IL-1) verbunden sind (Abb. 2g und ergänzende Daten 5). Weitere in CBM-PV-Zellen hervorgehobene biologische Prozesse waren die Toll-like-Rezeptor (TLR)-4-Signalisierung, bei der Signalwege stromabwärts des Rezeptors teilweise mit der IL-1-Signalisierung geteilt werden, sowie die mesenchymale Differenzierung und die TGFβ-Signalisierung (Vasn, Fst, Wisp2, Cyr61) (Feige. 2f, g).
(Bezogen auf ergänzende Abb. 3). FACS-Analyse und Gating-Strategien zur Sortierung von Endothel- und Stromazellen im zentralen Knochenmark (CBM; a) und Knochenauskleidung (BL; b) Zellkompartimente von Mäusen 1 Tag nach Blutplättchenmangel (GPIbα-Antikörperbehandlung). Kontrollmäuse erhielten Isotyp-Kontrollantikörper (IgG). Balkendiagramme stellen mittlere ± SD-Häufigkeiten (%) jeder Zellpopulation im gesamten nicht-hämatopoetischen CD45 dar-Ter119- Zellen. Die Daten stammen von 3 Mäusen pro Gruppe in 3 (a) und 2 (b) unabhängige Experimente. *p < 0.05; ns nicht signifikant (p > 0.05); Bewertet durch zweiseitigen t-Test. c-g RNA-Sequenzierungsanalyse der Endothel-/Stromazellkompartimente von Mäusen 1 Tag nach der Thrombozytendepletion. c Expression (FPKM) von Genen, die die verschiedenen Nischenzellpopulationen charakterisieren. d Hauptkomponentenanalyse der normalisierten Genexpression der verschiedenen untersuchten Zellpopulationen. e Anzahl der differentiell exprimierten (DE) Gene zwischen IgG- und GPIbα-behandelten Mäusen (angepasst). p Wert (q)<0.05), in jeder untersuchten Nischenzellpopulation. f Vulkangrundstücke und g Genontologie (GO) bezeichnet die Analyse von Genen, die in CBM-Endothelzellen (EC) und Lepr. unterschiedlich exprimiert werden+ perivaskuläre (PV) Zellen. In f, rote Punkte zeigen deutlich DE-Gene an (q < 0.05. Für alle Panels stellen die Daten den Mittelwert ± SD FPKM von 3 biologischen Replikaten aus 2 unabhängigen Experimenten dar. OB-Osteoblasten, OBP-Osteoblast-Vorläufer, PαS Pdfgrα+Sca1+ mesenchymale Vorläufer. Siehe auch ergänzende Abbildung. 3.
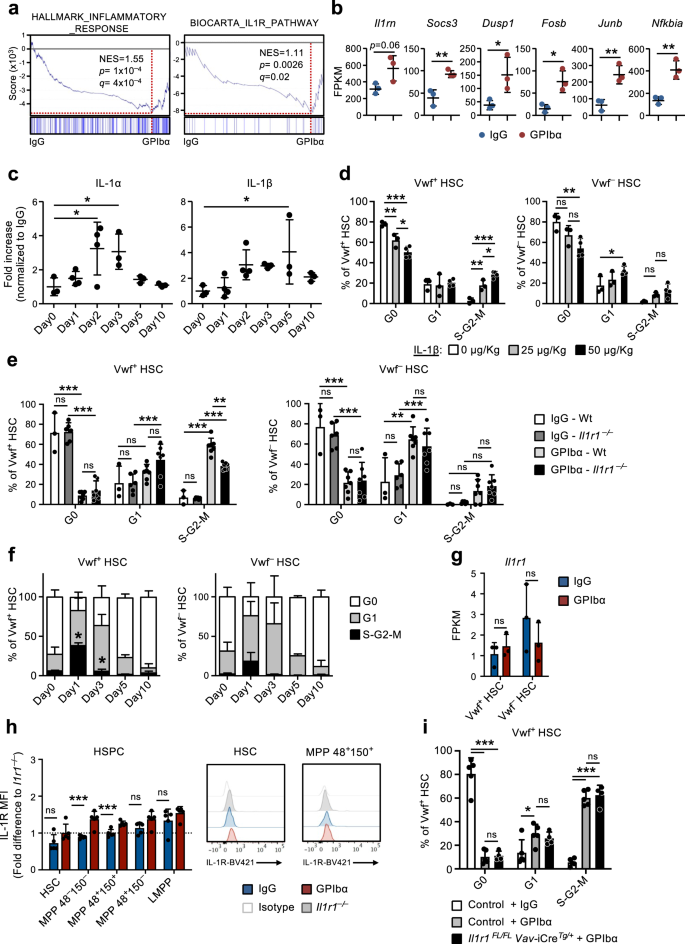
Die IL-1-Signalübertragung in nicht-hämatopoetischen Zellen ist entscheidend für die HSC-Reaktion auf den Blutplättchenmangel
Die Gen-Set-Anreicherungsanalyse (GSEA) bestätigte die Anreicherung von Genen, die mit der Entzündungsreaktion und der IL-1-Rezeptorsignalisierung verbunden sind, die in CBM-PV-Zellen beobachtet wurde, die aus GPIbα-behandelten Mäusen isoliert wurden (Abb. 3a). Diese Gene enthalten Il1rn (IL-1-Zielgen und IL-1-Signalweg-Antagonist), Socs3 machen Dusp1 (Regulatoren des IL-1-Signalwegs) und Fosb, Junb machen Nfkbia (Komponenten von Signalwegen, die stromabwärts der IL-1-Signalkaskade aktiviert werden) (Abb. 3b). Um die Rolle der sterilen Entzündung in diesem Prozess weiter zu untersuchen, analysierten wir die Konzentrationen verschiedener proinflammatorischer Zytokine in der BM-extrazellulären Flüssigkeit von mit GPIbα behandelten Mäusen. Diese Analyse ergab einen signifikant erhöhten IL-1α- und IL-1β-Spiegel nach der Erschöpfung der Blutplättchen (Abb. 3c), wobei die Kinetik parallel zur Expansion und anschließenden Normalisierung von Vwf verläuft+ HSC (Abb. 1e). Ein ähnlicher anfänglicher Anstieg wurde auch für TNFα beobachtet, obwohl dieser über den Zeitpunkt hinaus anhielt, zu dem Vwf auftrat+ Der HSC-Zellzyklusstatus hatte sich normalisiert (ergänzende Abb. 4a). Andere entzündliche Zytokine blieben weitgehend unverändert (IL-6 und IL-12) oder verringerten sich in späteren Stadien (INFγ) nach der Thrombozytendepletion (ergänzende Abb. 4a). Es wurde gezeigt, dass IL-1 im Steady-State hauptsächlich von zirkulierenden T-Zellen (IL-1α) und Granulozyten (IL-1β) produziert wird.30. In unseren Datensätzen wird beides auf IL-1-Expression analysiert Il1a machen Il1b waren in den verschiedenen Nischenzellpopulationen sowie in HSCs größtenteils nicht nachweisbar (ergänzende Abb. 4b), während primäre Mks (ergänzende Abb. 4c, d) zeigte einen hohen Ausdruck, insbesondere von Il1a (Ergänzende Abb. 4b).
(Bezogen auf ergänzende Abb. 5). a Genset-Anreicherungsanalyse (GSEA) globaler Genexpressionsdaten von CBM-PV-Zellen für die angegebenen Gensets. NES, normalisierter Anreicherungs-Score (oder skalierter Score). b Expression von Genen, die mit dem IL-1-Signalweg verbunden sind, in CBM-PV-Zellen 1 Tag nach der Thrombozytendepletion. Die Daten stellen den Mittelwert ± SD FPKM von 3 biologischen Replikaten aus 2 unabhängigen Experimenten dar. **p < 0.01; *p < 0.05 (zweiseitiger t-Test). c Mittlere ± SD-Spiegel von IL-1α und IL-1β in der aus Mäusen isolierten extrazellulären Knochenmarkflüssigkeit zu den angegebenen Zeitpunkten nach der Thrombozytendepletion (GPIbα-Antikörperbehandlung). Kontrollmäuse (Tag 0) erhielten Kontrollantikörper vom Isotyp (IgG). Die Daten stammen von 3 (Tag0), 4 (Tag1), 4 (Tag2), 3 (Tag3), 3 (Tag5) und 3 (Tag10) Mäusen aus 4 unabhängigen Experimenten. *p < 0.05 (einfache ANOVA mit Dunnetts Mehrfachvergleichen). d Zellzyklusanalyse von Vwf+ (links) und Vwf- (rechts) HSCs von Mäusen 1 Tag nach der intravenösen Verabreichung der angegebenen Mengen an IL-1β. Die Daten sind Mittelwerte ± Standardabweichung von 3 Mäusen, die 0 oder 25 μg/kg IL-4β erhielten, und 50 Mäusen, die 1 μg/kg IL-2β erhielten, in XNUMX unabhängigen Experimenten. Zellzyklusanalyse von Vwf+ (links) und Vwf- (rechts) HSCs von Wt und Il1r1- / - Mäuse 1 Tag (e) oder für HSCs von Il1r1- / - Mäuse zu den angegebenen Zeitpunkten (f) nach der Erschöpfung der Blutplättchen. e Mittelwert ± SD-Daten von 3 (IgG-Wt), 6 (IgG-Wt)Il1r1- / -) 7 (GPIbα -Wt) und 7 (GPIbα –Il1r1- / -) Mäuse aus 5 unabhängigen Experimenten. f Mittlere ± SD-Häufigkeiten von 6 (Tag 0), 7 (Tag 1), 3 (Tag 3), 3 (Tag 5) und 3 (Tag 10) Mäusen in 4 unabhängigen Experimenten. *p < 0.05 (im Vergleich zur gleichen Analyse von Wt Vwf+ und Vwf- HSCs in Abb. 1d). g, h Il1r1/IL-1R-Expressionsanalyse (h) auf RNA-Ebene durch RNA-Sequenzierung (FPKM) in Vwf+ und Vwf- HSCs und (i) auf Proteinebene mittels Durchflusszytometrie in HSPC-Untergruppen, isoliert aus Mäusen in Homöostase oder 1 Tag nach Blutplättchenmangel. h Mittelwert ± SD FPKM-Daten von 3 biologischen Replikaten pro Bedingung. i Mittelwert ± SD-Daten der mittleren Fluoreszenzintensität (MFI), normalisiert auf den MFI der äquivalenten Zellpopulation in Il1r1- / - Mäuse wurden im selben Experiment analysiert. Die Daten stammen von 5 Mäusen pro Bedingung in 2 unabhängigen Experimenten. i Zellzyklusanalyse von Vwf-tdTomato+ HSCs von Mäusen mit bedingter Deletion von Il1r1 in allen hämatopoetischen Zellen (Il1r1FL/FL Vav-CreTg/+) 1 Tag nach der Erschöpfung der Blutplättchen. Zu den Kontrollen gehören Vwf-tdTomato+ HSCs von Il1r1FL/+ Vav-CreTg/+, Il1r1+ / + Vav-CreTg/+ machen Beeindruckend-Cre+ / + Mäuse (die Genotypen ohne IL-1R-Funktionsverlust darstellen). Die Daten repräsentieren mittlere ± SD-Häufigkeiten von 5 (Kontroll-IgG), 5 (Kontroll-GPIbα) und 4 (Il1r1FL/FL Vav-CreTg/+-GPIbα)-Mäuse aus 3 unabhängigen Experimenten. ***p <0.001; ** **.p < 0.01; *p < 0.05; ns nicht signifikant (p > 0.05); unter Verwendung des zweiseitigen t-Tests (b, g, h) oder 2-Wege-ANOVA mit Tukey-Mehrfachvergleichen (d-f, i). Siehe auch ergänzende Abbildung. 4.
Die Verabreichung von rekombinantem IL-1 an Mäuse führte zur Zellzyklusaktivierung von Vwf+ und Vwf- HSCs (Abb. 3d), mit Vwf+ HSCs werden in einem höheren Ausmaß in der S-G2-M-Phase des Zellzyklus rekrutiert (ergänzende Abb. 4e), kompatibel mit IL-1, das die HSC-Aktivierung als Reaktion auf Anti-GPIbα-induzierte Thrombozytopenie vermittelt. Um diese Hypothese genauer zu untersuchen, induzierten wir bei Mäusen mit IL-1R-Mangel einen Blutplättchenmangel (Il1r1-/-), die über ein normales HSC-Fach verfügen30 und normale Thrombozytenzahlen. Wichtig ist, Il1r1-/- Mäuse zeigten eine signifikante Verringerung der Häufigkeit des aktiven Radfahrens (S-G2-M) Vwf+ HSCs nach Thrombozytenmangel (Abb. 3e, f) im Vergleich zu GPIbα-behandelten Wildtyp-Mäusen (Wt). Die Tatsache, dass Il1r1 Die Tatsache, dass ein Mangel die Zellzyklusaktivierung von HSCs als Reaktion auf die GPIbα-Behandlung nicht vollständig aufhob, legt nahe, dass andere (IL-1-unabhängige) Mechanismen beteiligt sind. In Übereinstimmung damit haben wir bereits einen Tag nach der Thrombozytenverarmung einen erhöhten THPO-Spiegel im Serum festgestellt9. Um andere Signale zu identifizieren, die möglicherweise mit IL-1 bei der Aktivierung von HSCs nach der Erschöpfung der Blutplättchen synergistisch wirken, analysierten wir die Expression bekannter HSC-Regulatoren, einschließlich Tgfb1 machen Pf4, zuvor an der HSC-Ruhe beteiligt31,32eschriebenen Art und Weise; und Fgf1, früher mit HSC-Proliferation verbunden32. Die RNA-Sequenzierungsanalyse verschiedener Nischenzellpopulationen ergab eine > 20-fache Hochregulierung von Pf4 in CBM-EC (Ergänzende Abb. 4f), während sich der Ausdruck von nicht ändert Tgfb1 machen Fgf1 wurde beobachtet. Wir untersuchten weiter die Proteingehalte dieser Regulatoren in der extrazellulären BM-Flüssigkeit nach der Erschöpfung der Blutplättchen. Im Einklang mit der Genexpressionsanalyse waren die TGFβ1- und FGF1-Spiegel nicht verändert, aber PF4 war einen Tag nach der GPIbα-vermittelten Thrombozytendepletion signifikant erhöht (ergänzende Abb. 4g). Angesichts der zuvor beschriebenen Rolle von PF4 bei der Auslösung der HSC-Ruhe31,33Es ist unwahrscheinlich, dass die beobachteten erhöhten PF4-Spiegel in der extrazellulären BM-Flüssigkeit die Aktivierung der HSC-Proliferation nach der Erschöpfung der Blutplättchen erklären.
Die RNA-Sequenzierung ergab sehr geringe Mengen (≈1 FPKM). Il1r1 Transkripte in HSCs (Abb. 3g). Die durchflusszytometrische Analyse zeigte nicht nachweisbare Mengen an IL-1R-Protein auf HSCs und niedrige Mengen auf mehreren MPP-Untergruppen (Abb. 3h und ergänzende Abb. 5a). Zusätzlich zum Fehlen einer nachweisbaren IL-1R-Expression wurde festgestellt, dass keines der in CBM-PV hochregulierten IL-1-Signalisierungsgene in Vwf hochreguliert war+ oder Vwf- HSC nach GPIbα-Behandlung (ergänzende Abb. 5b). Während wir in phänotypisch definierten HSCs keine nachweisbare IL-1R-Expression beobachteten, wurde bereits früher vermutet, dass IL-1 HSCs aktiviert30. Um zu untersuchen, ob IL-1 die Aktivierung von HSCs nach einer Anti-GPIbα-induzierten Thrombozytopenie direkt vermitteln kann, haben wir daher eine Thrombozytendepletion induziert Il1r1FL/FL Beeindruckend-iCreTg/+ Mäuse, die auf die Löschung von abzielen Il1r1 auf alle hämatopoetischen Zellen, einschließlich HSCs. Digitale Tröpfchen-PCR-Analyse von Vwf+ und Vwf- HSCs bestätigten eine Löschungseffizienz von >99 % Il1r1 floxte Allele durch Vav-iCre in beiden Vwf+ und Vwf- HSC-Teilmengen (ergänzende Abb. 5c). Im Gegensatz zu dem, was wir in der Keimbahn beobachtet haben Il1r1-/- Mäuse (Abb. 3e, f), Il1r1FL/FL Beeindruckend-iCreTg/+ Mäuse zeigten eine ebenso wirksame Anti-GPIbα-induzierte Zellzyklusaktivierung von Vwf+ HSC wie in Wt-Mäusen (Abb. 3i). Zusammengenommen zeigen diese Ergebnisse, dass die direkte IL-1R-Signalübertragung durch HSCs oder andere hämatopoetische Zellen nicht an der eindeutigen Aktivierung des Zellzyklus von HSCs als Reaktion auf die Erschöpfung der Blutplättchen beteiligt ist und vielmehr eine Rolle der nicht-hämatopoetischen IL-1-Signalisierung in diesem Prozess impliziert.
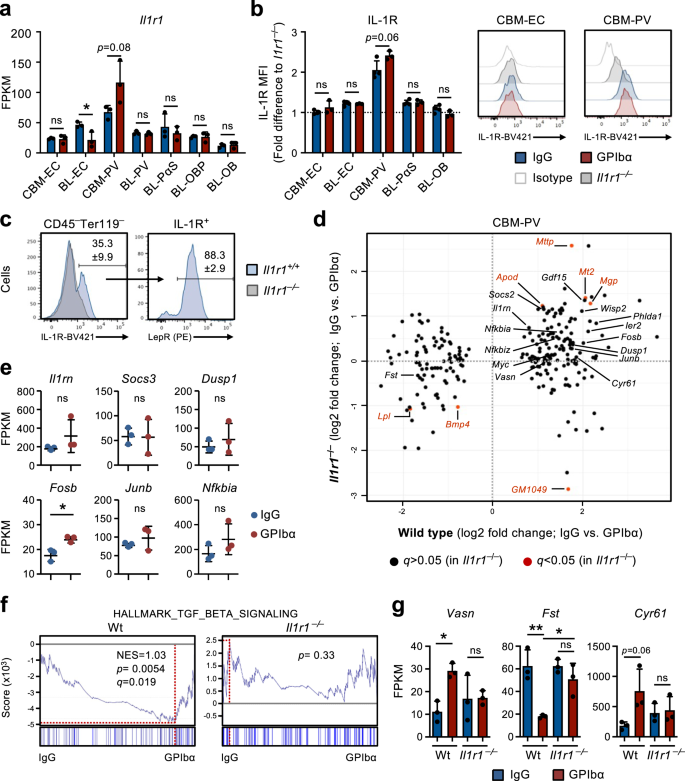
Die Erschöpfung der Blutplättchen führt zur Aktivierung der IL-1-Signalübertragung in perivaskulären Zellen
Unsere Studien in Il1r1FL/FLBeeindruckend-iCreTg/+Mäuse und RNA-Sequenzierungsanalysen von BM-Nischenzellen deuteten darauf hin, dass die IL-1-Signalübertragung in Nischenzellen und nicht in HSCs oder anderen hämatopoetischen Zellen eine Rolle bei der Feedback-Aktivierung von HSCs nach der Blutplättchenverarmung spielen könnte. Unter den Nischenzellen zeigten CBM-PV-Zellen die höchsten Transkriptionsniveaus von Il1r1 Ausdruck (Abb. 4a) und zeigten auch eine deutliche IL-1R-Proteinexpression, wohingegen alle anderen Stroma-/Endothelzellpopulationen praktisch negativ für eine nachweisbare IL-1R-Zelloberflächenexpression waren (Abb. 4b). Tatsächlich konnte fast die gesamte IL-1R-Expression in CBM Lepr zugeordnet werden+ PV-Zellen (Abb. 4c), die höhere Werte kritischer HSC-Regulatoren zum Ausdruck brachte, wie z Cxcl12 machen Kitl, im Vergleich zu endostalem IL-1R–/Lo BL-PV-Zellen (ergänzende Abb. 3c). Wichtig ist der Vergleich der DE-Gene in CBM-PV-Zellen aus Wt und Il1r1-/- Mäuse in Homöostase und nach GPIbα-Behandlung zeigten, dass die Mehrzahl der DE-Gene, die in Wt-Mäusen nach Blutplättchenmangel identifiziert wurden (Abb. 2f machen 3b) wurden in CBM-PV-Zellen nicht anders exprimiert als in blutplättchenarmen Zellen Il1r1-/- Mäuse (Abb. 4d), einschließlich der Gene, die direkt mit der Aktivierung des IL-1-Signalwegs verbunden sind (Abb. 4e). Zusätzlich zu den mit der IL-1-Signalübertragung verbundenen Genen fanden wir Hinweise auf eine IL-1R-abhängige DE von Signalwegen, die an der extrinsischen Regulierung der HSC-Proliferation beteiligt sind, einschließlich des TGFβ-Signalwegs (Abb. 2g machen 4d, f, g)34. Dies beinhaltete eine Hochregulierung von Vasn (Vasorin), ein direkter Inhibitor der TGFβ-Signalübertragung35 zuvor an der HSC-Aktivierung beteiligt36. Weitere IL-1R-abhängige DE-Gene enthalten Fst (Folistatin), ein direkter Inhibitor der BMP/Activin-Signalübertragung37 und es wurde zuvor gezeigt, dass es die Mk-Differenzierung aus hämatopoetischen Vorläuferzellen hemmt38und Gene, die mit Zelladhäsion und Integrinbindung/-regulation assoziiert sind (Abb. 2f, g machen 4d–g).
a RNA-Sequenzierungsanalyse von Il1r1 Genexpression (FPKM) in verschiedenen Nischenzellen, die aus Mäusen in Homöostase (IgG-behandelt) oder 1 Tag nach Blutplättchenmangel (GPIbα-behandelt) isoliert wurden. Mittelwert ± SD FPKM-Daten von 3 biologischen Replikaten aus 2 unabhängigen Experimenten. b, c Durchflusszytometrische Analyse der IL-1R-Expression in verschiedenen Endothel-/Stromazellpopulationen, die aus Mäusen in Homöostase oder 1 Tag nach Blutplättchenmangel isoliert wurden. Mittelwert ± SD-Daten der mittleren Fluoreszenzintensität (MFI), normalisiert auf den MFI der äquivalenten Zellpopulation in Il1r1- / - Mäuse, die im selben Experiment analysiert wurden (b). c Häufigkeit von Lepr+ PV-Zellen insgesamt IL-1R+ Nicht-hämatopoetische CBM-Zellen, isoliert aus Mäusen in Homöostase. Daten von 4 (IgG) und 3 (GPIbα) Mäusen in 2 unabhängigen Experimenten. d RNA-Sequenzierungsanalyse von isolierten CBM-PV-Zellen Il1r1+ / + machen Il1r1- / - Mäuse in Homöostase und nach Blutplättchenmangel auf die Expression von auf die CBM-PV-GPIbα-Behandlung reagierenden Genen. Daten von 3 biologischen Replikaten pro Zustand. e Expression von Genen, die mit dem IL-1-Signalweg verbunden sind, in isolierten CBM-PV-Zellen Il1r1- / - Mäuse 1 Tag nach Blutplättchenmangel. Mittelwert ± SD FPKM-Daten von 3 biologischen Replikaten pro Bedingung. GSEA globaler Genexpressionsdaten für den angegebenen Gensatz (f) und Expression (FPKM; Mittelwert ± SD) der angegebenen Gene (g), in CBM-PV-Zellen vom Wildtyp und Il1r1- / - Mäuse in Homöostase und nach Blutplättchenmangel. Daten von 3 Mäusen pro Bedingung. NES, normalisierter Anreicherungs-Score (oder skalierter Score). *p <0.05; ** **.p < 0.01; ns, nicht signifikant (p > 0.05); unter Verwendung des zweiseitigen t-Tests (a, b, e) und 2-Wege-ANOVA mit Tukey'a-Mehrfachvergleichen (g).
Die IL-1-Signalübertragung in perivaskulären Zellen ist entscheidend für die optimale Aktivierung von Vwf+ HSC
Um die Rolle der IL-1-Signalübertragung in CBM-PV-Zellen bei der Aktivierung von Vwf direkter zu untersuchen+ Als Reaktion auf Thrombozytopenie induzierten wir bei Mäusen eine Thrombozytendepletion mit bedingter Deletion von HSCs Il1r1 speziell in Lepr+ PV-Zellen (Ergänzende Abb. 5d). Il1r1FL/FLLepr-CreTg/+ Mäuse zeigten eine signifikante Verringerung des aktiv zyklischen (S-G2-M) Vwf+ HSCs im Vergleich zu mit Anti-GPIbα behandelten Kontrollmäusen (Abb. 5a). Die Verringerung der Zellzyklusaktivierung war vergleichbar mit der, die bei gelöschter Keimbahn beobachtet wurde Il1r1-/- Mäuse (Abb. 3e, f), was Lepr unterstützt+ CBM-PV-Zellen sind die Hauptzellen, die an der IL-1R-abhängigen Aktivierung von Vwf beteiligt sind+ HSCs als Reaktion auf Anti-GPIbα-induzierte Thrombozytopenie. Diese Ergebnisse werden durch die Verabreichung von rekombinantem IL-1 bestätigt Il1r1FL/FLLepr-CreTg/+ Mäuse führten zu einer verringerten Rekrutierung von Vwf+ HSCs in aktives S-G2-M (Abb. 5b). Darüber hinaus ist die gezielte Löschung von Il1r1 in Lepr+ PV-Zellen führten zu einer kleinen, aber signifikanten Verzögerung der Blutplättchenerholung nach der Erschöpfung der Blutplättchen (Abb. 5c).
(Bezogen auf ergänzende Abb. 6). a-c Analyse von Mäusen mit bedingter Löschung von Il1r1 in Lepr+ perivaskuläre Zellen (Il1r1FL/FL Lepr-CreTg/+) Mäuse nach Blutplättchenmangel. Zu den Kontrollen gehören Il1r1FL/+ Lepr-CreTg/+, Il1r1+ / + Lepr-CreTg/+, Il1r1FL/FL Lepr-CreTg/+ (nur IgG) und Lepr-Cre+ / + Mäuse. a Zellzyklusanalyse von Vwf+ und VWF- HSCs 1 Tag nach der Erschöpfung der Blutplättchen. Die Daten repräsentieren mittlere ± SD-Häufigkeiten von 3 (Kontroll-IgG), 5 (Kontroll-GPIbα) und 5 (Il1r1FL/FL Lepr-CreTg/+-GPIbα)-Mäuse aus 3 unabhängigen Experimenten. b Zellzyklusanalyse von Vwf+ und VWF- HSCs von Mäusen 1 Tag nach der intravenösen Verabreichung von 50 ug/kg IL-1β. Die Daten sind Mittelwerte ± SD von 3 (Kontroll-IgG), 6 (Kontroll-GPIbα) und 4 (Il1r1FL/FL Lepr-CreTg/+-GPIbα)-Mäuse aus 3 unabhängigen Experimenten. c Periphere Blutanalyse der Thrombozytenerholung zu den angegebenen Zeitpunkten nach der Thrombozytenverarmung. Mittelwert ± Standardabweichung der Thrombozytenzahlen von 6 (Kontrolle) und 11 (Il1r1FL/FL Lepr-CreTg/+) Mäuse in 3 unabhängigen Experimenten. d-g Differenzielle Genexpressionsanalyse in Vwf+ und Vwf- Aus Wildtyp-Mäusen isolierte HSCs 1 Tag nach Blutplättchenmangel (GPIbα-Behandlung). d Vulkandiagramme von Genen, die in Vwf unterschiedlich exprimiert werden+ und Vwf- HSCs. Rote Punkte zeigen Gene mit signifikanten Expressionsunterschieden an (angepasst). p Wert (q)<0.05). e Venn-Diagramm, das die Anzahl der unterschiedlich exprimierten Gene in Vwf zeigt+ und Vwf- HSCs nach der Erschöpfung der Blutplättchen und zwischen diesen HSC-Untergruppen in der Homöostase (IgG). f GO-Begriffe Analyse biologischer Prozesse/Wege, die in Vwf hochreguliert sind+ HSCs nach Thrombozytenmangel. g Expression (FPKM) von Genen, die mit der Activin/BMP-Signalisierung in Vwf assoziiert sind+ und Vwf- HSCs von Wt-Mäusen in Homöostase und 1 Tag nach Blutplättchenmangel. Alle Daten (d-g) stellen mittlere ± SD-FPKM-Daten von 3 biologischen Replikaten pro Genotyp und Zustand dar. *p <0.05; ** **.p <0.01; ***.p < 0.001; ns nicht signifikant (p > 0.05); unter Verwendung der 2-Wege-ANOVA mit Tukeys Mehrfachvergleichen (a, b), 2-Wege-ANOVA mit Sidaks Mehrfachvergleichen (c) und zweiseitiger t-Test (g). Siehe auch ergänzende Abbildung. 5.
Um weitere Einblicke in die Funktionsweise von Vwf zu erhalten+ HSCs werden als Reaktion auf die Anti-GPIbα-induzierte Thrombozytendepletion zur Proliferation rekrutiert. Wir führten eine RNA-Sequenzierung von Vwf durch+ und Vwf- HSCs. RNA-Sequenzierung von Vwf+ HSCs identifizierten 230 differentiell exprimierte Gene nach Thrombozytendepletion, von denen 170 ausschließlich differentiell im Vwf exprimiert wurden+ und nicht Vwf- HSCs, und 24 davon zeichneten bereits Vwf aus+ und Vwf- HSCs in der Homöostase, einschließlich der mit der Blutplättchen-/Mk-Linie assoziierten Gene (Abb. 5d, e, Ergänzende Abb. 5e, f und ergänzende Daten 6, 7). Vergleich von Vwf+ und Vwf- HSCs von Mäusen mit verminderter Blutplättchenzahl zeigten eine Anreicherung von Zellzyklus-Aktivierungsgenen in Vwf+ HSCs, was auf molekularer Ebene die bevorzugte Aktivierung von Vwf bestätigt+ HSCs als Reaktion auf die Erschöpfung der Blutplättchen (ergänzende Abb. 5g und ergänzende Daten 8). Gene, die in Vwf unterschiedlich exprimiert werden+ HSCs nach der Aktivierung und Depletion von Blutplättchen sind hauptsächlich mit der Integrinsignalisierung und der Zelladhäsion verbunden, die bekanntermaßen durch die TGFβ-Signalübertragung reguliert werden39, aber auch Zellzyklus, Blutgerinnung und Reaktion auf Stress/Entzündung (Abb. 5d–f). Während wir die Beteiligung anderer Signalwege an der Regulierung dieser Gene nicht ausschließen können, steht dies im Einklang mit der Herunterregulierung von Fst in CBM-PV-Zellen (Abb. 4g), die Kandidaten-Activin/BMP-Zielgene Runx3 machen Id140 wurden im Vwf jeweils herunter- bzw. hochreguliert+ aber nicht Vwf- HSCs nach der Erschöpfung der Blutplättchen (Abb. 5g). Bemerkenswert ist das Gen für die α1,6-Fucosyltransferase (Fut8), das die Aktivität der TGFβ- und Activin-Rezeptoren unterschiedlich reguliert41 und ist auch ein Regulator der Integrin-Signalisierung42 wurde speziell im Vwf hochreguliert gefunden+ HSCs nach der Erschöpfung der Blutplättchen. Darüber hinaus als Reaktion auf den durch Anti-GPIbα induzierten Blutplättchenabbau Vwf+ HSCs, aber nicht VWF – HSCs hochreguliert Fkbp1a, ein intrazellulärer Regulator der Smad-Signalübertragung, der die Intensität und Dauer der Signale stromabwärts der TGFβ-, Activin- und BMP-Rezeptoren moduliert43,44 (Feige. 5g). Zusammen mit der Herunterregulierung von Fst in CBM-PV-Zellen (Abb. 4g) deuten diese Daten darauf hin, dass eine Verlagerung von der ruheverstärkenden TGFβ-Signalisierung zur aktivierenden Activin/BMP-Signalisierung zu Veränderungen der Integrinaktivität, der Zelladhäsion und des Zellzyklusstatus von HSCs als Reaktion auf die akute Aktivierung und Erschöpfung der Blutplättchen führen kann.
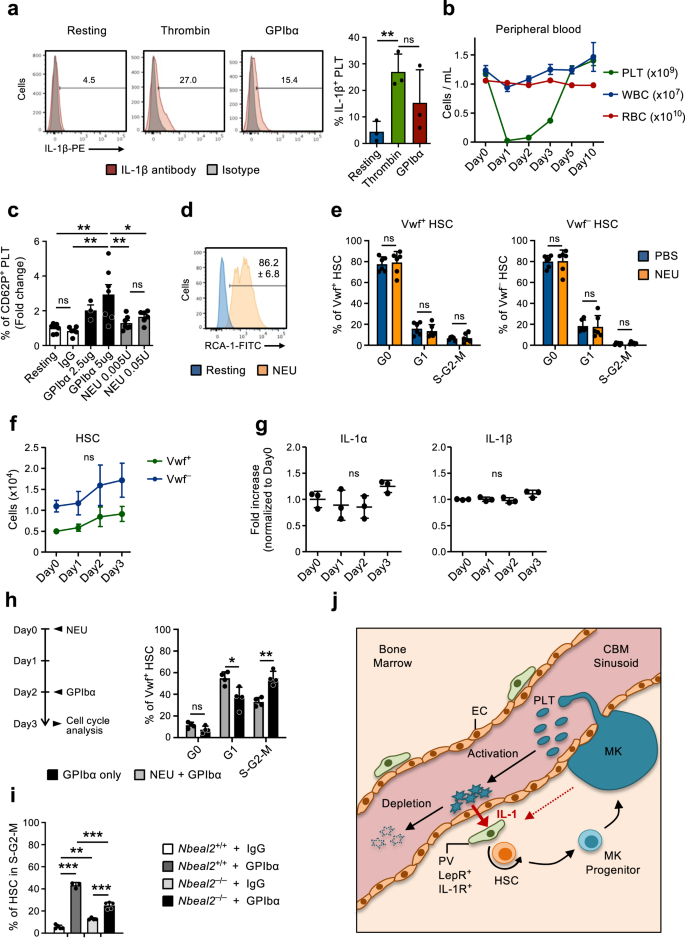
Die Aktivierung der Blutplättchen ist für die HSC-Reaktion auf die Erschöpfung der Blutplättchen von entscheidender Bedeutung
Die Genexpressionsanalyse von CBM-ECs ergab mehrere Gene, die bei Blutplättchenmangel hochreguliert wurden und mit der Blutplättchenaktivierung und -koagulation verbunden sind (Abb. 2f, g). Dies steht im Einklang mit dem Mechanismus, durch den Blutplättchen häufig verbraucht werden45, hier nachgeahmt durch GPIbα-vermittelte Thrombozytendepletion, die durch die Induktion einer Fc-unabhängigen Thrombozytenaktivierung funktioniert, was zur Translokation der Thrombozyten-Sialidase-Neuraminidase-1 (NEU) zur Membran, zur Desialylierung und anschließenden Clearance in der Leber führt20. Darüber hinaus gelten Blutplättchen als wichtige Entzündungsmediatoren46,47 und die IL-1-Proteinexpression bei Aktivierung schnell hochregulieren (Abb. 6a), wie bereits von anderen gezeigt48,49,50. Dies unterstützt eine Rolle der Thrombozytenaktivierung und des anschließenden Verbrauchs bei der Vermittlung der hier beobachteten IL-1-abhängigen Aktivierung von Vwf+ HSCs als Reaktion auf Thrombozytopenie. Um diese Möglichkeit weiter zu untersuchen, behandelten wir Mäuse mit NEU51, was ähnlich wie bei der GPIbα-Behandlung (Abb. 1a) führt zu einer effizienten Thrombozytendepletion (Abb. 6b), umgeht aber die Thrombozytenaktivierung20. Während die GPIbα-Behandlung die Blutplättchen in vitro effizient aktivierte, wie durch Oberflächen-P-Selectin (CD62P)-Färbung gemessen wurde, führte die in vitro NEU-Behandlung nur zu einer sehr milden Blutplättchenaktivierung und nur bei hohen Konzentrationen (Abb. 6c). Die In-vitro-NEU-Aktivität wurde jedoch bestätigt Ricinus communis Markierung von Agglutinin I (RCA-1) (Abb. 6d), das spezifisch an desialylierte Proteine bindet20. Obwohl die Thrombozytenzahl in vivo mit der gleichen Effizienz abgebaut wurde, führte die NEU-Behandlung im Gegensatz zur Anti-GPIbα-Behandlung nicht zu einer Aktivierung des HSC-Zellzyklus (Abb. 6e) noch hat es die Zahl der Vwf wesentlich erhöht+ oder Vwf- HSCs (Abb. 6f), LSK Flt3-CD48+CD150+ MPPs, Prä-MegE und MkPs in BM (ergänzende Abbildung). 6a, b). Bemerkenswert ist, dass bei NEU-behandelten Mäusen die IL-1α- und IL-1β-Spiegel im BM weitgehend unverändert blieben (Abb. 6g). Diese Ergebnisse legen nahe, dass an der beobachteten IL-1-abhängigen Aktivierung von HSCs nicht der bloße Verlust von Blutplättchen, sondern der durch die Anti-GPIbα-Aktivierung induzierte Abbau von Blutplättchen beteiligt ist. Frühere Studien deuteten darauf hin, dass Mks und ihre sezernierten Faktoren eine Rolle bei der Regulierung der HSC-Ruhe/-Proliferation spielen31,32,33,52. Da Mks auch GPIbα exprimieren, haben wir, um die Rolle von Blutplättchen bei der beobachteten HSC-Aktivierung als Reaktion auf die Behandlung mit Anti-GPIbα-Antikörpern unabhängig von Mks genauer zu demonstrieren, den Anti-GPIbα-Antikörper Mäusen verabreicht, bei denen die Blutplättchen effizient mit NEU abgereichert worden waren -Behandlung (Abb. 6b), was die Anzahl der Mks nicht ändert33. Diese sequentielle NEU-GPIbα-Behandlung führte zu einer verringerten Zellzyklusaktivierung von Vwf+ HSCs im Vergleich zur GPIbα-Behandlung allein (Abb. 6h), was die Beteiligung von Blutplättchen an diesem Prozess bestätigt. Die Tatsache, dass bei Mäusen mit NEU-depletierten Blutplättchen im Vergleich zu Kontrollmäusen mit normaler Blutplättchenzahl eine gewisse HSC-Aktivierung beobachtet wurde (Abb. 1d machen 3e), unterstützt auch eine Rolle von Mks bei der beobachteten HSC-Aktivierung als Reaktion auf die Behandlung mit Anti-GPIbα-Antikörpern.
(Bezogen auf ergänzende Abb. 4). a Expression von IL-1β in Blutplättchen im Ruhezustand oder nach In-vitro-Aktivierung (3 Stunden) mit Thrombin oder GPIbα-Antikörper. (Links), repräsentative FACS-Profile. Die Zahlen in den Diagrammen sind Durchschnittshäufigkeiten aus drei unabhängigen Experimenten. (Rechts) Häufigkeit von IL-3β+ Blutplättchen; Mittelwert ± SD von 3 biologischen Replikaten pro Bedingung in 3 unabhängigen Experimenten. Jedes biologische Replikat besteht aus gepoolten Blutplättchen von 2–3 Mäusen. b Kinetikanalyse peripherer Blutzelllinien nach in vivo-Verabreichung von Neuraminidase (NEU). Die Daten stellen den Mittelwert ± SEM von 10 (Tag 0), 7 (Tag 1), 8 (Tag 2), 9 (Tag 3), 6 (Tag 5) und 3 (Tag 10) Mäusen aus 6 unabhängigen Experimenten dar. PLT-Blutplättchen, weiße WBC-Blutkörperchen, rote RBC-Blutkörperchen. c Expression von Oberflächen-P-Selectin (CD62P) auf Blutplättchen, gemessen durch Durchflusszytometrie nach In-vitro-Inkubation mit GPIbα-Antikörper oder NEU in den angegebenen Konzentrationen. Die Daten stellen mittlere ± SD-fache Änderungen von % CD62P dar+ Zellen in jedem Zustand im Verhältnis zu unbehandelten (ruhenden) Blutplättchen, von 7 (ruhend), 6 (IgG), 3 (GPIbα-2,5ug), 7 (GPIbα-5ug), 7 (NEU 0.005U) und 6 (NEU). 0.05 U) Mäuse in 3 unabhängigen Experimenten. d In-vitro-Neuraminidase (NEU)-Aktivität in ruhenden Blutplättchen oder nach 30-minütiger Behandlung mit NEU, analysiert durch RCA-1-Bindung. Repräsentatives Profil von 1 von 3 biologischen Replikaten. Die Zahlen geben den Mittelwert ± SD % RCA-1+-Blutplättchen an. e Mittelwert ± SD-Zellzyklusphasenverteilung von Vwf+ (links) und Vwf- (rechts) HSCs 1 Tag nach der Thrombozytendepletion mit NEU. Daten von 6 Mäusen pro Bedingung in 3 unabhängigen Experimenten. f FACS-basierte Bewertung des HSC-Kompartiments im Knochenmark von Mäusen zu den angegebenen Zeitpunkten nach der Thrombozytendepletion mit NEU. Die Daten stellen absolute Zahlen dar Vwf-GFP+ (Vwf+oder Vwf-GFP- (Vwf-) HSCs (Durchschnitt ± SEM) zu den angegebenen Zeitpunkten nach der Erschöpfung der Blutplättchen. Die Daten stammen von 5 (Tag0), 4 (Tag1), 5 (Tag2) und 6 (Tag3) Mäusen in 4 unabhängigen Experimenten. Es wurden keine signifikanten Veränderungen in der Anzahl der Vwf beobachtet+ oder Vwf- HSCs zu jedem Zeitpunkt. g Mittlere ± SD-Spiegel (facher Anstieg im Vergleich zu Tag 0) der angegebenen Zytokine in der extrazellulären Knochenmarksflüssigkeit, die zu den angegebenen Zeitpunkten nach der Thrombozytendepletion mit Neuraminidase aus Mäusen isoliert wurde. Daten von 3 Mäusen pro Zeitpunkt in 2 unabhängigen Experimenten. h Mäuse wurden am Tag 0 mit NEU behandelt, gefolgt von der Verabreichung von GPIbα-Antikörpern am Tag 2 und am Tag 3 (links) auf die Zellzyklusphasenverteilung im Vwf analysiert+ HSCs (rechts). Kontrollmäuse wurden nur mit GPIbα-Antikörper behandelt und einen Tag später analysiert. Die Daten repräsentieren mittlere ±SD-Häufigkeiten von 1 Mäusen pro Gruppe in 4 unabhängigen Experimenten. i HSCs in S-G2-M in Nbeal2- / - Mäuse 1 Tag nach der Thrombozytendepletion (GPIbα). Die Daten repräsentieren mittlere ± SD-Zellhäufigkeiten von 5 (Wt-IgG), 3 (Wt-GPIbα), 4 (Nbeal2- / --IgG) und 5 (Nbeal2- / --GPIbα)-Mäuse pro Bedingung aus 3 unabhängigen Experimenten. j Schema, das den vorgeschlagenen Feedback-Mechanismus darstellt. Beim Verzehr scheiden aktivierte Blutplättchen IL-1 aus, das IL-1R exprimierende PV-Zellen aktiviert, um die HSC-Proliferation und -Differenzierung in Richtung der Blutplättchenlinie zu induzieren. Wie bereits erwähnt, kann Mks auch zur beschriebenen Rekrutierung von HSCs zur Proliferation als Reaktion auf die Behandlung mit dem Anti-GPIbα-Antikörper beitragen, was zu einer aktivierungsabhängigen Thrombozytendepletion führt. Für alle Daten ***p <0.001; ** **.p < 0.01; *p < 0.05 (Nur bei signifikanten Unterschieden angegeben) unter Verwendung einer einfachen ANOVA mit Tukey-Mehrfachvergleichen (a, c, f, i), 2-Wege-ANOVA mit Sidaks Mehrfachvergleichen (e, h) oder Dunnetts Mehrfachvergleiche (g); ns nicht signifikant. Siehe auch ergänzende Abbildung. 6.
Blutplättchen speichern mehrere Entzündungsmodulatoren in Blutplättchenkörnchen, die bei der Blutplättchenaktivierung freigesetzt werden53,54. Um weiter zu untersuchen, ob die Freisetzung von Blutplättchengranulatinhalten für die GPIbα-vermittelte HSC-Aktivierung erforderlich ist, induzierten wir bei Mäusen mit einem Mangel an Blutplättchen eine Blutplättchenverarmung (GPIbα-Behandlung). Nbeal2 (Nbeal2-/-), denen Thrombozyten-α-Granulat fehlt55. Nbeal2-/- Mäuse haben eine insgesamt normale Hämatopoese trotz eines leichten Rückgangs der Blutplättchenzahl und eines leichten Anstiegs der HSCs (ergänzende Abbildung). 6c–e). Einen Tag nach der Anti-GPIbα-Behandlung Nbeal2-/- Mäuse hatten im Vergleich zu Wt-Mäusen eine deutlich geringere Häufigkeit aktiv zyklischer HSCs, obwohl sich die HSCs vor der Behandlung häufiger im Kreislauf befanden (Abb. 6i). Zusammengenommen deuten diese Ergebnisse darauf hin, dass IL-1 und andere bei der Thrombozytenaktivierung ausgeschüttete Regulatoren eine Rolle bei der Regulierung der Aktivierung von HSCs als Reaktion auf Thrombozytopenie spielen könnten.
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- Quelle: https://www.nature.com/articles/s41467-023-41691-y