Es gab einen stetigen Strom ermutigender Daten Stammzellen für MS. Besonders bei bestimmten Arten von MS.
Eine neue Studie ergänzt diese optimistische Richtung.
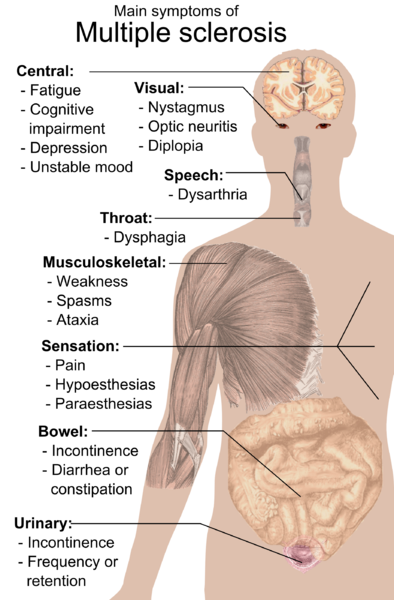
Gute Nachrichten zu Stammzellen für MS
Hämatopoetische Stammzelltransplantation zur Behandlung von schubförmig remittierender Multipler Sklerose in Schweden: eine beobachtende Kohortenstudie, Zeitschrift für Neurologie, Neurochirurgie und Psychiatrie.
Dieses Papier steht im Einklang mit den Ergebnissen anderer Gruppen HSCT scheint für einige MS-Patienten einen großen Nutzen zu haben. Die Autoren kommen hier zu dem Schluss: „Die Behandlung mit aHSCT bei RRMS ist bei der Mehrzahl der Patienten mit einer Abwesenheit von Krankheitsaktivität und akzeptablen unerwünschten Ereignissen verbunden.“ Dieses Verfahren sollte als Standardbehandlung für Patienten mit hochaktivem RRMS angesehen werden.“
Stellen Sie sich vor, Stammzellen für MS würden in vielen Fällen zum bewährten Behandlungsstandard werden. Es wäre so erstaunlich. Ich weiß, dass einige Ärzte, insbesondere außerhalb der USA, dies bereits so sehen.
Kimera Labs IND für COVID
Kimera Labs, das Exosomenprodukte herstellt, erhielt bereits im Mai gute Nachrichten von der FDA. Das Unternehmen erhielt seine erste genehmigte IND, in diesem Fall für eine Untersuchung Exosomentherapie für COVID.
Ich habe diese IND-Nachricht verpasst, wahrscheinlich weil ich im Juni/Anfang Juli drei NIH-Stipendien eingereicht habe und ab Mitte Juni einen schlimmen Fall von COVID hatte. Ich habe es verfolgt Kimera Labs für eine lange Zeit. Es wird interessant sein, diesen IND und alle nachfolgenden Testdaten zu verfolgen. Dieses IND ist besonders bemerkenswert, da die FDA Kimera während der schlimmsten Phase der Pandemie im Zusammenhang mit der Verwendung von Produkten gegen COVID einen Brief ohne Titel schickte.
Die Behörde schickte außerdem eine Warnung an Dr. Douglas Spiel wegen der Verwendung von Exosomen bei COVID-Patienten. Spiel war als klinischer Berater für Kimera tätig, hatte aber seit einigen Jahren keine Rolle mehr im Unternehmen.
Berufung gegen die FDA – Cell Surgical Network
Wahrscheinlich müssen wir bei einer großen, anhängigen Stammzellenklage viel geduldiger sein.

Die FDA hat den Fall vor einem Bundesbezirksgericht hier in Kalifornien wegen der Frage, ob das Fettzellprodukt SVF ein Medikament ist, und anderen Fragen verloren. Es hatte einen ähnlichen Fall in Florida gewonnen.
Nun der kalifornische SVF-Fall, der Klage gegen das Cell Surgical Network, ist bei The Ninth Circuit. Dies wird wahrscheinlich bis 2024 andauern, bevor eine Entscheidung getroffen wird. Warum? Zur Aktualisierung wird in der Fallliste nun die Möglichkeit einer mündlichen Verhandlung im Januar 2024 erörtert. Sofern die Parteien den Fall nicht unabhängig davon klären können, was unwahrscheinlich erscheint, wird dieser Fall sehr lange dauern.
Warum Pasadena? Ich dachte, es wäre in San Francisco.
Weitere empfehlenswerte Lektüre
Ein gegen H3K27M gerichteter Impfstoff bei Erwachsenen mit diffusem Mittelliniengliom, Nat. Med. Das ist hoffnungsvoll, auch wenn es noch sehr vorläufig ist. Besonders interessant fand ich die starke Reaktion eines Patienten.
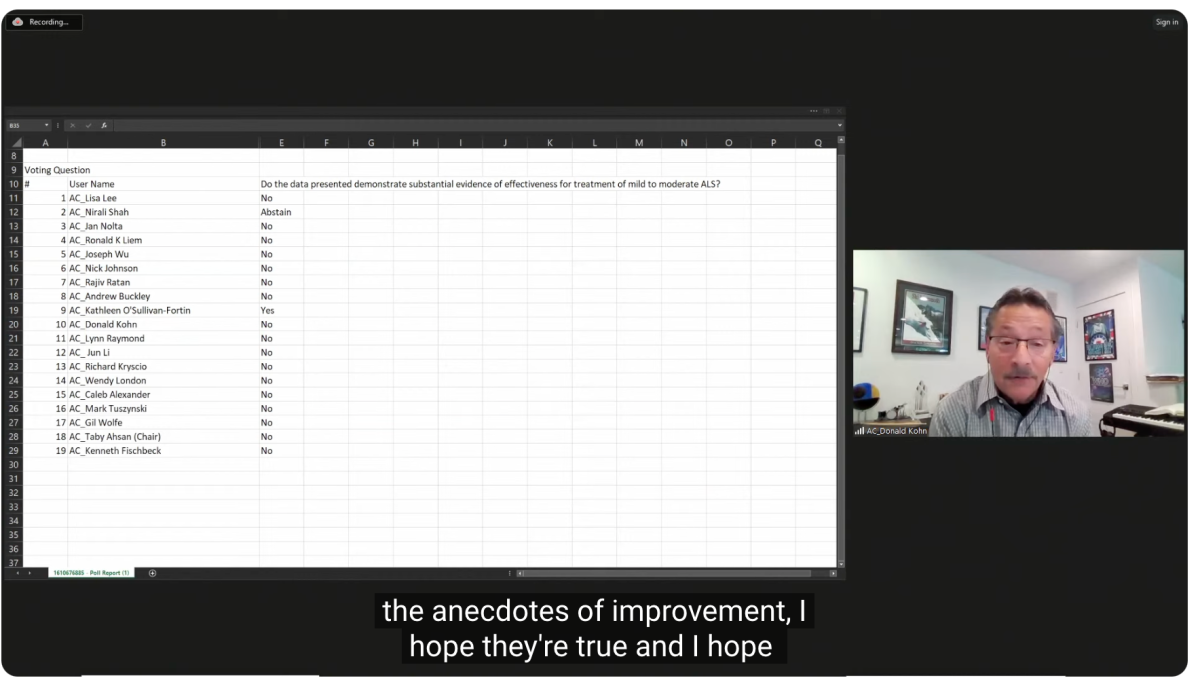
Ein Beratungsausschuss der FDA lehnte einen Einspruchsversuch ab BrainStorm-Zelltherapeutika für sein Nurown-Produkt für ALS.
Ich habe einen kleinen Teil der Panelsitzung gesehen und sie waren ziemlich negativ. Sie hatten große Bedenken hinsichtlich der Daten und wussten nicht, wie das Produkt funktionieren sollte. Es bestehe auch die Möglichkeit, sagten mehrere Ausschussmitglieder, dass Nurown einigen Patienten schadet.
Am Ende stimmte nur eine Person mit „Ja“, siebzehn sagten „Nein“ und einer enthielt sich der Stimme. Ich habe die Abstimmung oben aus dem Video gepostet. Ich habe kürzlich darüber geschrieben, wie ich diese Bemühungen der Firma als … betrachte Ave Maria. Die FDA hat nun bis Anfang Dezember Zeit, eine endgültige Entscheidung zu treffen. Es ist sehr unwahrscheinlich, dass Nurown zum jetzigen Zeitpunkt vorankommt.
Neuron befindet sich auch in klinischen Studien zur Behandlung von MS und stellt einen weiteren möglichen Stammzellenansatz für MS dar, aber die bisherigen Daten waren nicht so ermutigend.
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- Quelle: https://ipscell.com/2023/10/weekly-reads-stem-cells-for-ms-kimera-labs-ind-fda-lawsuit/



