(Noticias de Nanowerk) Imagine un mundo dentro de su cuerpo donde las células diminutas son como trabajadores que construyen y reparan estructuras de tejidos. Interactúan con su entorno, que incluye una estructura llamada matriz extracelular (MEC). Este andamio es como el sitio de construcción, donde las células reciben instrucciones sobre qué y cómo hacer. Ahora, los científicos han estado explorando este sitio de construcción para comprender cómo cambiar la rigidez de este andamio, como hacerlo más suave o más duro, afecta a un tipo especial de célula llamada células madre. Estas células madre son como constructoras multiusos, capaces de convertirse en diferentes tipos de células para ayudar con las reparaciones. Entonces, ¿qué tiene de interesante esto? Bueno, imaginemos si pudiéramos influir en cómo se comportan estas células simplemente alterando la rigidez de su sitio de construcción.
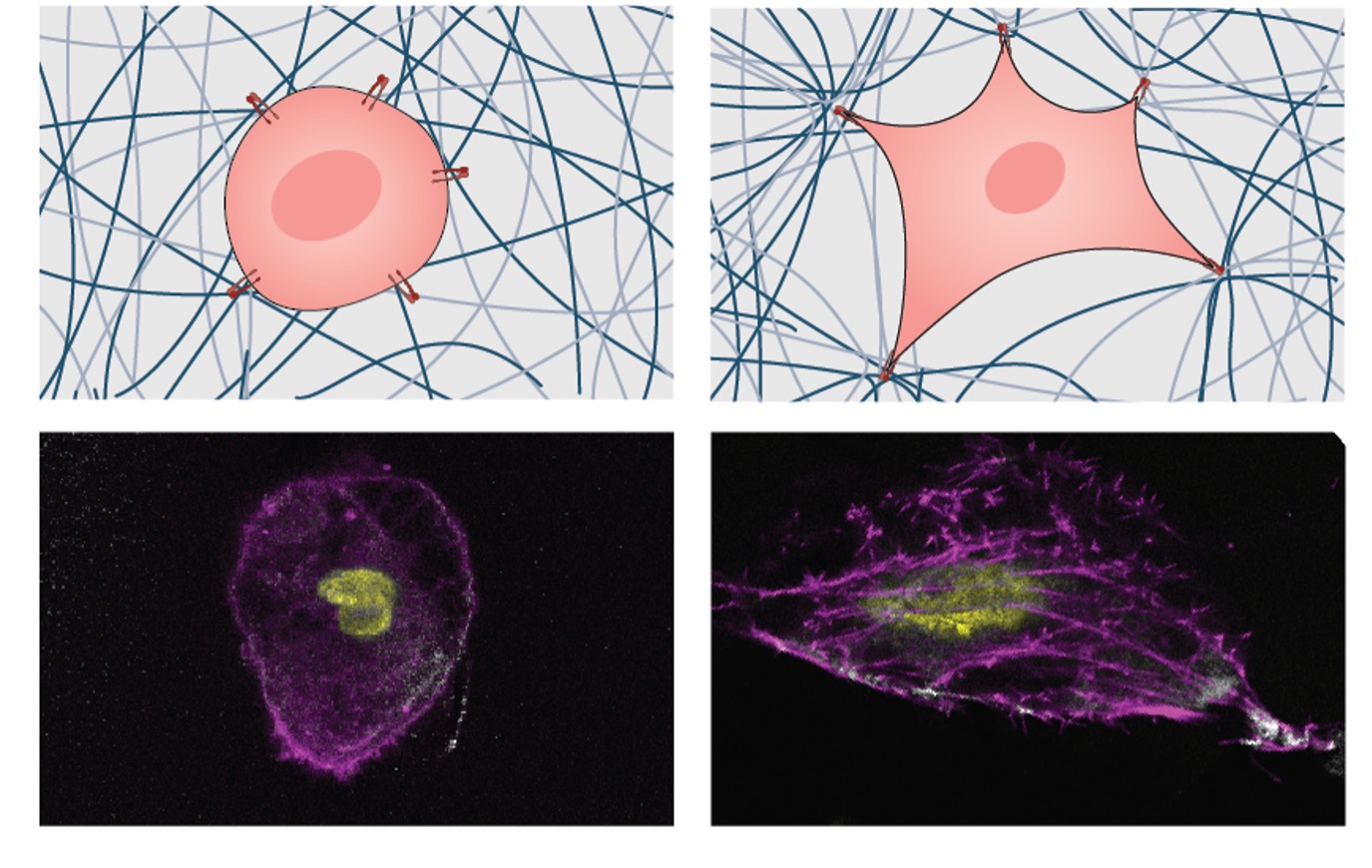 El equipo observó que los hidrogeles rígidos fomentaban la producción y remodelación incipientes de ECM, lo que desencadenaba una cascada de mecanotransducción. Estos cambios fueron impulsados por la señalización intracelular de PI3AKT, la regulación de modificadores epigenéticos y la activación de YAP/TAZ. (Imagen: Cortesía de los investigadores) En un estudio reciente publicado en la revista Biomateriales ("La remodelación de la matriz celular asistida por la rigidez desencadena programas reguladores de mecanotransducción 3D"), el Dr. Akhilesh Gaharwar, profesor y director de investigación del Departamento de Ingeniería Biomédica y la Dra. Irtisha Singh, profesora asistente del Departamento de Biología Celular y Genética, han desarrollado una nueva clase de hidrogeles, materiales gelatinosos para estudiar cómo se mueven las células y responden a la rigidez. Utilizaron nanopartículas para hacer el andamio más rígido, sin cambiar nada más. Es como añadir más vigas de soporte a un edificio sin cambiar los ladrillos. Lo que encontraron fue fascinante. "Cuando se aumentó la rigidez de la estructura, las células sufrieron alteraciones morfológicas y exhibieron un comportamiento proliferativo mejorado, lo que sugiere una señalización de crecimiento acelerado", afirmó Gaharwar. "Este fenómeno ejemplifica la 'mecanotransducción 3D', un proceso en el que las células detectan y responden a las propiedades mecánicas de la matriz circundante". Pero aquí es donde se vuelve aún más emocionante. Cuando introdujeron células madre en este entorno más rígido, sucedió algo sorprendente. Estas células madre también detectaron el cambio de rigidez y se transformaron en células reparadoras especializadas, listas para reparar cualquier daño. "La mecanotransducción 3D funciona como un intrincado mecanismo de comunicación celular con la matriz extracelular", explicó Singh. "Las alteraciones en la rigidez de la matriz transmiten señales distintas, lo que lleva a respuestas divergentes: en las células cancerosas, el aumento de la rigidez generalmente promueve fenotipos agresivos, mientras que en las células madre, puede iniciar la diferenciación en linajes reparativos". Este descubrimiento es increíblemente importante porque significa que podríamos controlar cómo se comportan las células manipulando la rigidez de su entorno. En el contexto del cáncer, es como si pudiéramos enviar una señal para ralentizar las células cancerosas y animar al equipo de reparación a entrar y reparar el daño. En términos simples, estamos aprendiendo cómo hablar el lenguaje de las células y darles instrucciones cambiando la sensación de su entorno. Esto podría abrir nuevas formas de comprender y tratar el cáncer, todo ello utilizando el poder de la mecanotransducción 3D. Si bien aún queda más por explorar, esta investigación ofrece esperanza para un futuro en el que tengamos mejores herramientas para combatir esta compleja enfermedad. Otros colaboradores incluyen al Dr. Tanmay Lele, académico del Instituto de Investigación y Prevención del Cáncer de Texas (CPRIT) y profesor del departamento de ingeniería biomédica de la Universidad Texas A&M.
El equipo observó que los hidrogeles rígidos fomentaban la producción y remodelación incipientes de ECM, lo que desencadenaba una cascada de mecanotransducción. Estos cambios fueron impulsados por la señalización intracelular de PI3AKT, la regulación de modificadores epigenéticos y la activación de YAP/TAZ. (Imagen: Cortesía de los investigadores) En un estudio reciente publicado en la revista Biomateriales ("La remodelación de la matriz celular asistida por la rigidez desencadena programas reguladores de mecanotransducción 3D"), el Dr. Akhilesh Gaharwar, profesor y director de investigación del Departamento de Ingeniería Biomédica y la Dra. Irtisha Singh, profesora asistente del Departamento de Biología Celular y Genética, han desarrollado una nueva clase de hidrogeles, materiales gelatinosos para estudiar cómo se mueven las células y responden a la rigidez. Utilizaron nanopartículas para hacer el andamio más rígido, sin cambiar nada más. Es como añadir más vigas de soporte a un edificio sin cambiar los ladrillos. Lo que encontraron fue fascinante. "Cuando se aumentó la rigidez de la estructura, las células sufrieron alteraciones morfológicas y exhibieron un comportamiento proliferativo mejorado, lo que sugiere una señalización de crecimiento acelerado", afirmó Gaharwar. "Este fenómeno ejemplifica la 'mecanotransducción 3D', un proceso en el que las células detectan y responden a las propiedades mecánicas de la matriz circundante". Pero aquí es donde se vuelve aún más emocionante. Cuando introdujeron células madre en este entorno más rígido, sucedió algo sorprendente. Estas células madre también detectaron el cambio de rigidez y se transformaron en células reparadoras especializadas, listas para reparar cualquier daño. "La mecanotransducción 3D funciona como un intrincado mecanismo de comunicación celular con la matriz extracelular", explicó Singh. "Las alteraciones en la rigidez de la matriz transmiten señales distintas, lo que lleva a respuestas divergentes: en las células cancerosas, el aumento de la rigidez generalmente promueve fenotipos agresivos, mientras que en las células madre, puede iniciar la diferenciación en linajes reparativos". Este descubrimiento es increíblemente importante porque significa que podríamos controlar cómo se comportan las células manipulando la rigidez de su entorno. En el contexto del cáncer, es como si pudiéramos enviar una señal para ralentizar las células cancerosas y animar al equipo de reparación a entrar y reparar el daño. En términos simples, estamos aprendiendo cómo hablar el lenguaje de las células y darles instrucciones cambiando la sensación de su entorno. Esto podría abrir nuevas formas de comprender y tratar el cáncer, todo ello utilizando el poder de la mecanotransducción 3D. Si bien aún queda más por explorar, esta investigación ofrece esperanza para un futuro en el que tengamos mejores herramientas para combatir esta compleja enfermedad. Otros colaboradores incluyen al Dr. Tanmay Lele, académico del Instituto de Investigación y Prevención del Cáncer de Texas (CPRIT) y profesor del departamento de ingeniería biomédica de la Universidad Texas A&M.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- Fuente: https://www.nanowerk.com/nanotechnology-news3/newsid=64680.php



