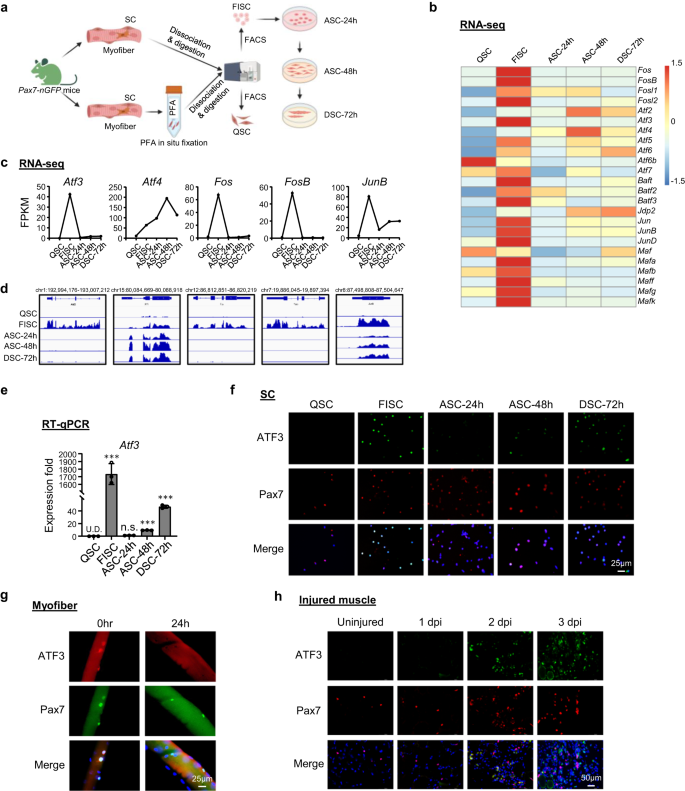
ATF3 se induce rápida y transitoriamente durante la activación temprana de SC
Para explorar los eventos regulatorios transcripcionales que gobiernan la transición de inactividad a activación de SC, volvimos a analizar nuestros conjuntos de datos de perfiles transcriptómicos publicados anteriormente.36 adquirido de SC en la progresión del linaje. Brevemente, los músculos de Pax7-nGFP ratones37 se fijaron in situ mediante PFA antes de someterlos al proceso estándar de aislamiento y disociación celular de 3 h de duración, y clasificación FACS para obtener QSC13, o sin fijación previa para obtener SC de activación temprana (FISC) recién aisladas (Fig. 1a y Fig. Suplementaria. 1a); Las FISC se cultivaron in vitro durante 24, 48 o 72 h para obtener células completamente activadas (ASC-24h), proliferantes (ASC-48h) o diferenciadas (DSC-72h). De acuerdo con los hallazgos de otros informes recientes38,39,40, genes de la familia AP-1, incluidos Fos, Atf, junio y maf Las subfamilias fueron inducidas dramáticamente en las FISC en comparación con las QSC (Fig. 1b). Notablemente, atf3 fue inducida bruscamente (42.4 veces) en FISC pero luego disminuyó rápidamente en ACS-24h (Fig. 1c, d); Esto también fue confirmado por RT-qPCR (Fig. 1e), lo que indica que es un gen que responde de forma rápida y transitoria a la activación temprana inducida por el aislamiento. Además, la tinción por inmunofluorescencia (IF) demostró la inducción concomitante de la proteína ATF3 en las FISC y una disminución de las ASC (Fig. 1f). Incluso en la miofibra única recién aislada que se cree que preserva el nicho inactivo hasta cierto punto y minimiza la activación SC41,42, las SC asociadas mostraron un alto nivel de expresión de la proteína ATF3 inmediatamente después de 2 h de aislamiento, que disminuyó a las 24 h en cultivo (Fig. 1g), lo que refuerza la idea de que ATF3 se induce rápidamente en las SC activadas tempranamente. Para confirmar aún más la inducción de ATF3 in vivo, se inyectó BaCl2 en los músculos tibiales anteriores (TA) de ratones C57BL/6 para inducir daño muscular agudo. En este modelo de lesión36,43,44, la degeneración del tejido con abundantes infiltrados de células inmunitarias normalmente se observa 1 día después de la lesión (dpi); Las SC se activan rápidamente para expandirse como mioblastos proliferantes que luego se fusionan para formar pequeñas miofibras nuevas que expresan la cadena pesada de miosina embrionaria (eMyHC) y se caracterizan por núcleos centralmente localizados (CLN); Estas fibras eMyHC+ se ven fácilmente a 5 ppp. A 7 ppp, el músculo está compuesto principalmente por miofibras regeneradas más grandes con expresión de eMyHC regulada negativamente; El daño muscular y las células inflamatorias se eliminan en gran medida a los 14 ppp, mientras que las miofibras regeneradas continúan creciendo en tamaño y madurando para lograr una regeneración completa alrededor de los 30 ppp. Como se esperaba, IF no detectó la proteína ATF3 en los músculos TA ilesos, pero se observó fácilmente a 1 ppp; Algunas tinciones no se fusionaron con las células Pax7+, lo que concuerda con su inducción ubicua reportada en múltiples células después de una lesión.45. A 2 ppp, la expresión de ATF3 en células Pax7+ aumentó considerablemente, de manera concomitante con la activación completa de las SC en esta etapa (Fig. 1h). Varios otros miembros de la familia AP-1, Atf4, Fos, FosBy JunB, compartió un perfil de expresión dinámica similar (Fig. 1b–d), que también fue confirmado por RT-qPCR (Fig. 1b) y tinción inmunofluorescente (Fig. 1c) resultados. En conjunto, nuestros hallazgos muestran que ATF3 y varios otros miembros de la familia AP-1 se inducen rápida y transitoriamente durante la activación temprana de SC, lo que sugiere sus roles potenciales en la regulación de la activación temprana de SC.
a Esquema para el aislamiento de células satélite inactivas (QSC) después de la fijación in situ, SC recién aisladas (FISC) sin fijación previa de músculos de Tg: Pax7-nGFP ratones. Posteriormente, las FISC se cultivaron y activaron durante 24 (ASC-24 h), 48 (ASC-48 h) o 72 h (DSC-72 h). Los ARN se extrajeron para el análisis RNA-Seq. Creado con BioRender.com. b Mapas de calor que indican los niveles de expresión génica (Log2 [FPKM]) de los TF de la familia AP-1 detectados por RNA-Seq. c, d Niveles de expresión (FPKM) e instantáneas genómicas de atf3, atf4, Fos, FosB, JunB ARNm del RNA-Seq anterior. e Detección por RT-qPCR de atf3 en las celdas anteriores. n = 3 ratones por grupo. p = 0.000025, 0.12, 0.0000011 y 0.0000052. f Tinción por inmunofluorescencia (IF) de las proteínas ATF3 y Pax7 en las células anteriores. Barra de escala: 50 μm. g Tinción IF de proteínas ATF3 y Pax7 en miofibras individuales de músculos EDL inmediatamente después del aislamiento o cultivo durante 24 h. Barra de escala: 25 μm. h Tinción IF de proteínas ATF3 y Pax7 en secciones de músculo TA de ratones ilesos o 1, 2 y 3 ppp. Barra de escala: 50 μm. Todos los gráficos de barras se presentan como media ± DE. Estudiantes t Se utilizó la prueba (no pareada de dos colas) para calcular la significación estadística (e): *p < 0.05, **p <0.01, ***p < 0.001. No tiene importancia. Los datos de origen se proporcionan como un archivo de datos de origen.
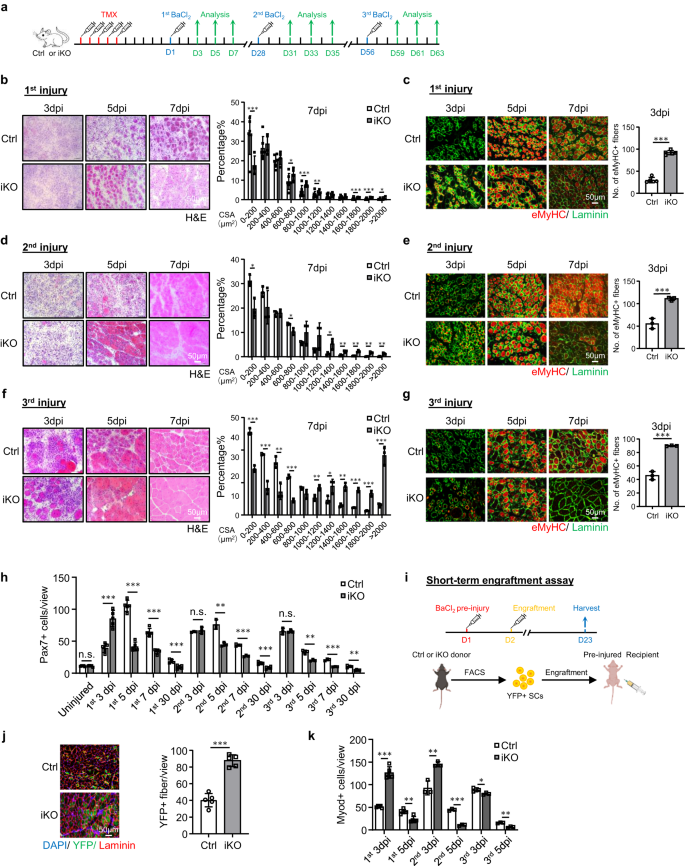
A corto plazo los atf3 la eliminación acelera la regeneración muscular inducida por lesiones agudas
Para facilitar la disección de la función ATF3 en SC, cruzamos el atf3flox alelo46, en el que se insertaron dos sitios LoxP en atf3 exón2, con pax7CreERT2/CreERT2-R26RYFP/YFP ratón43 para generar control (Ctrl) (atf3+ / +–Pax7CreERT2/CreERT2-R26RYFP/YFP) y ratones knockout inducibles de atf3 (atf3 iKO) (atf3 flox/flox–Pax7CreERT2/CreERT2-R26RYFP/YFP) (Fig. 2a). Después de 5 días consecutivos de inyección intraperitoneal (IP) de tamoxifeno (TMX) (Fig. 2a), WB confirmó la eliminación exitosa de ATF3 en FISC (Fig. 2b) o IF (Fig. 2c); su agotamiento se confirmó aún más mediante la tinción IF de SC en miofibras individuales (Fig. 2d). Morfológicamente, el iKO de 2 meses no mostró diferencias aparentes con los ratones de la camada Ctrl; Tampoco se detectaron cambios en el tamaño y el peso corporal (Figura complementaria. 2e).
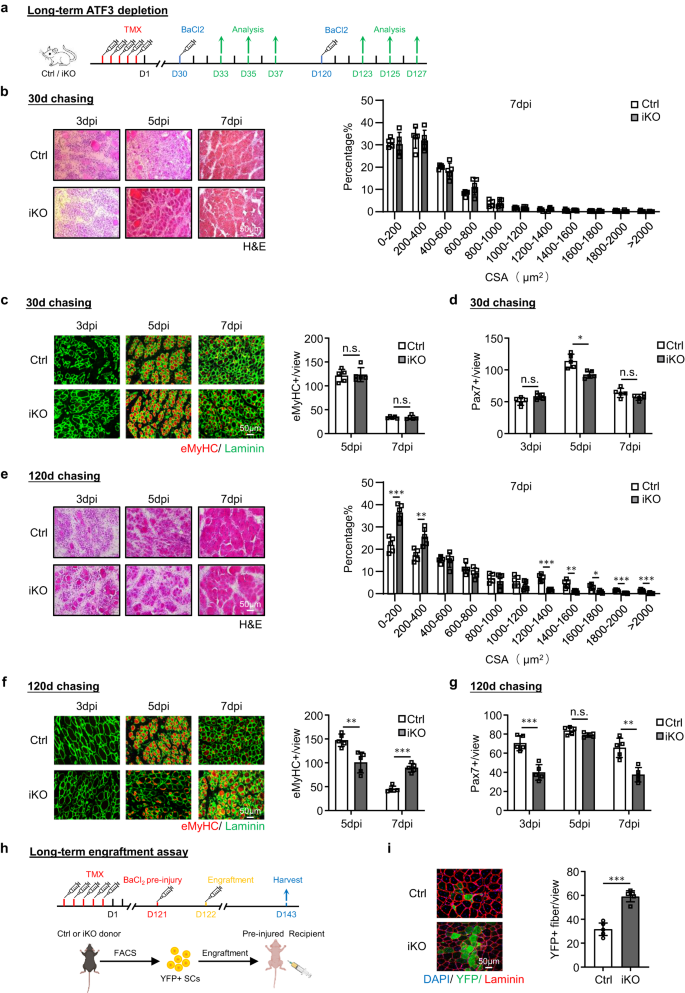
a Esquema del diseño experimental. b Tinción H&E de músculos TA recolectados a los 3, 5 y 7 días después de la lesión de la primera ronda (dpi). Barra de escala: 1 μm. Las áreas de sección transversal (CSA) de las fibras recién formadas se cuantificaron a partir de los músculos TA a 50 ppp. p = 0.000066, 0.018, 0.00069, 0.0087, 0.00082, 0.00047 y 0.046. c La tinción IF de eMyHC (rojo) y Laminin (verde) se realizó en los músculos TA anteriores. Barra de escala: 50 μm. p = 0.00000011. d, e Tinción H&E y eMyHC de los músculos TA después de la lesión de la segunda ronda. Barra de escala: 2 μm. p = 0.012, 0.019, 0.033, 0.0057, 0.0022, 0.0022 y 0.0093 (d); p = 0.00021 (e). f, g Tinción con H&E y eMyHC de los músculos TA después de la lesión de la tercera ronda. Barra de escala: 3 μm. p = 0.00015, 0.00087, 0.0063, 0.000074, 0.0089, 0.035, 0.0014, 0.00011, 0.00042 y 0.00071 (f); p = 0.000023 (g). h Los SC Pax7+ por vista se cuantificaron en los músculos Ctrl e iKO TA en personas ilesas o después de las 3 rondas de lesión. p = 0.96, 0.00011, 0.0000013, 0.000014, 0.00066, 0.45, 0.0023, 0.00017, 0.00032, 0.95, 0.0022, 0.00019 y 0.0012. i Esquema para el ensayo de injerto. Creado con BioRender.com. j Tinción IF de YFP (verde) y Laminin (rojo) en los músculos TA 21 días después del injerto. Barra de escala: 50 μm. n = 5 ratones por grupo. p = 0.0000091. k Cuantificación de Myod+ SC por vista en los músculos Ctrl e iKO TA después de las 3 rondas de lesión. p = 0.0000012, 0.0013, 0.0054, 0.000028, 0.041 y 0.0012. n = 5 ratones por grupo durante 3, 5, 7 días después de la primera lesión y 1 días después de la primera, segunda y tercera lesión y ensayo de injerto; n = 3 ratones por grupo durante 3, 5, 7 días después de la segunda y tercera lesión. Todos los gráficos de barras se presentan como media ± DE, Student t Se utilizó la prueba (no pareada de dos colas) para calcular la significación estadística (b–h, j, k): *p < 0.05, **p <0.01, ***p < 0.001. No tiene importancia. Los datos de origen se proporcionan como un archivo de datos de origen.
Teniendo en cuenta la rápida inducción de ATF3 durante la activación temprana de SC, razonamos que su pérdida podría afectar la regeneración muscular mediada por SC. Para probar esta noción, BaCl2 se inyectó en los músculos TA de ratones Ctrl o iKO para inducir daño muscular agudo 5 días después de la eliminación de TMX (Fig. 2a). Al examinar los músculos TA lesionados anteriormente a 3, 5, 7 y 30 ppp (Fig. 2a), los músculos iKO mostraron una tasa de regeneración muy acelerada. Mediante tinción H&E (Fig. 2b), a 5 ppp, las fibras en regeneración con CLN ya estaban presentes en el iKO pero no en los músculos Ctrl. A 7 ppp, el músculo dañado estaba casi reparado con fibras homogéneas y no había signos de células inmunes en el iKO y el tamaño de la fibra también era significativamente mayor en comparación con el Ctrl (la cuantificación a la derecha). Estas observaciones experimentales fueron respaldadas por la tinción IF de eMyHC (Fig. 2c); Las fibras eMyHC+ se observaron fácilmente en iKO incluso a 3 ppp (91.64 en iKO frente a 29.86 en Ctrl), pero disminuyeron drásticamente en 7 ppp. Consistentemente, el número de celdas Pax7+ a 3 ppp fue significativamente mayor en iKO frente a Ctrl pero menor a 5 ppp y 7 ppp (Fig. 2h y Fig. Suplementaria. 2f). Además, los músculos TA recolectados de los ratones iKO a 30 ppp tenían un mayor peso muscular en comparación con el Ctrl (43.7 frente a 48.4 mg) (Figura complementaria. 2g) y tamaño de fibra muscular agrandado (1137.4 frente a 862.8 μm2) (Fig. 2h), lo que refleja la reparación mejorada.
Sorprendentemente, la mayor capacidad regenerativa de atf3 Los SC de iKO persistieron después de una ronda más de BaCl2-lesión aguda inducida administrada un mes después (Fig. 2a). Como se muestra en la Fig. 2d, e, la regeneración acelerada se mantuvo igualmente fuerte según el aumento del tamaño de la fibra a 7 ppp y la cantidad de fibras eMyHC+ a 3 ppp después de la segunda lesión. A 2 ppp, el músculo iKO también mostró un mayor peso muscular en comparación con el Ctrl (30 frente a 61.7 mg) (Figura complementaria. 2i) y tamaño de fibra muscular ligeramente agrandado (1724.8 frente a 1633.8 μm2) (Fig. 2j). Luego se dio la tercera ronda de lesión (Fig. 2a) y la reparación acelerada aún era evidente (Fig. 2f, gramo), ya que el número de fibras eMyHC+ a 3 ppp era aún mayor en los músculos iKO frente a Ctrl (89.9 frente a 45.7) (Fig. 2g) y se observó un mayor número de fibras más grandes a 7 ppp (Fig. 2f). Sin embargo, a pesar del ligero aumento del peso del músculo TA en el iKO en comparación con el Ctrl 30 días después de la tercera lesión (Figura complementaria. 2k), no hubo diferencias significativas en el tamaño promedio de las fibras musculares (Fig. 2l), lo que sugiere que la regeneración acelerada en el músculo iKO finalmente desapareció después de la tercera lesión.
Luego se realizó el ensayo de injerto para validar aún más la capacidad regenerativa mejorada de los iKO SC. Como se ilustra en la Fig. 2i, 21 días después de que se inyectaran SC YFP+ de ratones Ctrl o iKO en los músculos TA prelesionados de ratones desnudos receptores, se recolectaron los músculos TA para evaluar la capacidad regenerativa de las células donantes en función de la expresión de YFP. De hecho, observamos un mayor número de miofibras YFP+ en los ratones receptores trasplantados con iKO frente a Ctrl SC (Fig. 2j). En conjunto, nuestros resultados demuestran que atf3 la eliminación mejora la regeneración muscular inducida por lesiones agudas.
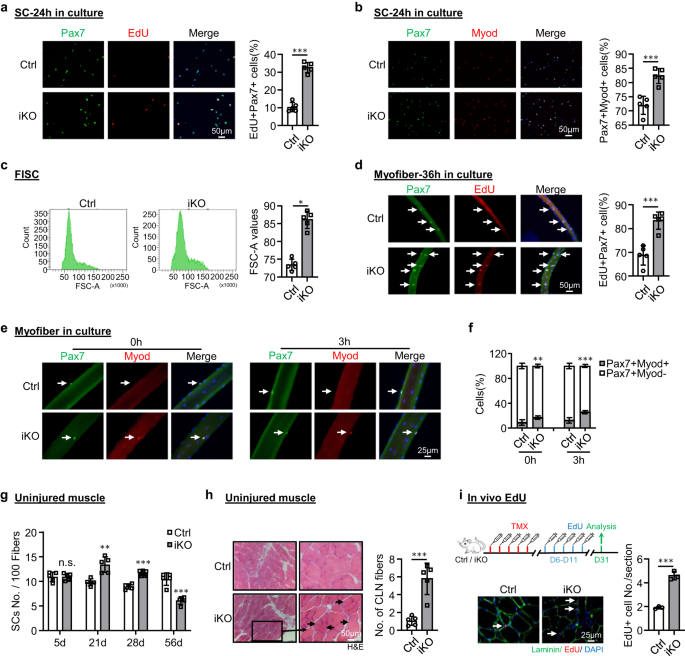
atf3 la eliminación provoca activación prematura de SC y pseudo-regeneración en el músculo homeostático
Para analizar la causa subyacente de la capacidad regenerativa mejorada tras la pérdida de ATF3, especulamos que los SC iKO experimentaron una activación rápida con BaCl.2 lesión. De hecho, al trazar la dinámica de los SC MyoD+ a lo largo de las tres rondas de lesión/regeneración. Se detectó un número mucho mayor de células MyoD+ a 3 ppp (Fig. 2k y Fig. Suplementaria. 2m), pero el número de celdas disminuyó rápidamente a 5 ppp. Este fenómeno existió durante las dos primeras rondas de lesiones pero desapareció en la tercera ronda (Fig. 2k y Fig. Suplementaria. 2m). En comparación con Ctrl, la activación más rápida de las células iKO tras una lesión aguda implica una transición más rápida de la inactividad a la activación. De hecho, los FISC del atf3Los ratones -iKO mostraron una propensión sorprendentemente aumentada a la entrada en el ciclo celular basada en la incorporación de EdU 24 h después del cultivo (aumento de ~23%) (Fig. 3a). Además, las células Pax7+MyoD+ en iKO mostraron un aumento del 10% en comparación con Ctrl 24 h después del cultivo (Fig. 3b). Además, los FISC de los músculos iKO también eran ligeramente más grandes que los Ctrl (86.1 frente a 72.9) (Fig. 3c). Consistentemente, las miofibras individuales aisladas de los músculos iKO tuvieron una incorporación de EdU significativamente mayor (aumento del 14%) que las Ctrl 36 h después del cultivo (Fig. 3d), reforzando la entrada más rápida al ciclo celular de los iKO SC. Las SC iKO en miofibras individuales recién aisladas también produjeron 1.90 veces y 2.08 veces más células Pax7+MyoD+ que las SC Ctrl sin cultivo o con 3 h (Fig. 3e,f). En conjunto, estos resultados indican que la pérdida de ATF3 da como resultado la liberación de la inactividad y, por lo tanto, una rápida activación de SC sin lesión aguda.
a Se cultivaron SC de ratones Ctrl o iKO durante 24 h y se trataron con EdU durante 6 h antes de teñir EdU (rojo) y Pax7 (verde). Barra de escala: 50 μm. p = 0.0000014. b Tinción IF de Pax7 (verde) y MyoD (rojo) en los SC anteriores cultivados durante 24 h. Barra de escala: 50 μm. p = 0.00050. c Gráficos FACS representativos que muestran el tamaño de los FISC ordenados a partir de músculos Ctrl o iKO. p = 0.050. d Se cultivaron miofibras recién aisladas de ratones Ctrl o iKO durante 36 h y se trataron con EdU durante 6 h antes de teñir para EdU (rojo) y Pax7 (verde). Barra de escala: 50 μm. p = 0.00034. e Tinción IF de Pax7 (verde) y MyoD (rojo) en las miofibras anteriores inmediatamente después del aislamiento o cultivo durante 3 h. Barra de escala: 25 μm. f Cuantificación del porcentaje de SC Myod-Pax7+ y Myod+Pax7+. p = 0.0098 y 0.00035. g Cuantificación del número de SC Pax7+ por 100 fibras en músculos Ctrl o iKO ilesos 5, 21, 28 y 56 días después de la inyección de TMX. p = 0.96, 0.0018, 0.000049 y 0.00018. h Tinción H&E de los músculos ilesos anteriores 56 días después de la inyección de TMX. Barra de escala: 50 μm. p = 0.00043. i Superior: esquema del ensayo EdU in vivo realizado en músculo Ctrl o iKO ileso; EdU fue inyectado por IP 5 días después de TMX. Los músculos se recogieron 21 días después. Tinción IF inferior de EdU (rojo) y Laminin (verde). Barra de escala: 25 μm. p = 0.00024. n = 5 ratones por grupo (a–h); n = 3 ratones por grupo (i). Todos los gráficos de barras se presentan como media ± DE, Student t Se utilizó la prueba (no pareada de dos colas) para calcular la significación estadística (a–d, f–i): *p < 0.05, **p <0.01, ***p < 0.001. No tiene importancia. Los datos de origen se proporcionan como un archivo de datos de origen.
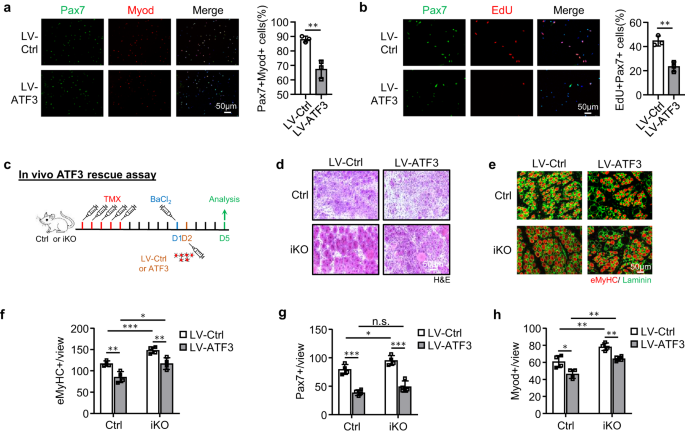
La capacidad regenerativa mejorada de los iKO SC nos llevó a realizar más pruebas si la pérdida de ATF3 puede conducir a una activación espontánea y pseudo-regeneración en músculos sin lesión. En comparación con Ctrl, no hubo un aumento de SC Pax7+ en los músculos iKO TA 5 días después de la inyección de TMX, pero sí un aumento significativo de células Pax7+ en los músculos iKO TA a los 21 (13.4 vs. 9.58) y 28 días (11.7 vs. . 8.9) (Figs. 3g y S3a), lo que indica la aparición de activación y expansión espontánea de iKO SC en músculos homeostáticos. Curiosamente, 56 días después de la inyección de TMX, el número de células Pax7+ en los músculos iKO finalmente disminuyó en comparación con Ctrl (Figs. 3g y S3a); esto estuvo acompañado de fibras CLN+ fácilmente visibles (Fig. 3h), lo que indica la fusión de los mioblastos derivados de SC activados con fibras existentes, lo que se conoce como pseudorregeneración.47. Para confirmar estos hallazgos, realizamos cinco dosis de inyecciones de EdU 5 días después de la inyección de TMX para mostrar que había más células EdU+ en las secciones musculares de iKO que Ctrl a los 21 días después de la inyección de EdU (Fig. 3i). De manera similar, con una dosis única de EdU administrada, las células EdU+ solo se detectaron en las miofibras iKO aisladas o en los músculos TA 12 h después, pero no en las Ctrl (Figura complementaria). 3b). En conjunto, estos resultados sugieren que atf3 la eliminación provoca la activación precoz de las SC en los músculos homeostáticos, por lo que ATF3 puede funcionar para suprimir activamente la activación de las SC. Esto se vio reforzado aún más por la sobreexpresión de ATF3 en FISC mediante un lentivirus (Figura complementaria). 3c); inhibió significativamente la activación de SC (Fig. 4a, 20.9% de reducción de células Pax7+MyoD+ y Fig. 4b, reducción del 21.3% de células EdU+). Además, la sobreexpresión de ATF3 in vivo mediante inyección intramuscular de partículas de lentivirus a 1 ppp (Fig. 4c) retrasó la regeneración en ratones Ctrl y también mitigó la regeneración acelerada en ratones iKO (Figs. 4d-h y S3d, mi).
a Los FISC de ratones Ctrl o iKO se infectaron con lentivirus que sobreexpresan ATF3 y se tiñeron para Pax7 (verde) y Myod (rojo) después de 48 h. Barra de escala: 50 μm. p = 0.0050. b Se realizó el ensayo EdU y se cuantificaron las células EdU+. Barra de escala: 50 μm. p = 0.0031. c Esquema para sobreexpresar ATF3 in vivo. Se inyectaron lentivirus que expresan ATF3 en los músculos Ctrl o iKO TA 1 día después de BaCl2 lesión. Los músculos se recogieron 5 días después de la infección para su análisis. d Tinción H&E de los músculos TA anteriores. Barra de escala: 50 μm. e La tinción IF de eMyHC (rojo) y Laminin (verde) se realizó en los músculos TA anteriores. Barra de escala: 50 μm. f Se cuantificó el número de fibras eMyHC+ por vista. p = 0.0044, 0.00081, 0.015 y 0.0072. g Se cuantificaron los números de células Pax7+ por vista en los músculos TA anteriores. p = 0.00018, 0.041, 0.098 y 0.00040. h Se cuantificaron los números de células Myod+ por vista en los músculos TA anteriores. p = 0.016, 0.0058, 0.0010 y 0.0019. n = 3 ratones por grupo (a, b); n = 4 ratones por grupo (d–h). Todos los gráficos de barras se presentan como media ± DE. Estudiantes t Se utilizó la prueba (no pareada de dos colas) para calcular la significación estadística (a, b, f–h): *p < 0.05, **p <0.01, ***p < 0.001. No tiene importancia. Los datos de origen se proporcionan como un archivo de datos de origen.
Además, observamos que hubo un aumento del 24% de células diferenciadoras MyoD+ MyoG+ en las fibras musculares iKO aisladas en comparación con Ctrl después de 72 h de cultivo (Fig. 3f), sugiriendo que atf3 la eliminación puede acelerar la diferenciación de la progenie SC. Esto se confirmó mediante tinción para MyoD y MyoG en SC cultivadas durante 72 h; Se detectó un aumento del 9 % en las células doblemente positivas en iKO frente a Ctrl (Fig. 3g). Curiosamente, también hubo una ligera disminución de células Pax7+MyoD− en las fibras musculares iKO en comparación con Ctrl (10.13% frente a 8.48%) (Figura complementaria. 3h), lo que sugiere que la pérdida de Atf3 también puede provocar un deterioro de la autorrenovación. Consistentemente, también notamos una disminución progresiva en el número de SC después de cada ronda de lesión (Fig. 2h y Fig. Suplementaria. 2f).
Largo plazo atf3 la deficiencia agota la reserva de SC y perjudica la regeneración muscular
A continuación, para probar si a largo plazo atf3 La deficiencia causa agotamiento de SC y perjudica la regeneración muscular, inducimos lesión muscular por BaCl2 administración 30 días o 120 días después de la eliminación atf3 de SC y examinó los músculos TA lesionados a 3, 5 y 7 ppp (Fig. 5a). Treinta días después de la eliminación, la regeneración muscular (basada en el tamaño de las fibras musculares y el número de fibras eMyHC+) no mostró cambios significativos en comparación con los ratones Ctrl (Fig. 5b, c). El número de Pax7+ SC también fue comparable a 3 y 7 ppp y sólo ligeramente inferior en el iKO a 5 ppp (Fig. 5d y Fig. Suplementaria. 4a). Por el contrario, 120 días después de la eliminación, la regeneración muscular estaba obviamente comprometida en los ratones iKO en comparación con los ratones Ctrl. Se observó un aumento significativo de fibras más pequeñas a 7 ppp (Fig. 5e); el número de fibras eMyHC+ fue mucho menor a 5 ppp pero mayor a 7 ppp (Fig. 5f); El número de Pax7+ SC también se redujo significativamente tanto a 3 como a 7 ppp (Fig. 5g y Fig. Suplementaria. 4b). Estos resultados demuestran que a largo plazo atf3 La deficiencia es perjudicial para la regeneración al reducir la reserva de SC. Curiosamente, cuando se utilizó la misma cantidad de células YFP+ aisladas de los ratones Ctrl o iKO 4 meses después de la inyección de TMX en el ensayo de injerto (Fig. 5h), se observó un mayor número de miofibras YFP+ en los ratones desnudos receptores trasplantados con células iKO (59.28 frente a 31.72, Fig. 5i), lo que sugiere que la capacidad regenerativa mejorada de las células iKO persiste después de una pérdida a largo plazo de ATF3 y que la regeneración muscular deteriorada surge de la reducción del conjunto de células.
a Esquema esquemático del diseño experimental para probar el efecto de largo plazo. atf3 Deleción en el proceso de regeneración muscular. 30 o 120 días después de que se administró la inyección de TMX antes de BaCl2 inyección. b Izquierda: tinción H&E de los músculos TA recolectados a 3, 5 y 7 ppp después del período de persecución de 30 días. Barra de escala: 50 μm. n = 5 ratones por grupo. Derecha: se cuantificaron las CSA de las fibras recién formadas a partir del músculo TA teñido anteriormente a 7 ppp y se muestra la distribución. n = 5 ratones por grupo. c Izquierda: la tinción IF de eMyHC (rojo) y Laminin (verde) se realizó en los músculos TA anteriores. Barra de escala: 50 μm. Derecha: Cuantificación del número de fibras eMyHC+ por vista a 5 y 7 ppp. n = 5 ratones por grupo. p = 0.83 y 0.98. d Cuantificación del número de SC Pax7+ por vista. n = 5 ratones por grupo. p = 0.054, 0.0047 y 0.11. e–g Los ensayos/cuantificaciones anteriores se realizaron en los músculos Ctrl o iKO recolectados a 3, 5 y 7 ppp después del período de persecución de 120 días. Barra de escala: 50 μm. n = 5 ratones por grupo. p = 0.00020, 0.0047, 0.000068, 0.0024, 0.013, 0.00019 y 0.00057 (e); p = 0.0034 y 0.000018 (f); p = 0.00031, 0.063 y 0.0010 (g). h Esquema del ensayo de injerto. 120 días después de la inyección de TMX, se inyectaron FISC de ratones donantes (Ctrl/iKO) en ratones desnudos receptores previamente lesionados. Los músculos TA se recolectaron 21 días después del injerto para su análisis. Creado con BioRender.com. i Izquierda: tinción IF de YFP (verde) y Laminin (rojo) en los músculos TA anteriores. Barra de escala: 50 μm. Derecha: se cuantificó el número de fibras YFP+ por vista. n = 5 ratones por grupo. p = 0.000047. Todos los gráficos de barras se presentan como media ± DE. Estudiantes t Se utilizó la prueba (no pareada de dos colas) para calcular la significación estadística (b–g, i): *p < 0.05, **p <0.01, ***p < 0.001. No tiene importancia. Los datos de origen se proporcionan como un archivo de datos de origen.
Para establecer aún más la importancia de atf3 en el establecimiento y mantenimiento de SC, eliminamos con éxito atf3 en progenitores miogénicos Pax7+ cruzando el atf3flox alelo con un no inducible pax7Cre-R26RYFP cepa de ratón transgénico48, en el que la recombinasa Cre se expresa en células progenitoras Pax7+ ya en E9.5 (Fig. 5a – c). Curiosamente, los músculos cKO mostraron un aumento del 84 % en los SC Pax7+ en comparación con los Ctrl alrededor de 1 mes después del nacimiento, cuando se estableció el grupo de SC.49, pero una disminución del 79% en ratones adultos de dos meses (Figura complementaria). 5e), lo que indica que el ATF3 es necesario para el mantenimiento del SC en la edad adulta, pero es prescindible para el establecimiento del SC. Se detectó una disminución del peso del músculo TA en cKO al mes de edad (1 mg frente a 29.42 mg, figura complementaria. 5f) pero no hubo diferencias significativas en el peso corporal (12.66 mg frente a 12.42 mg, figura complementaria. 5d) y tamaño de la fibra (861.96 μm2 frente a 848.71 µm2, Fig. Suplementaria 5g), por lo tanto, es difícil concluir si se produce hipertrofia muscular en los ratones cKO jóvenes. Como era de esperar, cuando se aislaron y cultivaron las SC adultas, las células cKO mostraron una propensión mucho mayor a la activación evaluada mediante tinción con Pax7+Myod+ (Fig. 5h, aumento del 23.8% en cKO frente a Ctrl) y ensayo EdU (Fig. 5i, aumento del 99.9%). En consecuencia, la capacidad regenerativa después de una lesión aguda estaba evidentemente comprometida en los músculos cKO (Fig. 5j–l). Por lo tanto, la pérdida de ATF3 induce una activación precoz de SC y conduce a la eventual reducción del conjunto de SC.
atf3 la eliminación mejora la activación de SC durante ejercicios voluntarios y de resistencia
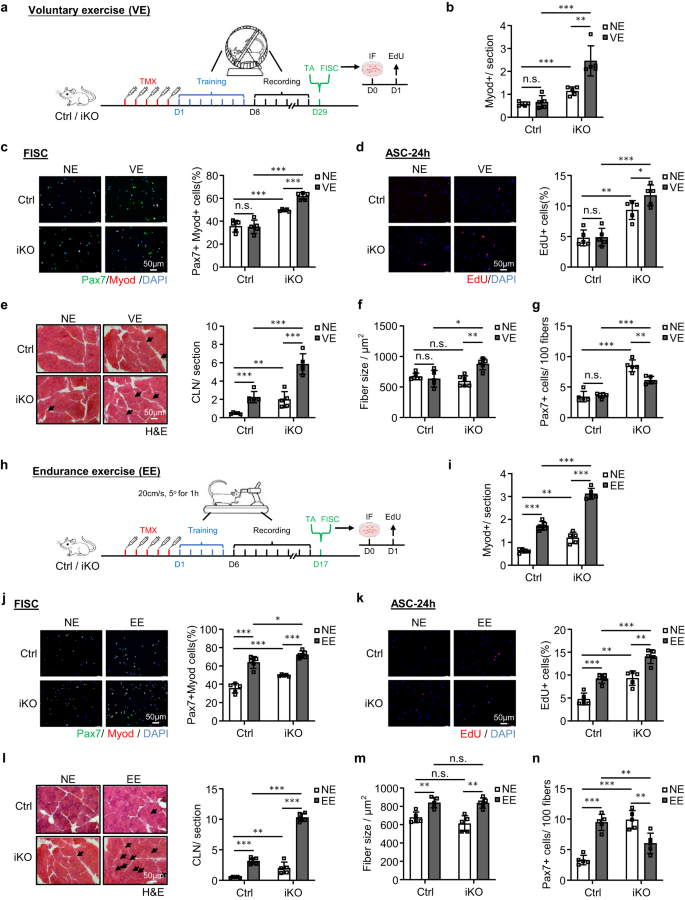
El ejercicio voluntario (VE) a corto plazo y no extenuante no logra provocar la activación de las SC, pero el ejercicio de resistencia (EE) activa las SC50,51,52,53,54. Para probar aún más la función de ATF3 en la prevención de la activación de SC, buscamos determinar si el agotamiento de ATF3 influye en la activación de SC inducida por VE. Inmediatamente después de cinco dosis de inyección de TMX, los ratones Ctrl e iKO fueron sujetos a un régimen voluntario establecido de carrera con ruedas; los ratones tuvieron acceso a ruedas giratorias libres; Se alcanzó una rutina de VE estable dentro de los 7 días posteriores al entrenamiento y se continuó durante otros 21 días de VE (Fig. 6a). Se registró la distancia de carrera diaria y no se detectaron diferencias significativas entre los ratones Ctrl (14.38 km) y iKO (13.78 km) (Fig. 6a, b).
a Esquema del diseño experimental para VE. b Cuantificación de células Myod+ en los músculos TA anteriores. p = 0.54, 0.00024, 0.00049 y 0.0024. c Tinción IF de Pax7 (verde) y MyoD (rojo) en SC aisladas de los ratones anteriores y cultivadas durante 24 h clasificadas. Barra de escala: 50 μm. p = 0.91, 0.00035, 0.000018 y 0.000032. d EdU (rojo) se tiñó en SC seleccionadas de los ratones anteriores y se cultivó durante 24 h. Barra de escala: 50 μm. p = 0.90, 0.0010, 0.00013 y 0.046. e Tinción H&E de los músculos TA anteriores. Barra de escala: 50 μm. p = 0.00043, 0.0073, 0.00021 y 0.00047. f Tamaño de las fibras de los músculos TA anteriores (e). p = 0.54, 0.19, 0.012 y 0.0017. g Cuantificación de Pax7 + SC en los músculos TA anteriores. p = 0.66, 0.000023, 0.000052 y 0.0017. h Esquema del diseño experimental (EE). i Cuantificación de células Myod+ en los músculos TA recolectadas de los ratones Ctrl e iKO anteriores con o sin EE. p = 0.0000026, 0.0010, 0.0000073 y 0.0000015. j Tinción IF de Pax7 (verde) y MyoD (rojo) en SC seleccionadas de los ratones anteriores y cultivadas durante 24 h. Barra de escala: 50 μm. p = 0.000062, 0.00035, 0.035 y 0.0000018. k Se tiñó EdU (rojo) en SC aisladas de los ratones anteriores y se cultivó durante 24 h. Barra de escala: 50 μm. p = 0.00031, 0.0010, 0.00034 y 0.0012. l Tinción H&E de los músculos TA anteriores. Barra de escala: 50 μm. p = 0.0000039, 0.0073, 0.000000071 y 0.00000026. m Tamaño de las fibras de los músculos TA anteriores (l). p = 0.0022, 0.19, 0.91 y 0.0012. n Cuantificación de Pax7 + SC según los músculos TA anteriores. p = 0.000018, 0.000024, 0.0067 y 0.0049. n = 5 ratones por grupo (b–g, i–n). Todos los gráficos de barras se presentan como media ± DE. Estudiantes t Se utilizó la prueba (no pareada de dos colas) para calcular la significación estadística (b–g, i–n): *p < 0.05, **p <0.01, ***p < 0.001. No tiene importancia. Los datos de origen se proporcionan como un archivo de datos de origen.
Como era de esperar, las expresiones de los miembros de la familia AP-1 fueron inducidas por VE en Ctrl SC (Figura complementaria. 6c). También consistente con informes anteriores.54, la VE no indujo la activación de SC en los ratones Ctrl ya que no se detectaron células MyoD+ en las secciones musculares antes y después de la VE (Fig. 6b y Fig. Suplementaria. 6d); consistentemente, la tinción Pax7+MyoD+ de FISC (Fig. 6c) o tinción con EdU de ASC cultivadas durante 24 h (Fig. 6d) no reveló una mayor tasa de activación antes y después de la VE. Por el contrario, las células iKO fueron activadas fácilmente por la VE (Fig. 6b–d y Fig. Suplementaria. 6d). Consistentemente, en los músculos iKO, también detectamos un número significativamente mayor de fibras CLN (aumento del 136%) (Fig. 6e) e hipertrofia evidente (el tamaño de las fibras aumentó un 43.3%) tras la VE (Fig. 6f). En los músculos Ctrl, el número de CLN aumentó después de la VE, pero no lo suficiente como para causar un crecimiento hipertrófico (Fig. 6e,f). Por lo tanto, los hallazgos anteriores refuerzan la idea de que la pérdida de ATF3 induce una rápida activación de las SC por parte de la VE. Como resultado, hubo una reducción del conjunto de SC (disminución del 38.2 % de FISC Pax7+) al final del régimen VE (Fig. 6g y Fig. Suplementaria. 6e).
Dado que se sabe que EE causa activación SC e hipertrofia muscular50,51,52,53, a continuación examinamos si el atf3 La deficiencia afecta la activación de SC inducida por EE. Para ello, se sometió a ratones Ctrl e iKO a un régimen de carrera en cinta rodante.55,56 en el que la cinta de correr se colocó con una inclinación de 5° y una velocidad de 20 cm/s durante 60 min. Después de cinco dosis de inyección de TMX, los ratones fueron entrenados durante un período de adaptación de 5 días, seguido por un entrenamiento de resistencia de 10 días (+EE) o, como condición de control, sin ningún entrenamiento (NE) (Fig. 6h). Como se esperaba, las expresiones de los miembros de la familia AP-1 fueron rápidamente inducidas por el EE en las SC (Fig. 6c). Además, el EE provocó una activación SC evidente en los músculos Ctrl, pero la activación fue mucho más fuerte en los músculos iKO (Fig. 6i-k y Fig. Suplementaria. 6f). Consistentemente, se indujeron fibras CLN en los músculos Ctrl e iKO después del EE; y se observó un mayor aumento de fibras CLN en los músculos iKO en comparación con los músculos Ctrl (Fig. 6l). Además, tanto los músculos Ctrl como iKO mostraron un crecimiento hipertrófico después del EE, pero no se detectó diferencia (Fig. 6m). Al final del régimen EE, el número de Pax7+ FISC aumentó significativamente en Ctrl pero disminuyó en iKO (Fig. 6n y Fig. Suplementaria. 6g), lo que indica el rápido agotamiento del grupo de iKO SC. En conjunto, estos hallazgos indican que la pérdida de ATF3 provoca la activación de SC por VE y también mejora la activación de SC por EE.
ATF3 regula H2B Expresión genética y patrones de nucleosomas.
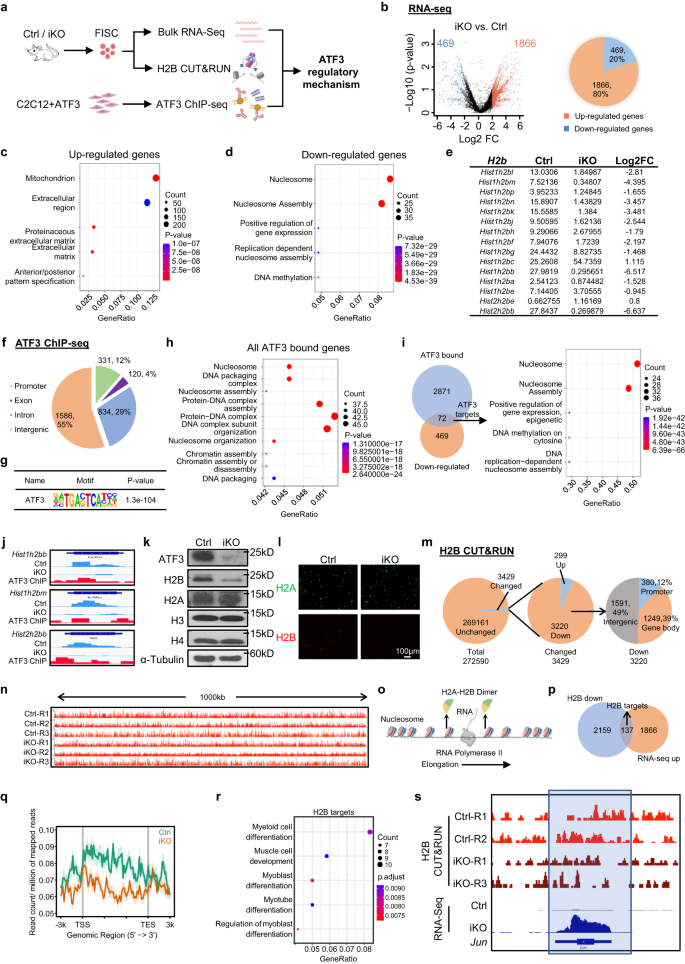
En conjunto, los resultados anteriores sugieren un papel esencial de la inducción de ATF3 en la prevención de la activación precoz de SC; para iluminar el mecanismo molecular subyacente, perfilamos la salida transcripcional de ATF3 realizando RNA-Seq en FISC recolectadas de los músculos Ctrl e iKO (Fig. 7a). Un total de 1866 transcripciones (puntos rojos) (79.9%) estaban reguladas positivamente en iKO en comparación con Ctrl, mientras que 469 (puntos azules) (20.1%) estaban reguladas negativamente (Fig. 7b, Fig. Suplementaria 7a y datos complementarios 1), lo que sugiere que la pérdida de ATF3 indujo una activación transcripcional global. El análisis GO reveló que los genes regulados positivamente estaban enriquecidos en "mitocondria", "matriz extracelular", etc. (Fig. 7c y datos complementarios 1). Es de destacar que la actividad mitocondrial elevada y la expresión de la matriz extracelular se han descrito previamente en GAlertar células10, lo que sugiere que ATF3 funciona para reprimir la expresión de estos genes activadores, previniendo así la activación prematura de SC. Curiosamente, los genes regulados negativamente se enriquecieron para el “nucleosoma” y el “ensamblaje de nucleosoma”, etc. (Fig. 7d y datos complementarios 1). En particular, los genes que codifican las proteínas histonas estaban altamente representados entre los genes regulados negativamente (Fig. 7e), que también fue confirmado por RT-qPCR (disminución del 19% al 46%) (Fig. 7b). Los genes que codifican histonas generalmente se organizan en grupos multigénicos y la proteína H2B está codificada por 2 grupos de genes con 15 en Chr13 formando un hist1h2b grupo y 2 en Chr3 formando un hist2h2b grupo (Fig. 7c). Sorprendentemente, 13 de los 17 H2b Los genes estaban regulados negativamente en los SC iKO (Fig. 7e). Además, también realizamos RNA-Seq en FISC aislados de Ctrl y atf3-Se obtuvieron ratones cKO y resultados similares (Fig. 7d-g y datos complementarios 3). Estos resultados demuestran que la pérdida de ATF3 disminuye H2b la expresion genica.
a Esquema del diseño experimental. Creado con BioRender.com. b Los DEG se identificaron a partir de Ctrl frente a iKO RNA-seq. c, d Análisis GO de los genes regulados hacia arriba y hacia abajo anteriores. e FPKM y Log2FC de H2b genes en iKO vs. Ctrl. f Distribución genómica de 2871 picos de unión a ATF3. g Enriquecimiento de motivos ATF3 canónicos en las regiones de unión anteriores. h Análisis GO para todos los genes anteriores con unión a ATF3. i Izquierda: diagramas de Venn que muestran la superposición (72 genes) entre el objetivo ChIP-Seq identificado anteriormente (2871) y los genes regulados negativamente (469). Derecha: el análisis GO de los 72 genes anteriores reveló un enriquecimiento extremo de los términos relacionados con las histonas. j Instantáneas genómicas de 3 de los identificados anteriormente H2b genes con unión a ATF3 en sus TSS (pistas ChIP-Seq) y regulados negativamente por la eliminación de ATF3 (pistas RNA-Seq). k Las proteínas ATF3, H2A, H2B, H3 y H4 se midieron mediante transferencia Western en FISC de ratones Ctrl e iKO. Se utilizó α-tubulina como control de carga. l Tinción IF de H2A (verde) y H2B (rojo) en los FISC anteriores. Barra de escala: 100 μm; n = 3 ratones por grupo. m Gráficos circulares que muestran el número de contenedores con H2B cambiado (3429, 299 arriba y 3220 abajo) y sin cambios (269161) (izquierda y centro), y la distribución genómica de señales H2B reguladas negativamente (derecha). n Instantáneas genómicas de una región de 1000 kb del visor de genómica integradora (IGV) de la señal H2B en Ctrl frente a iKO en Chr4. o Esquema del proceso de elongación de la ARN polimerasa II durante la transcripción del ADN. Creado con BioRender.com. p Diagramas de Venn que muestran la superposición (137 genes) entre las regiones anteriores con señales H2B CUT&RUN reguladas negativamente (2159) y los genes regulados positivamente (1866) de la secuencia de ARN (A) anterior. q Metatramas que muestran señales H2B CUT&RUN promedio de 3 kb en sentido ascendente y descendente de TSS. r Análisis GO de los 252 genes anteriores de (P). s Instantáneas genómicas de Jun gen que muestra una señal H2B CUT&RUN regulada negativamente y una señal RNA-Seq regulada positivamente en iKO frente a Ctrl. Las regiones con reducción de señal H2B en iKO frente a Ctrl están resaltadas en un marco azul. Los datos de origen se proporcionan como un archivo de datos de origen.
A continuación, realizamos ChIP-Seq en los mioblastos C2C12 con sobreexpresión exógena de ATF3 como un sistema sustituto para definir objetivos de unión directa de ATF3 (Fig. 7a y Fig. Suplementaria. 7h). Se identificaron un total de 2871 picos de unión en 869 genes, con el 60%, 28% y 9% ubicados en regiones intergénicas, intrones y promotores, respectivamente (Fig. 7f y datos complementarios 2). Estos picos se enriquecieron con el conocido motivo de unión a ATF3, TGACTCA (Fig. 7g), lo que da fe de la buena calidad de los datos. El análisis GO de estos genes unidos a ATF3 indicó un enriquecimiento notable para los términos relacionados con el nucleosoma (Fig. 7h y datos complementarios 2). Al integrar los resultados de RNA-Seq y ChIP-Seq, 72 genes regulados negativamente contenían sitios de unión de ATF3 y nuevamente se enriquecieron en términos GO relacionados con nucleosomas y muchos eran genes de histonas (Fig. 7i y datos complementarios 2). En particular, 8 de los 13 regulados a la baja H2b Los genes tenían sitios de unión a ATF3 en sus promotores (Fig. 7i,j, Fig. Suplementaria 7i y datos complementarios 2). Mientras tanto, 112 genes regulados positivamente poseían unión a ATF3 y se enriquecieron en términos GO relacionados con las mitocondrias (Fig. 7j y datos complementarios 2). La transferencia Western (Fig. 7k) y tinción IF (Fig. 7l) los resultados confirmaron una reducción sustancial o casi una pérdida de la proteína H2B en los FISC de iKO, mientras que otras proteínas histonas como H3, H4 y H2A permanecieron inalteradas. Estos resultados demuestran que H2b Los genes son objetivos transcripcionales auténticos de ATF3.
La disminución global de histonas conduce a una disminución de la cantidad de nucleosomas, a un aumento del espaciamiento de los nucleosomas y altera la ocupación de los nucleosomas, lo que afecta la transcripción.57,58,59, para determinar si la pérdida de H2B en los SC iKO altera el posicionamiento y la ocupación de los nucleosomas, ensayo CUT&RUN60,61 Se realizó para mapear la localización genómica de H2B en células Ctrl e iKO (Fig. 7a). Se definieron un total de 272590 contenedores en todo el genoma a partir de las tres réplicas (Datos complementarios 4). Inesperadamente, las señales promedio de H2B CUT&RUN se mantuvieron prácticamente inalteradas en iKO frente a Ctrl, con solo 3429 contenedores (1.4%) mostrando cambios (Fig. 7m, norte). Sin embargo, 3220 de los contenedores alterados mostraron una disminución del enriquecimiento de H2B en varias regiones genómicas, incluido el promotor (12%), el cuerpo genético (39%) y las regiones intergénicas (49%). 7m). Dado que el nucleosoma se desmonta parcialmente mediante la eliminación de un dímero H2A-H2B para facilitar la transcripción de Pol II61 (Higo. 7o), planteamos la hipótesis de que la pérdida local de H2B podría facilitar la desestabilización del nucleosoma para promover la transcripción de genes asociados. De hecho, al cruzarse con los datos de RNA-Seq, 137 genes regulados positivamente mostraron señales H2B disminuidas en sus promotores o cuerpos genéticos (Fig. 7p,q y datos complementarios 4). Estos genes diana H2B se enriquecieron con términos GO relacionados con la diferenciación muscular y también se incluyeron id3, IGF-1 y Jun, etc. (Fig. 7r,s), que era consistente con el estado de activación de los iKO SC11,62,63. En conjunto, estos hallazgos demuestran que la disminución del nivel de H2B podría mediar la activación precoz de SC después de la pérdida de ATF3.
H2B media la función ATF3 en la activación SC y la regeneración muscular
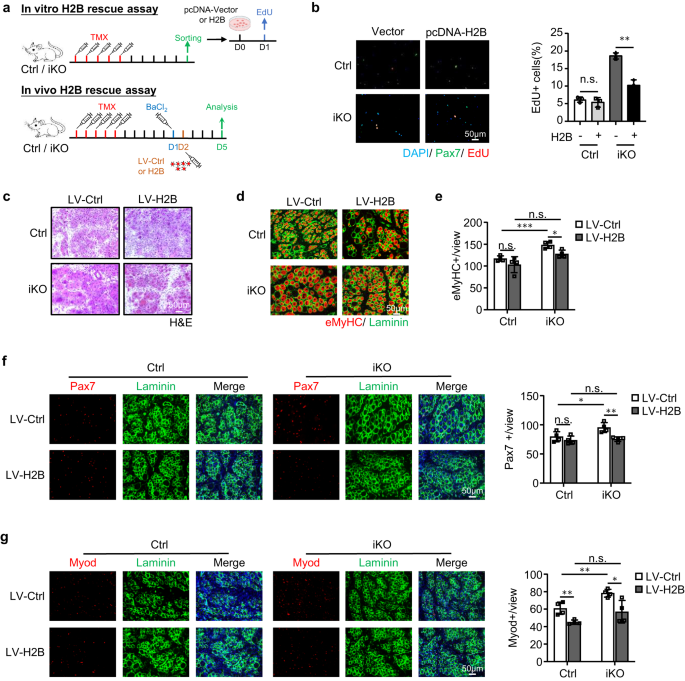
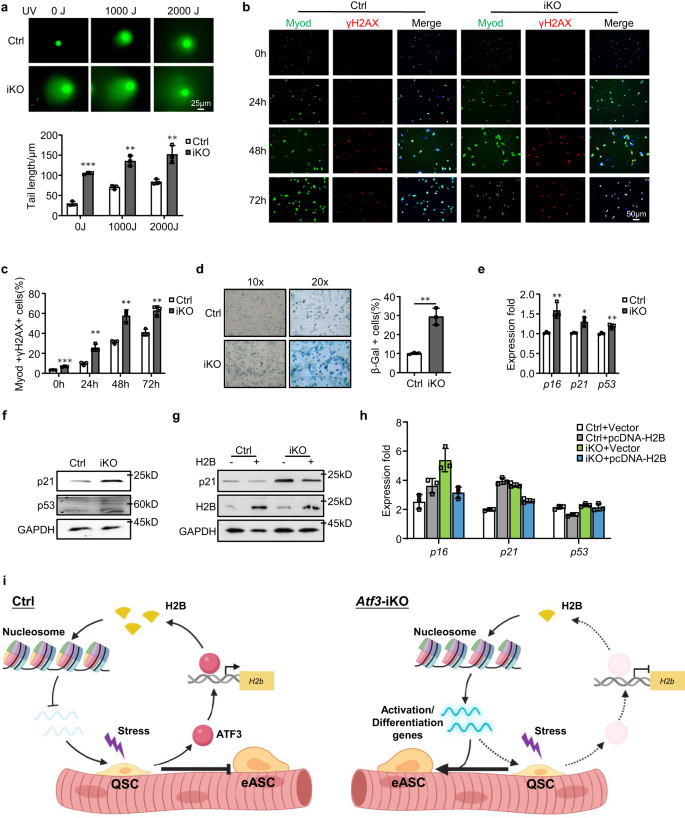
Para solidificar el vínculo funcional entre ATF3 y H2B en la activación de SC y la regeneración muscular, encontramos que la sobreexpresión de H2B mediante la transfección de un plásmido pcDNA-H2B en FISC de hecho reprimió la activación acelerada de las células Atf3 iKO, pero no tuvo impacto en las células Ctrl (Fig. 8a, b). E in vivo, también sobreexpresamos H2B (Fig. 7k) mediante inyección intramuscular de partículas lentivirales a 1 ppp (Fig. 8a). Como se muestra en la Fig. 8c-g, esto también restableció la regeneración inducida por lesión aguda en los ratones Atf3-iKO: se observó un número significativamente menor de fibras eMyHC+ a 5 ppp (Fig. 8d, e), que estuvo acompañado de un número reducido de células Pax7+ (Fig. 8f) y células MyoD+ (Fig. 8g). En conjunto, estos hallazgos validan que la pérdida de H2B media la activación precoz de SC y la mayor regeneración muscular observada tras la pérdida de ATF3.
a Arriba: esquema para la sobreexpresión de H2B in vitro. Se transfectaron FISC de ratones Ctrl o iKO con un control (Ctrl) o un plásmido pCDNA-H2B y se realizó un ensayo EdU para evaluar la activación de SC. Inferior: Esquema para la sobreexpresión de H2B in vivo mediante lentivirus. Se inyectó lentivirus que expresa H2B en los músculos Ctrl o iKO TA 1 día después de BaCl2 La lesión y los músculos se recogieron 5 días después de la infección para su análisis. b Izquierda: las células transfectadas anteriormente se cultivaron durante 24 h antes de tratarse con EdU durante 6 h; Las células EdU positivas se tiñeron y cuantificaron. Barra de escala: 50 μm; n = 3 ratones por grupo. p = 0.44 y 0.0013. c Tinción H&E de los músculos TA anteriores recolectados a 5 ppp después de la infección. Barra de escala: 50 μm. n = 4 ratones por grupo. d La tinción IF de eMyHC (rojo) y Laminin (verde) se realizó en los músculos TA anteriores. Barra de escala: 50 μm. e Se cuantificó el número de fibras eMyHC+ por vista. n = 4 ratones por grupo. De izquierda a derecha, p = 0.20, 0.00081, 0.052 y 0.012. f Izquierda: se realizó tinción IF de Pax7 (rojo) y Laminin (verde) en los músculos TA anteriores. Barra de escala: 50 μm. Derecha: se cuantificó el número de células Pax7+ por vista. n = 4 ratones por grupo. De izquierda a derecha, p = 0.33, 0.041, 0.67 y 0.0052. g Izquierda: se realizó tinción IF de Myod (rojo) y Laminin (verde) en los músculos TA anteriores. Barra de escala: 50 μm. Derecha: se cuantificó el número de células Myod+ por vista. n = 4 ratones por grupo. De izquierda a derecha, p = 0.0053, 0.0058, 0.12 y 0.020. Todos los gráficos de barras se presentan como media ± DE. Estudiantes t Se utilizó la prueba (no pareada de dos colas) para calcular la significación estadística (b, e–g): *p < 0.05, **p <0.01, ***p < 0.001. No tiene importancia. Los datos de origen se proporcionan como un archivo de datos de origen.
La pérdida de H2B aumenta el daño al ADN y la senescencia en atf3 iKO SC
Para dilucidar aún más las consecuencias de la pérdida de H2B en las SC, examinamos la inestabilidad del genoma y la senescencia celular considerando que las proteínas histonas son importantes para la integridad de la cromatina y la estabilidad del genoma.57,59. Los FISC de los músculos iKO o Ctrl se trataron con varias dosis (0, 1000 o 2000 J) de luz ultravioleta y se realizó el ensayo del cometa. De hecho, se observó un aumento sustancial en la longitud de la cola del cometa con las tres dosis del iKO en comparación con el Ctrl (Fig. 9a), lo que sugiere que la disminución de H2B provoca inestabilidad genómica. Esto fue confirmado aún más por un porcentaje mucho mayor de células γH2AX+ en las células iKO cultivadas en comparación con Ctrl (Fig. 9b, c). Para examinar si la inestabilidad genómica conduce a la senescencia celular, las células se cultivaron en medio de crecimiento durante 9 días y se realizó tinción con β-Gal; Se detectó un aumento del 19% de células β-Gal+ en el iKO en comparación con el Ctrl (Fig. 9d). Consistentemente, una importante regulación al alza de p16, p21y p53 ARNm (Fig. 9e) y también se detectó un mayor nivel de proteínas p21 y p53 en el iKO (Fig. 9f). En conjunto, los hallazgos anteriores demuestran que la pérdida de H2B conduce a una mayor inestabilidad del genoma y senescencia celular en el atf3 Células iKO. Como era de esperar, la sobreexpresión de H2B en las células iKO redujo la acumulación de daño en el ADN e inhibió la senescencia celular, según lo evaluado por la disminución de la proteína p21 (Fig. 9g) Así como p16, p21 y p53 ARNm (Fig. 9h). Estos resultados indican que la disminución de la expresión de H2B hace que las SC experimenten senescencia replicativa.
a El ensayo Comet se realizó en SC Ctrl o iKO después de un tratamiento con luz UV de 0, 1000 o 2000 J. Barra de escala: 25 μm. n = 3 ratones por grupo. p = 0.000029, 0.0012 y 0.0071. b La tinción IF de γH2AX (rojo) y Myod (verde) se realizó en SC de ratones Ctrl o iKO después de cultivarlos durante 0, 24, 48 o 72 h. Barra de escala: 50 μm. c Cuantificación de los porcentajes de células Myod+/γH2AX+; n = 3 ratones por grupo. p = 0.00014, 0.0024, 0.0021 y 0.0031. d La tinción con β-Gal (azul) se realizó en SC de ratones Ctrl o iKO después de cultivarlos durante 9 días. n = 3 ratones por grupo. p = 0.0017. e Expresión de los genes marcadores de senescencia seleccionados, incluidos p16, p21 y p53 en SC de Ctrl e iKO se cuantificó mediante RT-qPCR. p = 0.0078, 0.011 y 0.0061. f Los niveles de proteína p21 y p53 se detectaron mediante transferencia Western en SC de ratones Ctrl e iKO. Se utilizó GAPDH como control de carga. g, h Las SC de ratones Ctrl e iKO se transfectaron con un plásmido de control de vector o que sobreexpresa H2B. 96 h después de la transfección, la expresión de los genes indicados se detectó mediante transferencia Western y RT-qPCR. Se utilizó GAPDH como control de carga. i Modelo esquemático que representa el papel funcional de ATF3 en la prevención de la activación precoz de SC. En el músculo homeostático, la rápida inducción de ATF3 ante un estrés menor promueve H2b expresión para mantener el posicionamiento adecuado de los nucleosomas y suprimir la expresión de genes de activación, evitando así la activación precoz de las SC. Tras la pérdida de ATF3, se produce una deficiencia de H2B, lo que conduce a una alteración del posicionamiento de los nucleosomas y una regulación positiva de los genes de activación, lo que hace que las SC rompan la inactividad y entren en una etapa de activación temprana. Creado con BioRender.com. Todos los gráficos de barras se presentan como media ± DE. Estudiantes t Se utilizó la prueba (no pareada de dos colas) para calcular la significación estadística (a, c–e): *p < 0.05, **p <0.01, ***p < 0.001. No tiene importancia. Los datos de origen se proporcionan como un archivo de datos de origen.
Detección de otros miembros funcionales de la familia AP-1 en SC y regeneración
Después de la caracterización holística anterior de la función y el mecanismo de ATF3 en SC, buscamos ampliar el estudio preguntando si otros TF de la familia AP-1, como ATF4, FOS, FOSB y JUNB, también desempeñan roles funcionales en SC considerando sus características similares. Dinámica de inducción rápida y transitoria durante la activación temprana del SC (Figs. 1b–d y S1c). Para probar la idea, realizamos una evaluación funcional utilizando nuestro recientemente desarrollado pax7Cas9/Plataforma de edición del genoma in vivo mediada por AAV-sgRNA64, que se basa en ratones knock-in Cas9 dependientes de Cre y administración de sgRNA mediada por AAV. Brevemente, se seleccionó un par de sgRNA dirigidos a cada TF y se empaquetó en partículas de virus AAV9; 4×1011 Se inyectaron genomas virales (vg)/ratón de AAV9-sgRNA por vía intramuscular (IM) en los músculos TA de pax7Cas9 ratones con una edad posnatal (P) de 10 días (P10). Para el grupo de control (Ctrl), se inyectó la misma dosis de virus AAV9 que contenía el esqueleto del vector pAAV9-sgRNA sin ninguna inserción de sgRNA. Luego, los ratones fueron sacrificados para aislamiento SC y análisis después de ocho semanas (Fig. S8a). Se confirmó la eficiencia exitosa de la edición de ADN para los cuatro TF (Fig. 8b-e); De manera consistente, WB detectó la eliminación (KD) de cada proteína en diversos grados (52.4% –83.6%) (Fig. 7b-e) o IF (Fig. 8f) a pesar de los niveles de ARNm inalterados (Fig. 8g).
Para examinar el efecto del AP-1 TF KD anterior sobre la activación de SC, se cultivaron FISC de cada mutante para el ensayo EdU in vitro (Fig. 8a). Similar a atf3 KO, el Fos-Las células KD mostraron una activación SC acelerada mientras que las JunB-KD mostró una activación embotada; el atf4 or FosB-KD, por otro lado, no tuvo ningún impacto (Figura complementaria. 8h). Al medir las células Pax7+ en los músculos ilesos de aproximadamente 2 meses de edad, curiosamente, se observaron números reducidos en los músculos ilesos. atf4, Fos or JunB-KD (Figura complementaria. 8i), lo que sugiere una pérdida del grupo de SC. desde el atf4 or JunB-KD no provocó una activación precoz de SC, la pérdida del número de SC puede deberse a otras razones considerando que la eliminación ocurrió muy temprano en la etapa posnatal.64. FosB-KD no tuvo ningún impacto en el grupo de Pax7+ SC.
Para investigar más a fondo el impacto sobre la capacidad regenerativa muscular, BaCl2 se inyectó 7 semanas después de la inyección de AAV (Fig. 8a) y la regeneración fue evaluada por H&E (Fig. 8j), eMyHC (Fig. 8k), Pax7 (Fig. 8l) y MyoD (Fig. 8m) tinción a 5 ppp. Se reveló una regeneración deteriorada en el atf4 y Fos-KD presumiblemente debido al agotamiento de los SC después de su eliminación a largo plazo; La regeneración en el JunB-KD también se vio comprometido probablemente debido a un grupo reducido de SC; consistentemente, no se observó ningún impacto en la regeneración en el FosB-K.D. En conjunto, nuestros resultados indican que estos miembros de la familia AP-1 pueden desempeñar diversas funciones en la activación de SC y la regeneración muscular.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Automoción / vehículos eléctricos, Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- ChartPrime. Eleve su juego comercial con ChartPrime. Accede Aquí.
- Desplazamientos de bloque. Modernización de la propiedad de compensaciones ambientales. Accede Aquí.
- Fuente: https://www.nature.com/articles/s41467-023-40465-w