El Instituto Nacional de Estándares y Tecnología (NIST) de EE. UU. publicó el 8 de diciembre directrices que invitan a comentar sobre el uso de March en derechos. Jyotpreet Kaur, pasante de SpicyIP, escribe sobre estos derechos, los cambios propuestos en las directrices y la posición de la India sobre acuerdos similares. Esta publicación ha sido escrita con aportes de Swaraj. Jyotpreet es un estudiante de derecho de tercer año de la Universidad Nacional de Derecho de Delhi que está interesado en los derechos de propiedad intelectual y el derecho de la competencia y busca estudiar su interacción entre sí. Se puede acceder a sus publicaciones anteriores. esta página.

Revisión por parte de Estados Unidos de los derechos de entrada y algunas preguntas sobre una contraparte india
Por Jyotpreet Kaur
Como muchos lectores sabrán, el gobierno de Estados Unidos, especialmente a través de su oficina del Representante Comercial de Estados Unidos, había estado persiguiendo a la India durante años después de que se le concediera una única licencia obligatoria, sujeta a mucho escrutinio judicial. Fue sólo durante el COVID-19 que esta presión dejó de aplicarse tan descaradamente (con un giro hacia los “secretos comerciales” en su lugar). En un giro muy interesante de los acontecimientos, parece que EE.UU. está avanzando hacia directrices que amplían cómo puede aplicar su propia versión de licencias obligatorias, también conocidas como derechos de “marcha de entrada”, a nivel nacional. Parece que la presión interna resultante de sus costos de atención médica cada vez mayores ha llegado a un punto en el que finalmente hay un reexamen de cómo su sistema de patentes está afectando los costos. El 8 de diciembre, el Instituto Nacional de Estándares y Tecnología (NIST) publicó un borrador orientaciones invitando a comentar sobre el uso de los derechos de “marcha de entrada” para promover el objetivo de la administración Biden de reducir los precios de los medicamentos. Según el NIST, el gobierno de EE. UU. invierte aproximadamente 115 mil millones de dólares en I+D a través de varias universidades, organizaciones sin fines de lucro y empresas. Los derechos de entrada son disposiciones que permiten al gobierno exigir una licencia para las invenciones que surjan de esta inversión, previo cumplimiento de ciertas condiciones. En particular, aunque la “amenaza” de los derechos de Marcha ya se ha mencionado antes, en realidad no se han ejercido en los 44 años transcurridos desde que entró en vigor la ley que los rige. El objetivo de este proyecto de directrices parece ser la ampliación de los criterios bajo los cuales se pueden ejercer los derechos de entrada. El Secretario de Salud y Servicios Humanos de EE.UU. aclamado esto como una “herramienta poderosa para garantizar que el contribuyente estadounidense obtenga un retorno justo de su inversión”.
Equilibrar la innovación y el interés público: los objetivos de la Ley Bayh-Dole frente a los derechos de marcha
La Ley Bayh-Dole promulgada en 1980 puso de relieve, entre otras cosas, los derechos de “marcha hacia adentro” del gobierno federal. Como se mencionó anteriormente, los derechos de entrada son similares a medidas inherentes disponibles para el gobierno en caso de que quienes desarrollan DPI a partir de investigaciones financiadas por el gobierno no hayan comercializado adecuadamente la propiedad intelectual. Al ejercer este poder, los gobiernos pueden intervenir y dirigir el uso de los DPI o otorgar licencias a un tercero. La propiedad de la patente sigue siendo del instituto; es sólo un derecho de concesión de licencias a terceros que se adquiere a favor del gobierno si decide ejercer este derecho. El propósito de este derecho es permitir que el gobierno aproveche plenamente el potencial del DPI financiado con fondos públicos en cuestión si el instituto de inventores lo subutiliza.
El ejercicio de los derechos de entrada en virtud de la Ley Bayh-Dole está previsto en 35 U.S.C. § 203, que exige el cumplimiento de cuatro criterios legales. Estos son (i) no lograr implementar efectivamente la innovación en cuestión; (ii) la necesidad de aliviar necesidades de salud o seguridad no atendidas; (iii) incumplimiento de los requisitos de uso público de la invención; y (iv) incumplimiento de obligaciones contractuales, especialmente según el art. 4., que exige que los productos patentados se fabriquen en gran medida en Estados Unidos hasta que sea comercialmente inviable.
Hasta la fecha, el gobierno de Estados Unidos no ha ejercido el derecho de manifestación a pesar de las peticiones que solicitan lo mismo. La primera vez que se presentó una petición para el ejercicio del derecho de entrada fue en sobre CellPro donde el Gobierno se negó a ejercer este derecho. Esta tendencia ha continuado hasta la fecha como se puede ver en la ocho peticiones que han sido presentados ante el NIH y han sido eliminados.
Renovación de los derechos de entrada: ¿receta para el desastre o fórmula para el éxito?
Uno de los cambios introducidos a través de las directrices ha sido aclarar el proceso informal de consulta de la agencia con el contratista antes del ejercicio de los derechos de entrada y aumentar el plazo permitido que tiene una agencia para responder al contratista después de la consulta informal de 60 días a 120 días.
Aparte de esto, las nuevas directrices introducen un método de tres pasos que parece aclarar el proceso para invocar los derechos de entrada (ver imagen). En primer lugar, hay que comprobar si la Ley Bayh-Dole se aplica a las invenciones en cuestión; aquí se comprueba si dichas invenciones son “invenciones sujetas” y si están financiadas por el gobierno. En segundo lugar, si alguno de los cuatro criterios legales, como se mencionó anteriormente, es aplicable al caso que nos ocupa y, finalmente, si el ejercicio de los derechos de entrada se ajusta al espíritu general de la legislación Bayh-Dole y sus objetivos.
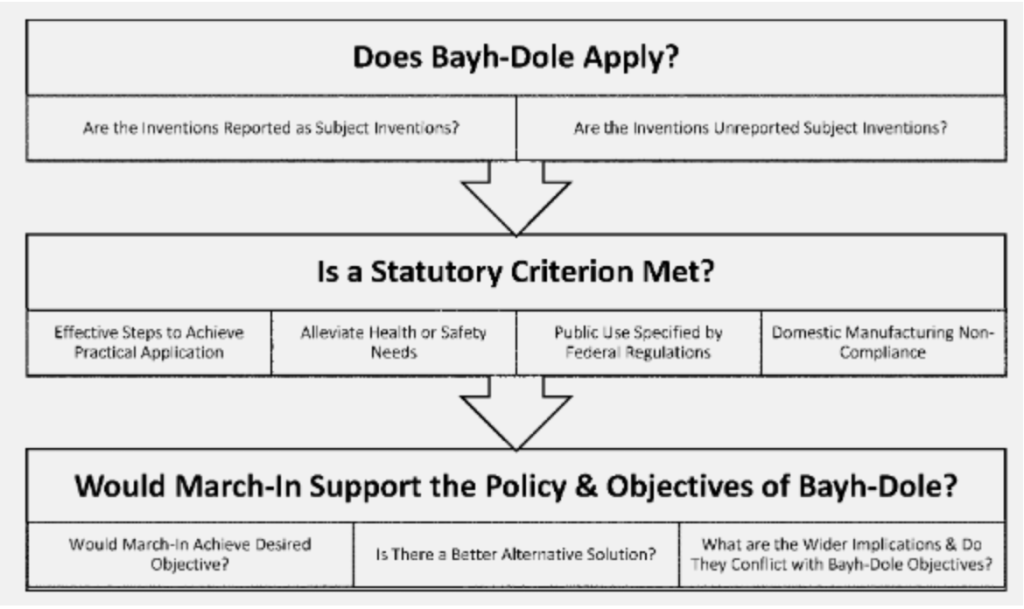
Quizás el cambio más importante se ve en el segundo paso al invocar el primer criterio legal, es decir, cuando el otorgante de la patente no ha tomado o no tomará medidas efectivas para la realización de la “innovación en cuestión” en su campo de uso. Las directrices han añadido una consideración de factores que pueden "limitar injustificadamente la disponibilidad de la invención para el público". En este caso, las directrices han introducido un requisito de fijación de precios razonables que anteriormente no se reconocía como criterio para el ejercicio de los derechos de entrada. Las directrices implican plantear la cuestión de si “el contratista o el licenciatario puso el producto a disposición sólo de un grupo reducido de consumidores o clientes debido a su alto precio”.
Esto contrasta con la postura anterior del gobierno, que puede evidenciarse en sus interacciones previas con los precios altos como motivo para ejercer una marcha hacia el interior. En 2004, el peticionario instó al NIH a invocar esta medida debido al alto precio de un medicamento para el tratamiento del VIH llamado Norvir y un medicamento para el tratamiento del glaucoma titulado Xalatan. En 2012, la preocupación por el alto precio de Norvir Se planteó nuevamente ante el NIH. Una vez más, en 2016, los peticionarios expresaron su preocupación por el alto precio de la Xtandí medicamento que cuesta alrededor de $98 por pastilla en comparación con otros países de altos ingresos. Sin embargo, en todos estos casos, el NIH se negó a ejercer su derecho de entrada simplemente por motivos de fijación de precios, citando otras razones para negarse a hacerlo.
Cuando las directrices hablan de precios razonables, no abordan lo que puede ser un precio “razonable”, dejando esto a discreción del gobierno federal.
Sus defensores saludan estas directrices como medidas progresistas para hacer que los medicamentos exorbitantes sean más accesibles al público estadounidense en general y para devolverle al público lo que es “legítimamente” suyo, ya que la investigación financiada con fondos federales se cubre esencialmente con el dinero de los contribuyentes.
Por otro lado, quienes se oponen a las directrices argumentan que son antitéticas a los objetivos de la Ley Bayh-Dole, ya que la fijación de precios nunca se concibió como motivo para ejercer los derechos de “marcha de entrada”. La Cámara de Comercio de Estados Unidos ha calificado estas directrices como una forma de “confiscación gubernamental”. Otros argumentan que tal cláusula inhibiría la innovación y la competencia, que son los objetivos principales de la ley. Algunos han argumentado que el objetivo de la Ley era fomentar la colaboración entre los sectores público y privado con el fin de introducir ideas novedosas en el mercado, a diferencia de lo que las directrices actuales pretenden lograr: aliviar los problemas de acceso a los medicamentos y las ineficiencias del mercado. Joseph Allen también ha argumentado que estas directrices son una "píldora venenosa" ya que, aunque están dirigidas a las "grandes farmacéuticas", terminarán perjudicando a los pequeños inventores que en realidad están cubiertos por la Ley Bayh-Dole porque la mayoría de las "grandes farmacéuticas" 'La investigación no está financiada por el gobierno. Al mismo tiempo, sostiene que estas directrices se han formulado teniendo en cuenta (sólo) los altos precios de los medicamentos e ignorando que el Bayh-Dole también cubre otras industrias como la energía, la agricultura y la protección del medio ambiente, que ahora se verán afectadas por la crisis. adversidades de estas directrices.
¿Qué está pasando en el frente indio?
Ahora que este debate se está tomando más en serio en Estados Unidos, ¿tendrá esto algún efecto indirecto en la India? Si bien las flexibilidades en materia de patentes de la India son bastante sólidas, y algunas, como la Sección 3(d) han hecho sentir su presencia, todavía tenemos que ver la traducción o la práctica de muchas otras disposiciones en efectos en el mundo real. Por ejemplo, aunque ha habido discusiones sobre licencias obligatorias para un par de otras drogas, no ha surgido nada de estas discusiones. No está claro en qué medida esto se debe a la presión externa, por ejemplo, a varios TLC y, por supuesto, al USTR; y cuánto de esto posiblemente se deba a otras razones. Por ejemplo, aunque la India estuvo entre los que estuvieron a la vanguardia al solicitar exenciones de propiedad intelectual durante la pandemia de Covid-19, irónicamente, a nivel nacional, aunque el Gobierno tenía una número de opciones que podría haber tomado, no se tomaron muchas medidas. Por ejemplo, el Gobierno no proporcionó claridad sobre la propiedad de los DPI (Covaxin) y su acto de “otorgar aprobación” al Instituto Haffkine fue algo que debería haber sido socavado por el interés público en el “derecho a la salud”, como se ha argumentado esta página y esta página. De manera similar, el Gobierno de la India se había negado a divulgar los datos de los ensayos clínicos a través de RTI citando la Sección 8(1)(d) y (e), que establece los derechos de propiedad intelectual como motivo para eximir la divulgación. El Estado ha invocado la protección de los DPI al rechazar la publicación de datos sin realizar el acto de equilibrio de sopesar esta protección con el interés público en juego (que también se ha dispuesto en el artículo 39(3) de los ADPIC). Por lo tanto, el Estado no ha ejercido su propia propiedad intelectual de manera abierta, en contraste con su postura internacional.
En cualquier caso, el debate interno de Estados Unidos sobre algo contra lo que han adoptado fuertes posiciones internacionales hasta la fecha es un acontecimiento interesante a seguir. En casa, el Departamento de Biotecnología publicó recientemente su propio conjunto de directrices de propiedad intelectual para invenciones que surjan de la financiación de DBT. ¿Cómo va esto? ¿Marca esto el comienzo de otro intento de resucitar el fallido “Proyecto de Ley de Protección y Utilización de la Propiedad Intelectual Financiada con Fondos Públicos”? Al mismo tiempo, el Gobierno presentó la Política Nacional de Investigación y Desarrollo e Innovación en el Sector Farma-MedTech (ver el borrador de la política esta página) en septiembre de 2023 para “transformar” el sector farmacéutico de la India y “catalizar” la I+D en estos sectores de una doble manera: fortaleciendo la infraestructura de investigación y promoviendo la investigación en el sector farmacéutico. En particular, esta política no aborda en absoluto cuestiones relacionadas con la propiedad intelectual. ¡Quizás todas estas sean algunas preguntas sobre las que vale la pena reflexionar y sobre las que intentaremos elaborar una publicación separada!
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- Fuente: https://spicyip.com/2024/01/the-us-review-of-march-in-rights-and-some-questions-on-an-indian-counterpart.html



