La levadura que carece de la esterol desaturasa C-5 Erg3 exhibe una sorprendente tolerancia mejorada a la escina
Nuestra hipótesis es que si la toxicidad de la escina está mediada por la interacción directa con el ergosterol, entonces los mutantes de la biosíntesis de ergosterol pueden diferir en la tolerancia a la escina. Se considera que los esteroles tienen un papel clave en el mantenimiento de la homeostasis de la dinámica de la membrana plasmática.28, sin embargo, las cepas de levadura que carecen de enzimas que catalizan los cinco pasos finales en la biosíntesis de ergosterol (Erg2, Erg3, Erg4, Erg5 o Erg6; Figs. 1by S1) son viables. Debido a la promiscuidad del sustrato de estas últimas enzimas en la biosíntesis de ergosterol, estos mutantes por deleción acumulan una mezcla de estructuras de esteroles, que difieren del ergosterol en el número y la posición de los dobles enlaces en el anillo B de esteroles y en la cadena lateral de esteroles.29. Utilizamos cultivos en microplacas de la cepa natural BY4741 (WT) y mutantes de Yeast Deletion Collection.30, para evaluar el crecimiento de los mutantes de la biosíntesis de ergosterol en medio rico complejo (YPD) en presencia y ausencia de escina (Fig. 1C). La extracción de esteroles y el análisis mediante cromatografía de gases-espectrometría de masas verificaron que el ergosterol no se acumulaba en las cepas mutantes (Figs. S2 y S3). La concentración inhibidora mínima (CMI) de escina para la cepa WT en medio YPD fue de 150 µg/ml. Se observaron MIC similares para el erg2Δ, erg4Δ, erg5Δ y erg6Δ cepas, sin embargo el crecimiento de la erg3La cepa Δ se desinhibió hasta la concentración más alta probada (1000 µg/mL; Fig. S4).
Análisis de transcriptomas
Para explorar más a fondo el impacto de la escina en las células WT y el mecanismo de tolerancia a la escina en erg3Δ, analizamos los transcriptomas de WT, erg3Δ y erg6Células Δ, tratadas con 0 o 100 g/ml de escina en YPD durante 1 h, en cultivos de matraces agitados. El erg6La cepa Δ se incluyó en este experimento ya que esta cepa comparte muchos fenotipos similares con erg3Δ29, pero no tiene tolerancia mejorada a la escina (CMI 150 µg/ml; Fig. 1C). Dentro del alcance de este experimento, también analizamos los transcriptomas de erg3Δ y erg6Δ células que fueron tratadas con 75 µg/ml de escina durante 1 h.
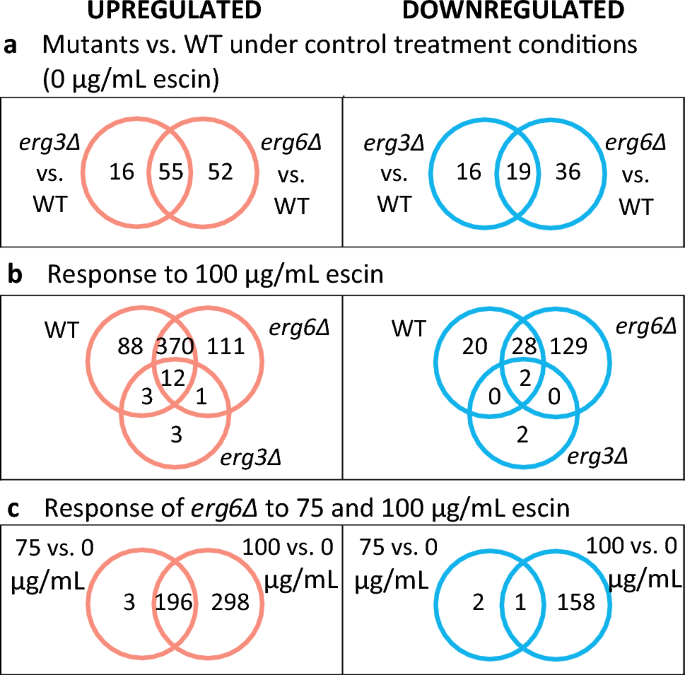
K significa agrupación de los 2000 genes con los niveles de expresión más variables como se muestra en la Fig. S5, con detalles completos del análisis de enriquecimiento de conjuntos de genes incluidos en la Información complementaria (SI). Los genes del grupo B (n = 82) se expresan en general en un nivel más alto en erg3Δ y erg6Δ en comparación con WT en todas las condiciones y, como se anticipó, este grupo está enriquecido en genes relacionados con la biosíntesis de esteroles, el transporte de esteroles, el transporte de sideróforos y la regulación de la transcripción por la glucosa. Los genes del grupo A (n = 821) están regulados negativamente en WT y erg6Δ en respuesta al tratamiento con escina. Este grupo está enriquecido en genes relacionados con la biogénesis de ribosomas y el procesamiento de ARN. Los genes del grupo C (n = 897) y D (n = 200) están en general regulados positivamente en WT y erg6Δ en respuesta al tratamiento con escina, con genes del grupo D regulados positivamente en mayor medida que el grupo C. El grupo D está enriquecido en genes relacionados con el metabolismo de trehalosa, manosa, fructosa y glutamato, así como con la glucólisis y la organización de la pared celular. El grupo D también está enriquecido en genes asociados con respuestas al estrés osmótico, oxidativo, térmico y de inanición. El grupo C está enriquecido en genes relacionados con la nucleofagia tardía, el catabolismo lipídico, la asimilación de azufre, el ciclo del ácido tricarboxílico y la gluconeogénesis.
Genes expresados diferencialmente (DEG) con expresión diferencial ≥ 2 veces entre condiciones de interés (Fig. 2) se analizan con más detalle a continuación, con detalles completos del enriquecimiento del conjunto de genes en SI.
Impacto de ERG3 y ERG6 deleción en el transcriptoma de levadura
La comparación de los transcriptomas de cepas en condiciones de control revela diferencias interesantes entre las cepas mutantes y WT. Eliminación de ERG6 da como resultado un mayor número de DEG (n = 162) que ERG3 eliminación (n = 106). En ambos mutantes, los DEG regulados positivamente están enriquecidos en genes relacionados con la biosíntesis y el transporte de esteroles, incluido el sensor de esteroles y el activador transcripcional. UPC2 (Higo. S6). Por el contrario, sólo un número muy pequeño de genes implicados en el suministro de esfingolípidos y fosfolípidos están regulados positivamente.YSR3, RSB1, FAA2 y ELO2 en ambas cepas, y además sur1 in erg6Δ; Higo. S7), aunque se han informado grandes cambios en la composición de los esfingolípidos para los mutantes de la biosíntesis de esteroles31.
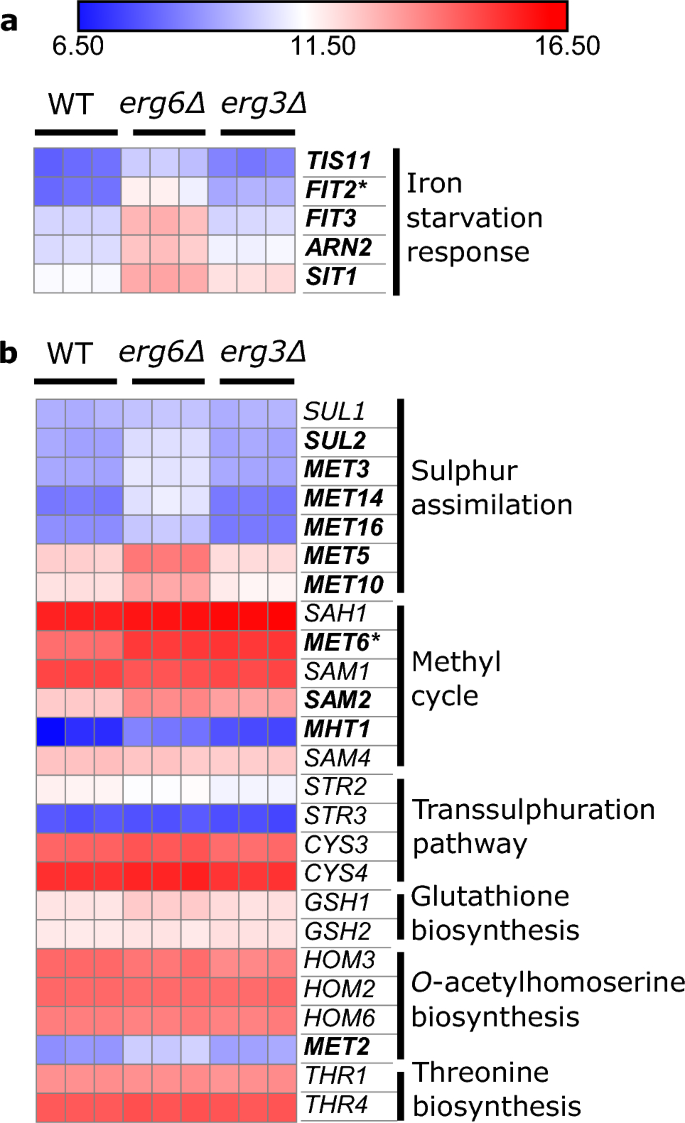
Los genes de las manoproteínas de la pared celular de la respuesta anaeróbica también están altamente regulados en ambas cepas (Fig. S8). Varios pasos de la biosíntesis de ergosterol requieren oxígeno y hierro como cofactores, y existe una compleja interacción entre las respuestas reguladoras al ergosterol, el oxígeno y el hierro.32,33,34,35. Varios genes de respuesta a la falta de hierro.36 están regulados positivamente en erg6Δ (FIT2, FIT3, ARN2, SIT1, TIS11), pero no erg3Δ, relativo a WT (Fig. 3a). Recientemente se ha informado que el factor de transcripción Aft1, que detecta el hierro y que generalmente se desplaza entre el citoplasma y el núcleo, se acumula en las vacuolas de las células con disminución de ergosterol. upc2Δ células37. Nuestros datos sugieren que esta vía de señalización puede verse afectada en diferentes grados en erg6Δ y erg3Δ.
El erg6La cepa Δ exhibe una expresión elevada de genes de asimilación de azufre y genes de respuesta a la falta de hierro. Expresión de genes relacionados con (a), homeostasis del hierro y (b), la vía de biosíntesis de metionina, en condiciones de control, unidades log2(CPM + 4). Atrevido; gen regulado positivamente ≥ 2 veces en erg6Δ versus peso. Asterisco; gen regulado positivamente ≥ 2 veces en erg3Δ versus WT (FDR ≤ 0.1).
Los genes del metabolismo de la metionina también están regulados positivamente en erg6Δ, pero no erg3Δ (Fig. 3b). Específicamente, los genes regulados positivamente están asociados con la vía de asimilación de azufre (SUL2, MET3, MET14, MET16, MET5, MET10), y el ciclo del metilo (MET6, SAM2, MHT1) que genera S-adenosilmetionina (SAM) (Fig. S9). La enzima Erg6 utiliza el donante de metilo SAM para metilar el zimosterol.38, y un Erg6–Anteriormente se había descubierto que la cepa deficiente acumulaba SAM, lo que se atribuyó a un menor consumo de SAM.39.
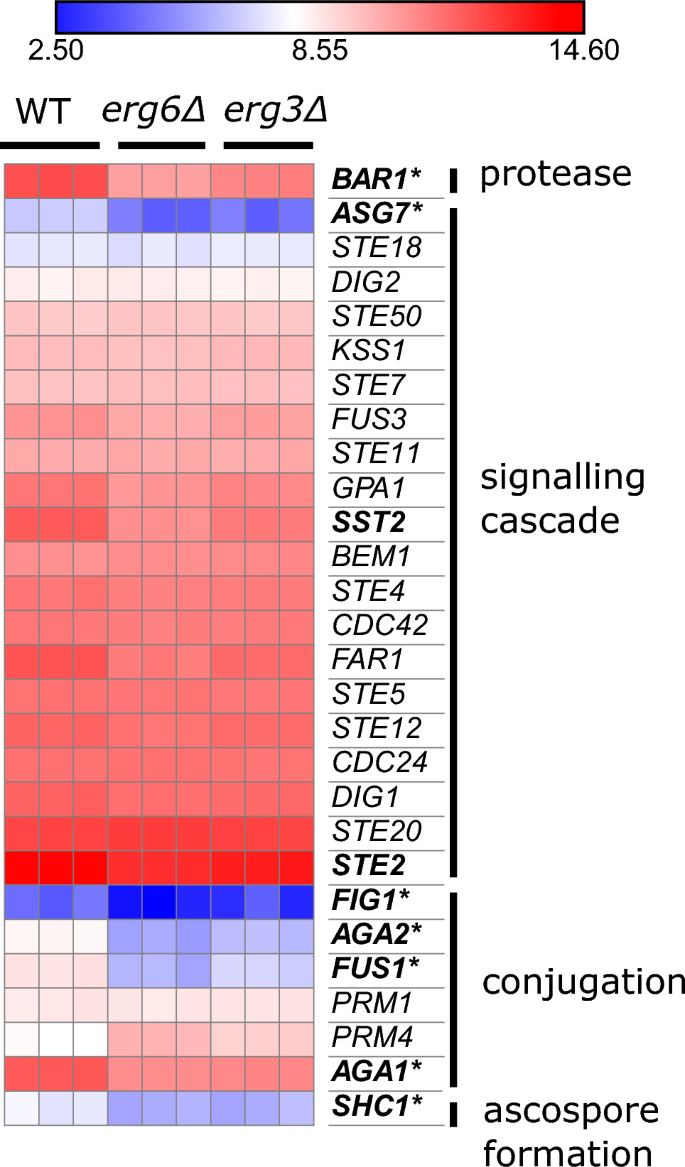
Ambas cepas regulan a la baja una serie de genes implicados en el apareamiento (Fig. 4). Estos son principalmente genes que están involucrados en la conjugación entre las puntas de apareamiento schmoo (FUS1, AGA1, AGA2, FIG1, SHC1), y previamente se ha descrito una eficiencia de apareamiento notablemente reducida para mutantes de biosíntesis de ergosterol40,41.
El erg3Δ y erg6Las cepas Δ exhiben una expresión reducida de genes de apareamiento. Expresión de genes relacionados con el apareamiento, unidades log2(CPM + 4). Atrevido; regulado a la baja ≥ 2 veces en la comparación erg6Δ escina 0 µg/ml versus escina WT 0 µg/ml. Asterisco; regulado a la baja ≥ 2 veces en las comparaciones erg3Δ escina 0 µg/ml versus escina WT 0 µg/ml (FDR ≤ 0.1).
Ambas cepas también expresan NCE102 a un nivel más bajo que WT (42% del nivel de WT en erg3Δ, y 40% del nivel de WT en erg6Δ). Aunque se localiza principalmente en los isosomas de la membrana plasmática, recientemente se ha informado que Nce102 desempeña un papel en la fusión de vacuolas.42, y las vacuolas están muy fragmentadas en muchas cepas mutantes de biosíntesis de ergosterol, incluidas erg3Δ, aunque no erg6Δ43,44,45.
Es de destacar que varios DEG entre los mutantes y WT tienen una función desconocida; 20 y 29 DEG regulados al alza, y 10 y 13 DEG regulados a la baja, en erg3Δ y erg6Δ respectivamente.
Respuestas del transcriptoma al tratamiento con escina.
En respuesta a 100 µg/mL de escina, el WT y erg6Las cepas Δ regulan positivamente 473 y 494 genes, respectivamente (Fig. 2b). Estos DEG están enriquecidos en genes que también están asociados con respuestas a la desecación, estrés osmótico, estrés oxidativo, temperatura, tratamiento químico y cambios en los niveles de nutrientes (SI). Tratamiento de erg6Las células Δ con 75 µg/mL de escina dieron como resultado una regulación positiva de 199 genes (Fig. 2C). Estos 199 DEG están enriquecidos en genes asociados con respuestas al estrés oxidativo, al estrés químico y al hambre (SI).
El impacto del tratamiento con escina en los genes del metabolismo central del carbono se muestra en la Fig. S10. En respuesta a 100 μg/mL de escina, tanto WT como erg6Δ regula fuertemente los genes relacionados con la biosíntesis de trehalosa, glucógeno y glicerol. Se considera que el glucógeno polímero de glucosa funciona principalmente como un carbohidrato de almacenamiento, lo que tiene poco impacto sobre la presión osmótica interna de la célula.46,47. Se considera que el disacárido trehalosa tiene un papel clave en la protección de la estructura de las membranas lipídicas y las proteínas, al desplazar el agua de las bicapas lipídicas y las superficies proteicas, y prevenir la agregación de proteínas desnaturalizadas que impedirían su posterior replegamiento.47. El glicerol actúa como un osmolito clave durante el estrés hiperosmótico y forma la columna vertebral de los fosfolípidos y los triacilgliceroles lipídicos de almacenamiento.48. La regulación positiva de la biosíntesis de trehalosa, glucógeno y glicerol es parte de una respuesta general al cambio ambiental.47,48,49. Además, tanto WT como erg6Las cepas Δ regulan positivamente los genes que codifican proteínas del complejo de degradación inducida por glucosa (GID), que regula negativamente la gluconeogénesis, a favor de la glucólisis, al iniciar la poliubiquitinación y la degradación de la fructosa-1,6-bisfosfatasa.50 (Higo. S11).
En respuesta a 100 μg/mL de escina, tanto WT como erg6Δ también regula positivamente genes que codifican enzimas de la vía de derivación del ácido γ-aminobutírico (GABA) (Fig. S12) que degrada el glutamato a través de GABA. En la levadura, se ha demostrado que esta vía es importante para la tolerancia al calor y al estrés oxidativo.51.
Los DEG regulados positivamente también están enriquecidos en genes relacionados con la organización de la pared celular, incluida la esporulación y la biosíntesis de quitina (Fig. S13). La interferencia entre las vías de la proteína quinasa activada por mitógenos (MAPK) de glicerol 1 de alta osmolaridad (Hog1) y de integridad de la pared celular (CWI) significa que es difícil analizar tensiones específicas que inician la regulación positiva de estos genes, sin utilizar mutantes que sean defectuosos. en ramas específicas de estas vías de señalización52,53,54.
Muchos genes relacionados con la autofagia están regulados positivamente en WT y erg6Δ en respuesta al tratamiento con escina (Fig. S14), incluidos los componentes centrales del fagosoma y las proteínas involucradas en la vía del citoplasma a la vacuola, que administra selectivamente hidrolasas a la vacuola.55. En respuesta a 100 μg/ml de escina, más genes relacionados con la autofagia se regulan positivamente ≥ 2 veces en el erg6Δ cepa que WT (11 vs. 7).
El erg6La cepa Δ también regula a la baja más genes que WT en respuesta a 100 μg/ml de escina (159 frente a 50), y estos DEG están enriquecidos en genes relacionados con la biogénesis y la traducción de los ribosomas. Estos procesos requieren cantidades sustanciales de energía.56, y su regulación negativa es parte de una respuesta general al estrés, en la que los recursos se desvían hacia la resistencia al estrés en lugar de hacia la proliferación celular.57,58.
Si la escina secuestrara el ergosterol de las células o inhibiera la detección de esteroles mediante la interacción con el ergosterol o con un sensor de esteroles, entonces podríamos esperar ver un cambio transcripcional en los genes de biosíntesis de esteroles, como ERG2 y ERG11 en respuesta al tratamiento con escina. Estos genes están regulados por los sensores de esteroles y activadores transcripcionales Upc2 y Ecm22, en respuesta al contenido de ergosterol.59,60. No se observa expresión diferencial de los genes de biosíntesis de ergosterol (Fig. S6), aunque existe una regulación positiva estadísticamente significativa pero pequeña de UPC2 en cada cepa (1.3, 1.9 y 1.5 veces para WT, erg6Δ y erg3Δ respectivamente). Una pequeña cantidad de genes relacionados con el suministro de esfingolípidos están regulados positivamente en respuesta a la escina en WT y erg6Δ (Fig. S7), aunque cabe señalar que gran parte de la regulación de los esfingolípidos es postraduccional31.
En contraste con los grandes cambios en el transcriptoma observados para WT y erg6Δ cepas, las erg3La cepa Δ regula positivamente solo 19 genes en respuesta a 100 µg/mL de escina y regula negativamente 4 (Fig. S15). La mayoría de estos DEG también se expresan diferencialmente en WT y/o erg6Δ cepa en respuesta al tratamiento con escina, con excepción de HAP4 (codificando un regulador de la respiración), YOL163W (considerado no funcional), YGL088W (función desconocida) y los genes de manoproteínas de la pared celular. DAN1 y DAN4.
El erg3El transcriptoma Δ no está preparado para el estrés del tratamiento con escina
Para explorar si los DEG de respuesta a escina en la cepa WT ya se expresan diferencialmente en erg3Δ bajo condiciones de control, potencialmente 'cebado' erg3Δ para el estrés del tratamiento con escina, comparamos DEG en las comparaciones WT 100 versus 0 µg/mL de escina, y erg3Δ escina 0 µg/mL versus escina WT 0 µg/mL (Fig. S16a). En condiciones de control, el erg3La cepa Δ tiene una expresión elevada de 18 genes que también están regulados positivamente en WT en respuesta al tratamiento con escina, y una expresión más baja de 5 genes que están regulados negativamente en WT en respuesta al tratamiento con escina. En la figura XNUMX se incluye un mapa de calor que muestra los niveles de expresión de estos genes superpuestos. S16b. La mayoría de estos genes también están regulados diferencialmente en el erg6Δ tensión en condiciones de control, y la erg6La cepa Δ no exhibe el fenotipo de tolerancia mejorada a la escina. Las excepciones son PADRE3 (que codifica un inhibidor de la proteinasa A citoplasmática), SRL3 (que codifica un regulador del ciclo celular), HED1 (que codifica una proteína específica de la meiosis), MAL31 (que codifica una permeasa de maltosa), ARG3 (que codifica ornitina carbamoiltransferasa), COS111 (que codifica una proteína mitocondrial), genes YBR090C y YKR075C de función desconocida y genes YJR037W y YJL195C que es poco probable que codifiquen proteínas funcionales.
En general, estos datos muestran que la escina no tiene ningún impacto sobre el crecimiento y un impacto insignificante sobre el transcriptoma de erg3Δ células. No es probable que esto se deba a erg3Las células Δ ya están preparadas para el estrés inducido por el tratamiento con escina, y es potencialmente atribuible a la composición química de los esteroles de su membrana.
La premezcla de escina con ergosterol, pero no con brasicasterol, previene la inhibición del crecimiento mediada por escina
Para explorar la hipótesis de que la escina media la toxicidad al interactuar directamente con el ergosterol, pero no con los esteroles alterados presentes en erg3Δ, evaluamos el impacto del tratamiento de las células WT con escina sola o escina premezclada con ergosterol en una proporción molar de 1:1. Se consideró que si el ergosterol interactúa directamente con la escina, entonces una mezcla de escina y ergosterol tendría un impacto reducido en el crecimiento de la WT que la escina sola, debido a la accesibilidad reducida de las saponinas de la escina. En particular, las células de levadura no importan esteroles exógenos en condiciones aeróbicas.37.
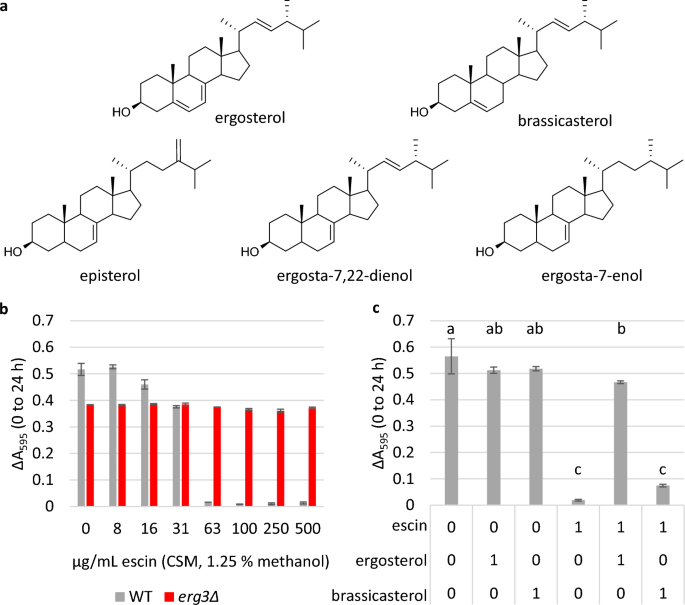
El experimento se llevó a cabo utilizando cultivos en microplacas y medios de mezcla completa de suplementos (CSM), a diferencia de YPD, ya que se define el contenido exacto de CSM, mientras que YPD es un medio rico que contiene moléculas complejas de extracto de levadura, que también pueden interactuar con la escina. y/o esteroles. Estudios anteriores han informado que el ergosta-7,22-dienol es el esterol predominante en la levadura que carece de Erg3, y que también se acumulan episterol y ergosta-7-enol.31,43. Cuando se verificó el contenido de esteroles mediante cromatografía de gases-espectrometría de masas (Figs. S2 y S3), el tiempo de retención relativo del pico de esterol más grande en el erg3El cromatograma de iones totales Δ correspondió a informes anteriores para ergosta-7,22-dienol, cuando la cepa se cultivó en YPD o CSM.
Se determinó que la CMI de la escina en medio CSM era de 63 μg/ml para las células WT (Fig. 5b); 2.4 veces menor que en YPD. Mientras tanto el crecimiento de la erg3La cepa Δ se desinhibió hasta la concentración más alta analizada (500 μg/ml). Cuando la escina se premezcló con ergosterol en una proporción molar de 1:1 y la mezcla se añadió a las células, el crecimiento de la cepa WT en presencia de 63 μg/ml de escina se restableció por completo (Fig. 5C). La premezcla de escina con ergosterol también restauró el porcentaje de células teñidas con el tinte impermeable a la membrana yoduro de propidio para controlar los niveles de tratamiento (Fig. S17), lo que indica una disminución de la permeabilidad celular y/o una mayor viabilidad celular.
Restauración del crecimiento cuando la escina se premezcla con ergosterol, pero no con brasicasterol. (a) Estructura del ergosterol (el esterol predominante en S. cerevisiae membrana plasmática), brasicasterol (un esterol vegetal) y esteroles que se han identificado como acumulativos en la erg3Cepa Δ (episterol, ergosta-7,22-dienol, ergosta-7-enol). (b) Y (c), Crecimiento en cultivos de microplacas indicado por ΔA595 (0-24 h). Tres réplicas biológicas ± desviación estándar (DE). En (b), la CIM de la escina en medios CSM es de 63 μg/ml para WT, que es 2.4 veces menor que en un medio rico y complejo. En (c), las células WT se cultivaron en presencia de 0 o 63 μg/ml de escina (1.25 % de metanol), sola o premezclada con ergosterol o brasicasterol en una proporción molar de 1:1. Se incluyeron controles únicamente de ergosterol y brasicasterol. Estadísticas: ANOVA unidireccional con prueba post-hoc de Tukey HSD, las condiciones que no están conectadas por la misma letra son significativamente diferentes (p ≤ 0.05).
Los esteroles presentes en erg3Δ son de disponibilidad limitada, por lo que, a modo de comparación, también evaluamos el crecimiento cuando la escina se premezcló con el fitosterol brassicasterol, que también tiene un doble enlace en el anillo B, aunque la posición de este está entre C-5 y C-. 6 (fig. 5a). En contraste con el crecimiento restaurado observado cuando la escina se premezcló con ergosterol, la restauración del crecimiento WT no se observó cuando la escina se premezcló con brasicasterol en una proporción molar de 1:1 (Fig. 5do).
Esto respalda la hipótesis de que la escina interactúa directamente con el ergosterol y que pequeños cambios en la estructura de los esteroles pueden tener un gran impacto en la fuerza de las interacciones esterol-saponina.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Automoción / vehículos eléctricos, Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- ChartPrime. Eleve su juego comercial con ChartPrime. Accede Aquí.
- Desplazamientos de bloque. Modernización de la propiedad de compensaciones ambientales. Accede Aquí.
- Fuente: https://www.nature.com/articles/s41598-023-40308-0