Preparación de NP Mel-PLGA
Se utilizó el método de nanoprecipitación-volatilización de solvente de un solo paso para la síntesis de NP Mel-PLGA26. Se disolvieron veinte mg de PLGA (P2191, lactida:glicolida (50:50), peso molar 30,000 60,000–73 31, Sigma Aldrich, EE. UU.) en acetona (un ml); y se añadieron dos mg de Mel (4-232.28-2, peso molar XNUMX, Sigma Aldrich, EE. UU.) seguido de media hora de centrifugación para formar la fase orgánica [XNUMX% (p/v)]. La fase orgánica formada se inyectó en H destilado.2O con agitación continua durante media hora; seguido de evaporación de acetona (a 37°C al vacío).
Caracterización de NP Mel-PLGA
Las NP Mel-PLGA producidas se obtuvieron mediante liofilización y se almacenaron a 4 ° C. La forma de las nanopartículas preparadas se observó mediante un microscopio electrónico de transmisión (TEM). Malvern.
Se utilizó el dispositivo Zetasizer para determinar el tamaño y el potencial zeta de las nanopartículas.
Eficiencia de encapsulación (EE%) y carga de fármaco (DL%) de Mel-PLGA NP26
La cantidad de Mel en Mel-PLGA NP se determinó mediante cromatografía líquida de alta resolución (HPLC). Donde, las NP de Mel-PLGA se disolvieron en acetona seguido de ultrasonido para liberar el Mel encapsulado. La solución se centrifugó a 3000 rpm durante veinte minutos para precipitar el PLGA. El Mel disuelto en el sobrenadante representó la masa encapsulada en NP. La liberación de Mel de las NP Mel-PLGA se determinó diluyendo un ml de NP con nueve ml de solución salina tamponada con fosfato (PBS, pH 7.4); seguido de incubación a 37°C en un agitador. A las 0, 20, 40, 60, 80 y 100 h, se retiraron 300 µl de la solución (reemplazados por el mismo volumen con PBS) y se centrifugaron a 3000 rpm durante 30 min. El %EE y el %DL se calcularon mediante las siguientes ecuaciones:
$${texto{EE}}% = izquierda( {{texto{masa}};{texto{de}};{texto{Mel}};{texto{en}};{texto{Mel}} – {texto {PLGA}};{text{NPs}}/{text{total}};{text{mass}};{text{of}};{text{Mel}}} derecha) multiplicado por {1}00.$$
$${texto{DL}}% = izquierda( {{texto{masa}};{texto{de}};{texto{Mel}};{texto{en}};{texto{Mel}} – {texto {PLGA }};{texto{NPs}}/{texto{total}};{texto{masa}};{texto{de}};{texto{Mel}} – {texto{PLGA}};{texto NPs}}} derecha) multiplicada por {1}00.$$
Efectos in vitro de las NP Mel-PLGA
Efecto antioxidante in vitro de las NP Mel-PLGA. 27
La capacidad antioxidante de las NP Mel-PLGA preparadas se ha evaluado a partir de sus efectos eliminadores de radicales libres a través del 1, 1-difenil-2-picrilhidrazilo [DPPH (281,689, Sigma Aldrich, EE. UU.)]. Simplemente, se mezclaron diferentes concentraciones de NP (de 3.9 a 1000 μg/ml) con un ml de solución de DPPH/etanol (0.1 mM), se agitaron y se dejaron reposar durante 30 minutos a 25 °C. La absorbancia se midió a 517 nm utilizando ácido ascórbico como sustancia de referencia. % de actividad eliminadora de DPPH = [(A0-UNA1)/A0]× 100. La absorbancia de la muestra fue A1, mientras que la absorbancia de la reacción de control fue A0.
Efecto de citotoxicidad in vitro de las NP Mel-PLGA
La seguridad del uso de NP Mel-PLGA se examinó in vitro antes de su uso in vivo. Se cultivaron células Caco2 (Sigma Aldrich, EE. UU.), a 37 °C en 5% de CO2 y una humedad relativa del 95%, en medio Eagle modificado por Dulbecco (DMEM) suplementado con NaHCO.3 (2.2 g/l), d-glucosa (4.5 g/l), 1% de aminoácidos no esenciales, 10% de suero fetal bovino, 100 UI/ml de penicilina y 0.1 mg/ml de estreptomicina (todos los materiales utilizados en el proceso de cultivo se adquirieron en Sigma Aldrich, EE. UU.). Los ensayos de citotoxicidad in vitro se realizaron según Alaa et al..28. 100 µl/pocillo de 105 Las células Caco2 en placas de cultivo de tejidos se incubaron a 37 °C durante 24 h para permitir el desarrollo de monocapas celulares. Después de la decantación del medio, se usó un medio de lavado para lavar las monocapas. Se produjeron concentraciones graduadas de NP Mel-PLGA combinando NP con medio RPMI. La dilución de NP producida se diluyó a 0.1 ml, se añadió a los pocillos y luego se dejó reposar durante otras 24 h. Los pocillos recibieron 20 µl de MTT (bromuro de 3-(4,5-dimetiltiazol-2-il)-2-5-difeniltetrazolio) a una concentración de 5 mg/ml. Las placas se agitaron durante cinco minutos para garantizar la mezcla del MTT y luego se incubaron durante cuatro horas a 37 °C con 5 % de CO.2. Para disolver el formazán desarrollado, se aplicaron a las placas 200 µl de dimetilsulfóxido (DMSO). Se midió la absorbancia (que estaba directamente relacionada con el formazán) a 560 nm.
Efecto de coagulación in vitro de Mel-PLGA NP29
Se probó la actividad de coagulación de las NP de Mel-PLGA preparadas para predecir su efecto cuando se administran in vivo. La actividad anticoagulante de las NP de Mel-PLGA se evaluó midiendo el tiempo de coagulación en segundos a 37 °C, con heparina como control. De acuerdo con las recomendaciones del fabricante, se utilizaron reactivos de tiempo de protrombina (PT) y tiempo de tromboplastina parcial (PTT) (preincubados a 37 °C durante 5 minutos). Brevemente, se combinaron plasma de rata (900 μl) y varias concentraciones de Mel-PLGA NP (100 μl) o heparina disuelta en solución salina. La prueba se completó tres veces y se registró el tiempo de coagulación.
Efecto antiinflamatorio (inhibición de la hemólisis) in vitro de las NP Mel-PLGA
El efecto antiinflamatorio de las NP de Mel-PLGA se determinó mediante la prueba de inhibición de la hemólisis según Anosike et al..30. Se centrifugó sangre fresca de rata heparinizada (5 ml) a 2500 rpm durante 15 minutos; después de eso, el sedimento resultante se disolvió con tampón isotónico (que era equivalente al volumen de sobrenadante). Se combinaron diferentes dosis de Mel-PLGA NP (de 100 a 1000 μg/ml) con 5 ml de agua destilada para crear una solución hipotónica. Se combinaron las mismas dosis de NP con una solución isotónica (5 ml); y se empleó indometacina como control. Las soluciones de NP y el control recibieron 0.1 ml de la suspensión de eritrocitos producida, que luego se incubó durante una hora a 37 °C antes de centrifugarse durante tres minutos a 1500 rpm. Se utilizó un espectrofotómetro para cuantificar la hemoglobina liberada en el sobrenadante a 540 nm, y el porcentaje de inhibición de la hemólisis se estimó mediante la fórmula: inhibición de la hemólisis (%) = 1−[(ODb−ODa)/(SOBREDOSISc−ODa)]× 100. DEa representaba la absorbancia de la muestra en una solución isotónica, ODb para absorbancia de muestra en una solución hipotónica y ODc para controlar la absorbancia en una solución hipotónica.
Animales y diseño experimental.
Se compraron ratas macho Sprague Dawley, que pesaban 200 gy ocho semanas de edad, en el galpón de animales de la Organización Nacional para el Control y la Investigación de Drogas (El Cairo, Egipto). Todos los procedimientos experimentales se llevaron a cabo de acuerdo con las pautas internacionales para el cuidado y uso de animales de laboratorio y cumplieron con las pautas ARRIVE. Se examinaron in vivo dos dosis de NP Mel-PLGA (5 y 10 mg/kg) para probar la eficacia de las NP en el tratamiento de la lesión hepática inducida por CCL4; y también, encontrar la dosis terapéutica requerida. Además, se utilizaron dos dosis de Mel libre (5 y 10 mg/kg) en los subgrupos experimentales y se compararon con los subgrupos administrados con Mel-PLGA NP para probar el éxito de las Mel-PLGA NP preparadas para reducir la cantidad de Mel administrada. Se diseñaron subgrupos de control sanos como subgrupos con lesión hepática inducida por CCL4 para lograr una comparación crítica y un análisis estadístico. Por lo tanto, los animales se dividieron en dos grupos, sanos (H) y con lesión hepática CCL4 (I); cada grupo se dividió en cinco subgrupos (cinco ratas/subgrupo):
-
Grupo sano (H):
Control H GI: ratas control negativas sanas.
H Mel (5 mg/kg) GII: ratas control sanas que recibieron 5 mg/kg de Mel.
H Mel (10 mg/kg) GIII: ratas control sanas que recibieron 10 mg/kg de Mel.
H Mel-PLGA NP (5 mg/kg) GIV: ratas de control sanas que recibieron 5 mg/kg de Mel-PLGA NP.
H Mel-PLGA NP (10 mg/kg) GV: ratas de control sanas que recibieron 10 mg/kg de Mel-PLGA NP.
-
CCL4-grupo de lesión hepática (I):
Controlo el GI no tratado: ratas no tratadas con lesión hepática inducida por CCL4 (control positivo).
I Mel (5 mg/kg) GII: ratas con lesión hepática inducida por CCL4 tratadas con 5 mg/kg de Mel.
Mel (10 mg/kg) GIII: ratas con lesión hepática inducida por CCL4 tratadas con 10 mg/kg de Mel.
I Mel-PLGA NP (5 mg/kg) GIV: ratas con lesión hepática inducida por CCL4 tratadas con 5 mg/kg de Mel-PLGA NP.
I Mel-PLGA NP (10 mg/kg) GV: ratas con lesión hepática inducida por CCL4 tratadas con 10 mg/kg de Mel-PLGA NP.
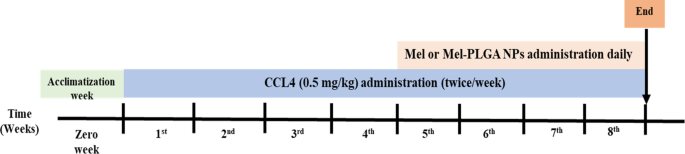
Además del grupo vehículo (VG) que estuvo compuesto por ratas sanas que recibieron 0.1 ml de aceite de oliva mediante inyección intraperitoneal (ip) dos veces por semana durante todo el período experimental. CCL4 se disolvió en aceite de oliva y se administró a una dosis de 0.5 mg/kg por vía ip dos veces por semana durante cuatro semanas sucesivas. Después de la inducción de la lesión hepática, se administraron Mel o Mel-PLGA NP por vía ip diariamente durante otras cuatro semanas (nota: las ratas continuaron recibiendo dosis de CCL4 durante el tratamiento) (Fig. 1).
Al final del experimento, las ratas fueron anestesiadas terminalmente con 50 mg/kg de pentobarbital sódico.31. Las muestras de sangre se recogieron mediante punción cardíaca. Después de permitir que la sangre coagulara a temperatura ambiente, se recogió el suero después de centrifugarlo a 1500 rpm durante 15 minutos y se dividió en alícuotas que se mantendrían a -20 °C. Se diseccionaron ratas de todos los grupos experimentales para la recolección de órganos (hígado). Brevemente, se colocó a la rata boca arriba sobre la bandeja de disección y se fijaron sus extremidades con la ayuda de una cinta. Se cortó la piel de la rata para exponer los músculos subyacentes. Se despegó la pared abdominal y se extrajo el hígado con cuidado. Se homogeneizaron muestras de hígado (10 g), de todos los grupos experimentales, utilizando tampón Tris-HCl frío para preparar homogeneizado de hígado (XNUMX%).
Análisis bioquímico en muestras de suero.
Se midieron los parámetros de la función hepática para evaluar el efecto hepatoprotector de las NP de Mel-PLGA. Los niveles de aspartato aminotransferasa (AST), alanina transaminasa (ALT), albúmina (ab234579, ab263883, ab108789, abcam, EE. UU.) y bilirrubina total (MBS9389057, MyBiosource, EE. UU.) se midieron mediante kits de ELISA para ratas según Farid et al..27.
Marcadores de estrés oxidativo en homogeneizados de tejido hepático:
El efecto antioxidante de las NP preparadas se determinó, in vivo, midiendo el marcador de peroxidación lipídica malondialdehído (MDA) y las enzimas antioxidantes. Los niveles de MDA (MBS268427, MyBioSource, EE. UU.), GPx (MBS744364, MyBioSource, EE. UU.), SOD (ab285310, EE. UU.) y CAT (P04762, CUSABIO, EE. UU.) se midieron mediante kits de ELISA para ratas según Farid et al.32 y Amr et al..33.
Niveles de citocinas en homogeneizados de tejido hepático.
El efecto antiinflamatorio de las NP de Mel-PLGA se determinó midiendo el nivel de citocinas proinflamatorias (TNF-α, IL-1β e IL-6) y la citocina antiinflamatoria (IL-10). Los niveles de citocinas se midieron en el hígado de ratas mediante IL-1β (MBS825017, MyBioSource, EE. UU.), TNF-α (ab100785, abcam, Reino Unido), IL-6 (P20607, CUSABIO, EE. UU.) e IL-10 (P29456, CUSABIO, EE.UU.) kits de ELISA para ratas según Farid et al..34.
Niveles de metaloproteinasas de matriz en homogeneizados de tejido hepático:
El efecto de las NP de Mel-PLGA sobre la remodelación del tejido hepático se evaluó midiendo MMP9 y TIMP1 mediante kits ELISA de rata (MBS722532 y MBS2502910, respectivamente; MyBioSource, EE. UU.).
Técnica de citometría de flujo.
Se utilizó la técnica de citometría de flujo para encontrar el efecto de las NP preparadas sobre la apoptosis y los niveles de proteínas apoptóticas intracelulares. Los cultivos de células de hepatocitos se produjeron en condiciones de esterilización. La vena porta de ratas bajo anestesia se perfundió con tampón de colagenasa. El hígado se diseccionó después de la perfusión, las células se separaron, se suspendieron en medio completo de William, se filtraron a través de un filtro de nailon (100 µm) y luego se cultivaron. El nivel de apoptosis en las células hepáticas se examinó utilizando el kit de detección de apoptosis Anexina-V-FITC/PI (ab14085, abcam, EE. UU.). Las células del hígado fueron permeabilizadas por saponina (pH 7.4); y la proteína antiapoptótica Bcl2 (11-6992-42) y las proteínas proapoptóticas [Bax (MA5-14,003), p53 (ab90363), caspasa 3 (C92-605) y 8 (ab32125)] se midieron mediante citometría de flujo. .
Examen histopatológico e inmunohistoquímico:
Se examinaron secciones de hígado mediante el método de tinción ordinario con hematoxilina y eosina para evaluar los diferentes cambios histopatológicos entre los grupos experimentales. Se utilizó tinción inmunohistoquímica para evaluar el efecto antiinflamatorio de las NP de Mel-PLGA. Las muestras de hígado se deshidrataron utilizando niveles crecientes de alcohol: 70% de alcohol durante 1.5 h, 90% de alcohol durante 1.5 h y alcohol absoluto durante 3 h. Luego se aclaró el hígado durante 4 h en xileno. Después de la limpieza, las muestras de hígado se someten al procedimiento de infiltración, donde se impregnaron con parafina pura y blanda en tres grados distintos (cada uno con una duración de una hora) a 56 °C. Luego las muestras se dispusieron en bloques y se sumergieron en cera de parafina a 58 °C. Para el análisis histológico, se cortaron rodajas de parafina de 4 micras de espesor, se tiñeron con hematoxilina y eosina, se montaron en poliestireno xileno dibutilftalato y luego se cubrieron.33,35. Para examen inmunohistoquímico28, H2O2 (3%) [seguido de un lavado con PBS y un bloqueo de 60 minutos con albúmina sérica bovina (BSA, 5%)] para inhibir la actividad de la peroxidasa endógena. Las secciones de hígado se lavaron en PBS, después de una incubación de 30 minutos con el anticuerpo primario [anticuerpo p65 del factor antinuclear kappa beta (NF-кB) (ab86299, abcam, EE. UU.) o anticuerpo anti-proteína C reactiva (C1688). , Sigma Aldrich, EE.UU.)]. El anticuerpo secundario IgG anti-rata de conejo peroxidasa de rábano picante (HRP) (ab6734, abcam, EE. UU.) se aplicó a secciones de hígado y se incubó durante 60 minutos. Se utilizó 3, 3-diaminobencidina (DAB) para el desarrollo del color, siendo el color marrón un resultado positivo. Se lavaron secciones de hígado y luego se contratiñeron con hematoxilina (0.1%).
análisis estadístico
Los datos se expresaron como media ± DE y se investigaron mediante análisis de varianza unidireccional (ANOVA) utilizando SPSS versión 20.0 (SPSS Inc., Chicago, EE. UU.). Las diferencias entre medias se examinaron mediante la prueba post hoc de Tukey. Cuando P < 0.05, los valores se consideraron significativos.
Aprobación de ética
Todo el procedimiento experimental y el mantenimiento de los animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- Fuente: https://www.nature.com/articles/s41598-023-43546-4