Estimado editor,
Las células madre hematopoyéticas (HSC) que residen en la médula ósea (MO) de ratones adultos son muy heterogéneas,1 que van desde HSC que ejecutan todo su potencial multilinaje hasta aquellas con producción restringida/sesgada de plaquetas (P).2,3,4 Estas distintas propensiones sesgadas por el linaje se sustentan en el trasplante secundario y, por lo tanto, son en gran medida intrínsecas.1 Mientras que las HSC adultas derivan de HSC fetales definitivas,5 No está claro hasta qué punto los sesgos/restricciones de linaje observados en HSC de BM adultos, o cualquier otro sesgo/restricción de linaje distinto, se han establecido antes del nacimiento.
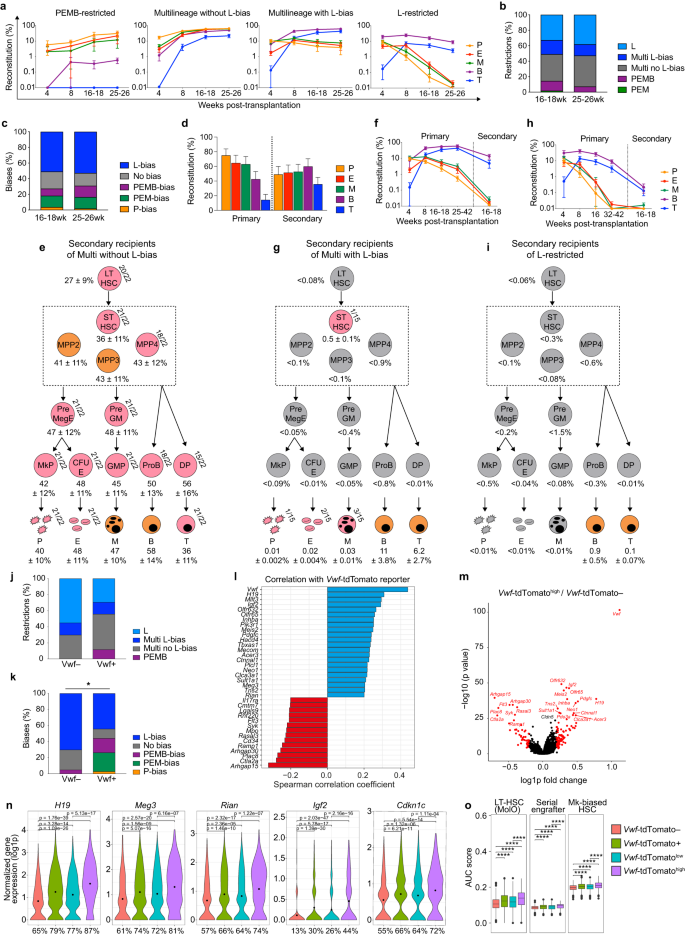
Las HSC definitivas se expanden en el hígado fetal a mitad de la gestación y, en el día embrionario (DE) 17.5, comienzan a migrar a la MO, el sitio hematopoyético primario durante toda la vida.5 Estudios previos de trasplante de HSC fetales individuales, que evaluaron solo linajes de glóbulos blancos, identificaron HSC con sesgo mieloide (M) y linfoide (L) en el hígado ED14.5 y ED18.5.6 Mientras que estudios previos identificaron HSC adultas restringidas/sesgadas por P,2,3,4 La propensión de las HSC fetales y perinatales (pnHSC) a reponer los linajes críticos de plaquetas y eritroides (E) aún no se ha investigado a nivel clonal en ratones o humanos. En este documento, analizamos sistemáticamente la reposición de sangre de cinco linajes posterior al trasplante mediante pnHSC individuales en ED19.5/día posnatal 0 (PD0). Utilizando un vwf-tdTomatetg/+;gata1-eGFPtg/+ modelo de trasplante de ratón,2 Evaluamos la contribución clonal a lo largo del tiempo a las células sanguíneas P, E, M, B y T por linaje único.-Sca1+Kits+(LSK)CD150+CD48- HSC de hígado y BM (Fig. 1a; Información complementaria, Fig. S1 y mesa S1). El 22 % de los ratones trasplantados con un solo hígado o BM pnHSC mostraron una contribución a largo plazo (LT) ≥ 0.1 % a al menos un linaje de células sanguíneas después de 25 a 26 semanas (Información complementaria, Fig. S1a). Más del 90% de las pnHSC individuales reconstituidas (de hígado o médula ósea, información complementaria, Fig. S1) repuso todos los linajes sanguíneos (Fig. 1a), en contraste con < 50 % de los LT-HSC de BM de un solo adulto.2 Mientras que un tercio de los LT-HSC adultos solteros contribuyen exclusivamente a los linajes PEM,2 ninguna pnHSC estaba restringida por P o PEM (Fig. 1a, b) en el hígado o la MO (Información complementaria, Fig. S1b). Del mismo modo, mientras que la mitad de los LT-HSC adultos poseen sesgo P/PEM,2 sólo un pnHSC de BM y ninguno de hígado mostraron sesgo P, y <15% mostró sesgo PEM (Fig. 1c; Información complementaria, Fig. S1c). Una pequeña fracción de pnHSC estaba restringida a PEMB a las 25-26 semanas (Fig. 1a, b), que representa la única restricción de linaje de pnHSC en este momento. Sin embargo, si bien la mayoría de las HSC para adultos restringidas por P y PEM siguen restringidas en los destinatarios primarios,2 Para la mayoría de las pnHSC que muestran una reconstitución restringida por PEMB a las 25-26 semanas, la producción de células T se hizo evidente con el tiempo (Información complementaria, Fig. S2a,b). Por lo tanto, en general, las pnHSC trasplantadas muestran menos sesgo/restricción de P y PEM y una producción linfoide más consistente que las HSC adultas.
a Patrones de reconstitución de sangre LT tras el trasplante primario de un solo LSKCD150+CD48- pnHSC clasificado a partir de hígado de ratón o MO en ED19.5/PD0 (n = 252 destinatarios; 7 experimentos independientes). Media ± SEM para cada linaje. restringido por PEMB, n = 4; multilinaje sin polarización L, n = 22; multilinaje con polarización L, n = 8; restringido en L, n = 21. Tenga en cuenta que todos los patrones restringidos por L mostraron reposición de linajes PEM en momentos anteriores. b, c Restricciones de linaje (b) y sesgos (c) entre ratones reconstituidos a las 16-18 semanas y 25-26 semanas después del trasplante primario (n = 55). Los patrones de linaje restringido se definieron por una contribución indetectable (<0.01%) a uno o más linajes sanguíneos. Los patrones sesgados se definen en el Métodos suplementarios. d, e Reposición de sangre (media ± SEM) en receptores primarios de un solo pnHSC con reconstitución multilinaje sin sesgo L en el momento del trasplante secundario (n = 12, 26–42 semanas después del trasplante primario) y en los receptores secundarios correspondientes (n = 12, donantes primarios, 1 a 3 receptores secundarios por donante, 16 a 18 semanas de trasplante postsecundario (d)), y reposición (media ± SEM) de HSPC en receptores secundarios (n = 8, donantes primarios, 1 a 3 receptores secundarios por donante, 17 a 27 semanas de trasplante secundario (e)). f, g Reposición de sangre (media ± SEM) en receptores primarios de un solo pnHSC con reconstitución multilinaje con L-bias en el momento del trasplante secundario (n = 7, 25–49 semanas después del trasplante primario) y en los receptores secundarios correspondientes (n = 7, donantes primarios, 1 a 3 receptores secundarios por donante, 16 a 18 semanas de trasplante secundario (f)), y reposición (media ± SEM) de HSPC en receptores secundarios (n = 7, donantes primarios, 1 a 3 receptores secundarios por donante, 17 a 28 semanas de trasplante secundario (g)). h, i Cinética de reposición de sangre (media ± SEM) en receptores primarios de un único pnHSC con reconstitución restringida en L en el momento del trasplante secundario (n = 6, 32–42 semanas después del trasplante primario) y en los receptores secundarios correspondientes (n = 6, donantes primarios, 2 a 3 receptores secundarios por donante, 16 a 18 semanas de trasplante secundario (h)), y reposición (media ± SEM) de HSPC en receptores secundarios (n = 3, donantes primarios, 1 a 3 receptores secundarios por donante, 27 semanas de trasplante secundario (i)). El gris denota poblaciones sin contribución de donante detectable en ningún receptor, el rosa denota contribución en algunos pero no en todos los receptores (se especifica la frecuencia de los ratones reconstituidos) y el naranja denota contribución en todos los receptores (e, g, i). PreMegE, progenitor premegacariocito/eritroide; MkP, progenitor de megacariocitos; CFU-E, unidad formadora de colonias-eritroide; PreGM, progenitor de pregranulocitos/monocitos; GMP, progenitor de granulocitos/monocitos; DP, progenitores de células T doblemente positivos. j, k Restricciones de linaje (j) y sesgos (k) de pnHSC individuales entre 25 y 26 semanas después del trasplante primario, reanalizados en función de vwf-tdExpresión de tomate (vwf-tdTomate-, n = 20; vwf-tdTomate+, n = 34). No hubo asociación estadísticamente significativa entre variables con la prueba exacta de Fisher en j (P = 0.1679), pero estadísticamente significativo en k (*P = 0.0259). l Análisis de correlación de Spearman de pnHSC individuales (n = 1700) para la expresión genética asociada con vwf-tdNivel de tomate determinado por índice-ordenación FACS. Genes con correlación positiva (azul; coeficiente de correlación > 0.2) y negativa (rojo; coeficiente de correlación < −0.2) con vwf-Se muestran las expresiones tdTomato. m Gráfico de volcán para DEG (rojo; combinado P < 0.05) al comparar vwf-tdTomatehigh (n = 283) con vwf-tdTomate- (n = 1128) pnHSC. Genes regulados negativamente a la izquierda (cambio log1p veces < −0.2) y genes regulados positivamente a la derecha (cambio log1p veces > 0.2). n Expresión normalizada (log1p) para DEG seleccionados (combinados P < 0.05) en sencillo vwf-tdTomate- (n = 1128), vwf-tdTomate+ (n = 572), vwf-tdTomatebajo (n = 289), y vwf-tdTomatehigh (n = 283) pnHSC. La expresión media está representada por puntos dentro de los gráficos de violín y el porcentaje de células con expresión detectada se indica a continuación. o Puntuaciones AUC para firmas LT-HSC (“superposición molecular”, MolO), HSC con injerto en serie y HSC con sesgo Mk para un solo vwf-tdTomate- (n = 1128), vwf-tdTomate+ (n = 572), vwf-tdTomatebajo (n = 289), y vwf-tdTomatehigh (n = 283) pnHSC. Prueba de suma de rangos de Wilcoxon. ****P <0.001.
Muchas pnHSC multilinaje no mostraron un sesgo de linaje prominente (Fig. 1c), manteniendo la producción de LT de todos los linajes sanguíneos y reponiendo las células madre y progenitoras hematopoyéticas (HSPC) en los receptores primarios y secundarios (Fig. 1d, e; Información complementaria, Fig. S2c-g), lo que confirma su amplio sesgo de autorrenovación y linaje estable.
De acuerdo con los datos publicados de ED18.5,6 Muchas pnHSC mostraron una contribución de LT a la sangre con sesgo de L y restricción de L (Fig. 1a – c; Información complementaria, Fig. S1b,c). Sin embargo, el sesgo L del LSKCD150 reconstituyente de múltiples linajes+CD48- Las células solo se hicieron evidentes semanas o meses después del trasplante, y todos los casos restringidos por L contribuyeron a los linajes PEM en momentos anteriores (Fig. 1a). La contribución restringida a L fue típicamente precedida por una reconstitución sesgada por L (Fig. 1a; Información complementaria, Fig. S3a,b), y los patrones de reconstitución primarios sesgados por L se volvieron restringidos por L tras el trasplante secundario, con una reconstitución de PEM drásticamente reducida (Fig. 1f–yo). La reposición de HSPC fue baja e inconsistente en los receptores primarios de HSC restringidas/sesgadas por L (Información complementaria, Fig. S3c, re), y ausente en receptores secundarios (Fig. 1g, yo), lo que demuestra que el aporte de sangre L-sesgado o restringido-L refleja la longevidad prolongada de los linfocitos en comparación con los linajes mieloides de vida corta,7 en lugar de un sesgo linfopoyético de las LT-HSC. De relevancia para nuestros hallazgos, el reciente seguimiento clonal de la hematopoyesis nativa sugirió que las células mieloides y linfoides se derivan principalmente de progenitores embrionarios multipotentes (eMPP) independientemente de las HSC, al menos en los primeros meses después del nacimiento, y que las eMPP siguen siendo la principal fuente de nutrición durante toda la vida. aporte linfoide.8 En nuestros estudios, muchas pnHSC, enriquecidas entre vwf-tdTomate- LSKCD150+CD48- células, dieron a LT una reconstitución robusta principalmente de linfocitos, y un análisis adicional de BM reconstituido demostró que estas células restringidas/sesgadas por L no eran verdaderas LT-HSC y, por lo tanto, podrían estar más estrechamente relacionadas con HSC o eMPP a corto plazo (ST).
vwf-La expresión de tdTomato en pnHSC fue del 59 % y 47 % en el hígado y la MO, respectivamente (Información complementaria, Fig. S4a), comparable a la MO del adulto.2,4 Según los datos de clasificación de índice, la frecuencia de reconstitución única vwf-tdTomate+ y vwf-tdTomate- pnHSCs fue comparable (Información complementaria, Fig. S4b). Aunque el sesgo P y PEM fue más raro que en las HSC adultas, estas propiedades fueron exclusivas de vwf-tdTomate+ pnHSC (Fig. 1j,k). No se observaron diferencias significativas entre el hígado y la MO en cuanto al sesgo de linaje/restricción de vwf-tdTomate+ y vwf-tdTomate- pnHSC (información complementaria, Fig. S4c, re). Esto demuestra que, aunque mucho menos prominente que para los adultos vwf-reportero+ HSC, el proceso de sesgo/restricción P y PEM se ha iniciado en vwf-reportero+ HSC en el momento del nacimiento. Además, un único multilinaje vwf-tdTomate- Los pnHSC no se reabastecieron de manera sólida vwf-tdTomate+ BM LSKCD150+CD48- células en receptores primarios (Información complementaria, Fig. T4e, f). Junto con todas las HSC de hígado fetal ED14.5 que se vwf-reportero+,4 Esto sugiere que la relación jerárquica entre vwf-reportero+ y vwf-reportero- HSC adultos,2,4 vwf-reportero+ HSC que dan lugar a vwf-reportero- HSC, pero no al revés, ya está establecido en pnHSC, aunque esto debería validarse aún más mediante ensayos de HSC funcionales in vivo como se informó anteriormente para adultos. vwf-reportero+ y vwf-reportero- HSC.4
A continuación comparamos los paisajes transcripcionales de vwf-tdTomate+ y vwf-tdTomate- LSKCD150+CD48- pnHSC hepáticas mediante secuenciación de ARN unicelular.9 El análisis de reducción de dimensionalidad no reveló una agrupación distinta asociada con vwf expresión (Información complementaria, Figs. S5, S6a,b), pero se identificaron 32 genes expresados diferencialmente (DEG) entre vwf-tdTomate-y vwf-tdTomate+ pnHSC (información complementaria, Fig. S6c y mesa S2), con varios genes correlacionados con vwf-tdNivel de tomate (Fig. 1l). Por lo tanto, también comparamos vwf-tdTomate- y vwf-tdTomatehigh pnHSC, que revelan 162 DEG con cambios generales de pliegue más altos (Fig. 1m; Tabla Suplementaria S2) que separó más claramente los subgrupos de pnHSC (Información complementaria, Fig. S6d, mi). DEG más expresados por vwf-tdTomate+/alto Las pnHSC incluían los ARN no codificantes largos con impronta materna H19, Meg3y Rian (Higo. 1n), ubicado en el H19–Igf2 y dlk1–Dio3 los loci demostraron estar altamente expresados selectivamente en LT-HSC y críticos para el establecimiento y mantenimiento de HSC embrionarias y adultas.10,11 Igf2 y su objetivo aguas abajo cdkn1c También son importantes para mantener la inactividad del HSC (Fig. 1n).12 Estos genes están ubicados dentro de distintos loci en los cromosomas 7 y 11 del ratón, lo que implica una regulación epigenética compartida que promueve una mayor expresión en vwf-tdTomate+/alto pnHSC. Los DEG también incluyeron genes asociados con HSC adultas con sesgo de linaje (Información complementaria, Fig. T6f) contribuyendo al enriquecimiento en vwf-tdTomate+/alto pnHSC de firmas asociadas con LT-HSC,13 injerto en serie,3 y sesgo de linaje de megacariocitos (Mk)3 (Higo. 1o). En apoyo de la polarización L vwf-tdTomate- LSKCD150+CD48- células perinatales enriquecidas en HSPC estrechamente relacionadas con eMPP, flt3, un gen característico expresado por eMPP,8 fue uno de los genes más regulados en vwf-tdTomate– cuando se compara con vwf-tdTomate+/alto LSKCD150+CD48– células (Fig. 1l, metro; Información complementaria, Fig. S6c–f).
Nuestros trasplantes únicos de HSC se realizaron en condiciones de estrés hematopoyético utilizando receptores mieloablación, imitando así el trasplante clínico de MO en lugar de la hematopoyesis en estado estacionario, aunque, como en los estudios correspondientes de HSC en adultos,2 El sesgo de linaje permaneció bastante estable muchos meses después del trasplante, cuando la hematopoyesis se había normalizado. Independientemente, el propósito de los trasplantes de HSC individuales es realizar un seguimiento clonal definitivo de la contribución del linaje sanguíneo a lo largo del tiempo por parte de una sola célula con una amplia capacidad de autorrenovación de LT, y nuestro mapeo cinético del destino de los resultados posteriores al trasplante de pnHSC individuales proporciona nuevos conocimientos sobre los potenciales de reposición de sangre de las HSC definitivas al nacer, en comparación con los ratones trasplantados con HSC individuales adultas.2 Mientras que una gran fracción de HSC adultas repone exclusivamente linajes PEM y con frecuencia tienen sesgo P, estas restricciones y sesgos de linaje son raros o están ausentes en las pnHSC. A diferencia de estudios anteriores,6 No encontramos que el sesgo M aumentara en las HSC que residen en BM al final de la gestación, ya que no se observaron diferencias significativas en los sesgos de linaje en el hígado y la BM. Nuestros datos funcionales son congruentes con los datos moleculares publicados.14 lo que demuestra que las pnHSC de hígado y BM son transcripcionalmente similares y más bien se agrupan por etapa de desarrollo.
Nuestro estudio no aborda el momento más temprano en el que surge el sesgo/restricción P, aunque la baja frecuencia de sesgo/restricción P y PEM observada en las pnHSC muestra que esta propiedad, compartida por una gran fracción de las HSC adultas, surge principalmente después nacimiento. Si bien nuestros datos funcionales y transcripcionales unicelulares muestran que el alcance del sesgo/restricción de P y PEM es muy limitado en las pnHSC en comparación con las HSC adultas, de acuerdo con el análisis molecular previo del cebado de Mk,15 Sin embargo, observamos que este proceso se había iniciado al nacer en un patrón que recuerda a las HSC adultas. De hecho, los sesgos de linaje observados (P, PEM y PEMB) fueron idénticos a los de las HSC adultas, y los sesgos de P y PEM eran exclusivamente una propiedad de las pnHSC que expresaban vwf-tdTomato, un sello distintivo de las HSC restringidas en P y PEM en la MO de adultos.2
Queda por explorar más a fondo hasta qué punto los distintos sesgos de linaje de las HSC, incluidos los sesgos P y PEM, están determinados intrínseca y/o extrínsecamente. Sin embargo, el hecho de que tanto adultos2,3,4 y las LT-HSC perinatales muestran sesgos de linaje similares tras el trasplante en receptores primarios y secundarios, así como la preparación del linaje transcripcional correspondiente a su sesgo de linaje tras el trasplante, sugiere que esto es, al menos en parte, una propiedad de HSC estable e intrínsecamente programada. La participación de la programación epigenética en el sesgo P de las HSC16 También es compatible con una interacción entre señales intrínsecas y extrínsecas.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Automoción / vehículos eléctricos, Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- ChartPrime. Eleve su juego comercial con ChartPrime. Accede Aquí.
- Desplazamientos de bloque. Modernización de la propiedad de compensaciones ambientales. Accede Aquí.
- Fuente: https://www.nature.com/articles/s41422-023-00866-4