12 de octubre de 2023 (Noticias de Nanowerk) A pesar de su papel fundamental en biología y de extensos estudios realizados durante medio siglo, muchos aspectos de cómo se forman los componentes básicos del ADN siguen sin estar claros. Ahora, un equipo internacional de científicos ha revelado valiosos detalles sobre este intrincado proceso. La investigación, publicada en Ciencia: (“Estructura de un radical proteico ribonucleótido reductasa R2”), ofrece información sobre la enzima radical (una molécula altamente reactiva que inicia la síntesis de ADN) y podría allanar el camino para aplicaciones médicas y terapéuticas para el cáncer y las enfermedades infecciosas. El equipo, que incluía investigadores de la Universidad de Estocolmo, el CNRS-Universidad de Toulouse, el Laboratorio Nacional del Acelerador SLAC del Departamento de Energía y el Laboratorio Nacional Lawrence Berkeley y varias otras instituciones combinaron su experiencia para descifrar los misterios de las ribonucleótidos reductasas (RNR), una conjunto de enzimas que producen los componentes básicos del ADN.
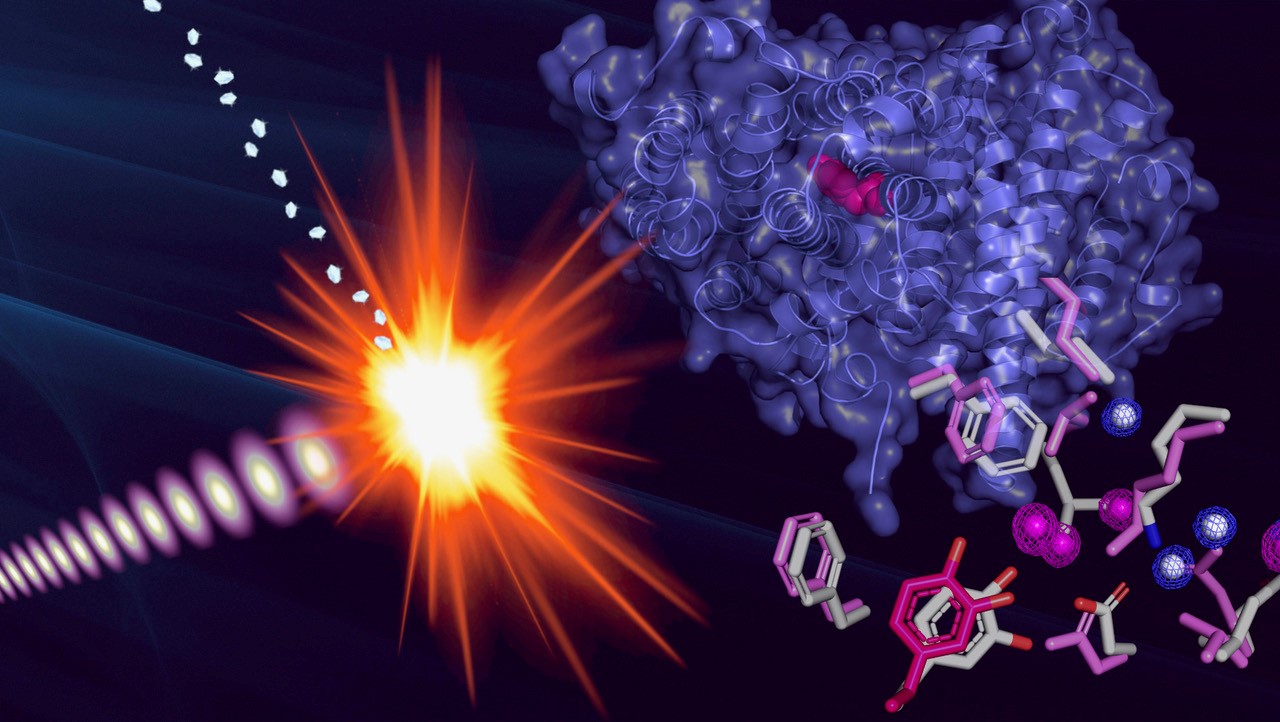 La estructura del radical proteico se determinó exponiendo microcristales del radical proteico a pulsos extremadamente cortos e intensos de un láser de rayos X. (Imagen: Martin Högbom, Universidad de Estocolmo) Los RNR han desconcertado a los científicos durante décadas. Generan radicales libres, que son un tipo de molécula que puede dañar las células, pero que también son esenciales para varios procesos bioquímicos. Resolver el misterio de los RNR radica en comprender su estado radical activo, un fenómeno aparentemente paradójico descubierto por primera vez hace 50 años en el que la proteína es en sí misma un radical y, por lo tanto, tiene un número impar de electrones.
"Como tengo experiencia en química, me sorprendió saber que las enzimas utilizan radicales", dijo Martin Högbom, investigador de la Universidad de Estocolmo que dirigió la investigación. “En aquel momento, la idea de determinar el aspecto de un radical proteico parecía incluso teóricamente descabellada. Pero esta curiosidad me siguió a lo largo de mi carrera científica”. A lo largo de los años, se ha reconocido que muchos sistemas enzimáticos utilizan química radical, pero hasta ahora no ha sido posible observar la estructura de las proteínas en este estado reactivo debido a su sensibilidad inherente a la medición.
"Usamos rayos X para medir la estructura de las proteínas, pero los radicales son extremadamente sensibles al daño por radiación inducido por estos haces de rayos X". dijo el científico y colaborador de SLAC Roberto Alonso-Mori. "Los rayos X pueden generar muchos electrones y otros radicales que pueden anular el estado radical de la proteína que queremos investigar". Utilizando el láser de rayos X Linac Coherent Light Source (LCLS) de SLAC, el equipo empleó una técnica de vanguardia llamada cristalografía en serie de femtosegundos, que permite a los investigadores observar proteínas y otras moléculas a la temperatura a la que se encuentran en la naturaleza, junto con difracción antes de la destrucción, que permite a los investigadores recopilar información precisa de muestras delicadas en el instante antes de que el láser las destruya. Esto les permitió capturar imágenes de la proteína en su estado radical activo por primera vez, proporcionando información directa sobre cómo se comporta cuando es funcional.
Más allá de su importancia fundamental en biología, el descubrimiento tiene potencial terapéutico ya que la RNR es esencial para la división celular.
Colaborador Jan Kern, científico del Laboratorio Nacional Lawrence Berkeley. dijo: "Con este nuevo método, podemos comprender el control natural y la utilización de estos estados reactivos, ofreciendo avances potenciales en tratamientos, especialmente para afecciones como el cáncer". Para el seguimiento, los investigadores esperan ampliar sus estudios a otras formas de esta enzima.
"Nuestro objetivo es estudiar otros tipos de ribonucleótidos reductasas, ampliando nuestra comprensión de la formación de radicales en diferentes tipos de enzimas", dijo el colaborador Hugo Lebrette, ex investigador postdoctoral en la Universidad de Estocolmo y ahora líder de grupo de investigación en el CNRS-Universidad de Toulouse.
"Compararlos podría proporcionar información sobre cómo atacar enzimas específicas en organismos relevantes", añadió el colaborador Vivek Srinivas, investigador postdoctoral en la Universidad de Estocolmo. "Esto abriría la puerta a la observación de diferentes proteínas en sus formas activas, con la esperanza de que esto pueda remodelar el tratamiento de enfermedades". métodos." Si bien la recopilación de datos en sí se ejecutó en una hora, las bases para este hito se sentaron a lo largo de varias décadas, marcadas por un trabajo preliminar meticuloso, la identificación de sistemas modelo adecuados y la preparación de muestras.
"Mi fascinación por los radicales proteicos comenzó hace casi 30 años durante mis estudios universitarios", dijo Högbom. “El concepto de una enzima que genera y mantiene un radical fue una revelación. Nuestro objetivo es comprender esta familia de proteínas de manera integral, y cada experimento, cada artículo, nos acerca a ese objetivo.
La estructura del radical proteico se determinó exponiendo microcristales del radical proteico a pulsos extremadamente cortos e intensos de un láser de rayos X. (Imagen: Martin Högbom, Universidad de Estocolmo) Los RNR han desconcertado a los científicos durante décadas. Generan radicales libres, que son un tipo de molécula que puede dañar las células, pero que también son esenciales para varios procesos bioquímicos. Resolver el misterio de los RNR radica en comprender su estado radical activo, un fenómeno aparentemente paradójico descubierto por primera vez hace 50 años en el que la proteína es en sí misma un radical y, por lo tanto, tiene un número impar de electrones.
"Como tengo experiencia en química, me sorprendió saber que las enzimas utilizan radicales", dijo Martin Högbom, investigador de la Universidad de Estocolmo que dirigió la investigación. “En aquel momento, la idea de determinar el aspecto de un radical proteico parecía incluso teóricamente descabellada. Pero esta curiosidad me siguió a lo largo de mi carrera científica”. A lo largo de los años, se ha reconocido que muchos sistemas enzimáticos utilizan química radical, pero hasta ahora no ha sido posible observar la estructura de las proteínas en este estado reactivo debido a su sensibilidad inherente a la medición.
"Usamos rayos X para medir la estructura de las proteínas, pero los radicales son extremadamente sensibles al daño por radiación inducido por estos haces de rayos X". dijo el científico y colaborador de SLAC Roberto Alonso-Mori. "Los rayos X pueden generar muchos electrones y otros radicales que pueden anular el estado radical de la proteína que queremos investigar". Utilizando el láser de rayos X Linac Coherent Light Source (LCLS) de SLAC, el equipo empleó una técnica de vanguardia llamada cristalografía en serie de femtosegundos, que permite a los investigadores observar proteínas y otras moléculas a la temperatura a la que se encuentran en la naturaleza, junto con difracción antes de la destrucción, que permite a los investigadores recopilar información precisa de muestras delicadas en el instante antes de que el láser las destruya. Esto les permitió capturar imágenes de la proteína en su estado radical activo por primera vez, proporcionando información directa sobre cómo se comporta cuando es funcional.
Más allá de su importancia fundamental en biología, el descubrimiento tiene potencial terapéutico ya que la RNR es esencial para la división celular.
Colaborador Jan Kern, científico del Laboratorio Nacional Lawrence Berkeley. dijo: "Con este nuevo método, podemos comprender el control natural y la utilización de estos estados reactivos, ofreciendo avances potenciales en tratamientos, especialmente para afecciones como el cáncer". Para el seguimiento, los investigadores esperan ampliar sus estudios a otras formas de esta enzima.
"Nuestro objetivo es estudiar otros tipos de ribonucleótidos reductasas, ampliando nuestra comprensión de la formación de radicales en diferentes tipos de enzimas", dijo el colaborador Hugo Lebrette, ex investigador postdoctoral en la Universidad de Estocolmo y ahora líder de grupo de investigación en el CNRS-Universidad de Toulouse.
"Compararlos podría proporcionar información sobre cómo atacar enzimas específicas en organismos relevantes", añadió el colaborador Vivek Srinivas, investigador postdoctoral en la Universidad de Estocolmo. "Esto abriría la puerta a la observación de diferentes proteínas en sus formas activas, con la esperanza de que esto pueda remodelar el tratamiento de enfermedades". métodos." Si bien la recopilación de datos en sí se ejecutó en una hora, las bases para este hito se sentaron a lo largo de varias décadas, marcadas por un trabajo preliminar meticuloso, la identificación de sistemas modelo adecuados y la preparación de muestras.
"Mi fascinación por los radicales proteicos comenzó hace casi 30 años durante mis estudios universitarios", dijo Högbom. “El concepto de una enzima que genera y mantiene un radical fue una revelación. Nuestro objetivo es comprender esta familia de proteínas de manera integral, y cada experimento, cada artículo, nos acerca a ese objetivo.
 La estructura del radical proteico se determinó exponiendo microcristales del radical proteico a pulsos extremadamente cortos e intensos de un láser de rayos X. (Imagen: Martin Högbom, Universidad de Estocolmo) Los RNR han desconcertado a los científicos durante décadas. Generan radicales libres, que son un tipo de molécula que puede dañar las células, pero que también son esenciales para varios procesos bioquímicos. Resolver el misterio de los RNR radica en comprender su estado radical activo, un fenómeno aparentemente paradójico descubierto por primera vez hace 50 años en el que la proteína es en sí misma un radical y, por lo tanto, tiene un número impar de electrones.
"Como tengo experiencia en química, me sorprendió saber que las enzimas utilizan radicales", dijo Martin Högbom, investigador de la Universidad de Estocolmo que dirigió la investigación. “En aquel momento, la idea de determinar el aspecto de un radical proteico parecía incluso teóricamente descabellada. Pero esta curiosidad me siguió a lo largo de mi carrera científica”. A lo largo de los años, se ha reconocido que muchos sistemas enzimáticos utilizan química radical, pero hasta ahora no ha sido posible observar la estructura de las proteínas en este estado reactivo debido a su sensibilidad inherente a la medición.
"Usamos rayos X para medir la estructura de las proteínas, pero los radicales son extremadamente sensibles al daño por radiación inducido por estos haces de rayos X". dijo el científico y colaborador de SLAC Roberto Alonso-Mori. "Los rayos X pueden generar muchos electrones y otros radicales que pueden anular el estado radical de la proteína que queremos investigar". Utilizando el láser de rayos X Linac Coherent Light Source (LCLS) de SLAC, el equipo empleó una técnica de vanguardia llamada cristalografía en serie de femtosegundos, que permite a los investigadores observar proteínas y otras moléculas a la temperatura a la que se encuentran en la naturaleza, junto con difracción antes de la destrucción, que permite a los investigadores recopilar información precisa de muestras delicadas en el instante antes de que el láser las destruya. Esto les permitió capturar imágenes de la proteína en su estado radical activo por primera vez, proporcionando información directa sobre cómo se comporta cuando es funcional.
Más allá de su importancia fundamental en biología, el descubrimiento tiene potencial terapéutico ya que la RNR es esencial para la división celular.
Colaborador Jan Kern, científico del Laboratorio Nacional Lawrence Berkeley. dijo: "Con este nuevo método, podemos comprender el control natural y la utilización de estos estados reactivos, ofreciendo avances potenciales en tratamientos, especialmente para afecciones como el cáncer". Para el seguimiento, los investigadores esperan ampliar sus estudios a otras formas de esta enzima.
"Nuestro objetivo es estudiar otros tipos de ribonucleótidos reductasas, ampliando nuestra comprensión de la formación de radicales en diferentes tipos de enzimas", dijo el colaborador Hugo Lebrette, ex investigador postdoctoral en la Universidad de Estocolmo y ahora líder de grupo de investigación en el CNRS-Universidad de Toulouse.
"Compararlos podría proporcionar información sobre cómo atacar enzimas específicas en organismos relevantes", añadió el colaborador Vivek Srinivas, investigador postdoctoral en la Universidad de Estocolmo. "Esto abriría la puerta a la observación de diferentes proteínas en sus formas activas, con la esperanza de que esto pueda remodelar el tratamiento de enfermedades". métodos." Si bien la recopilación de datos en sí se ejecutó en una hora, las bases para este hito se sentaron a lo largo de varias décadas, marcadas por un trabajo preliminar meticuloso, la identificación de sistemas modelo adecuados y la preparación de muestras.
"Mi fascinación por los radicales proteicos comenzó hace casi 30 años durante mis estudios universitarios", dijo Högbom. “El concepto de una enzima que genera y mantiene un radical fue una revelación. Nuestro objetivo es comprender esta familia de proteínas de manera integral, y cada experimento, cada artículo, nos acerca a ese objetivo.
La estructura del radical proteico se determinó exponiendo microcristales del radical proteico a pulsos extremadamente cortos e intensos de un láser de rayos X. (Imagen: Martin Högbom, Universidad de Estocolmo) Los RNR han desconcertado a los científicos durante décadas. Generan radicales libres, que son un tipo de molécula que puede dañar las células, pero que también son esenciales para varios procesos bioquímicos. Resolver el misterio de los RNR radica en comprender su estado radical activo, un fenómeno aparentemente paradójico descubierto por primera vez hace 50 años en el que la proteína es en sí misma un radical y, por lo tanto, tiene un número impar de electrones.
"Como tengo experiencia en química, me sorprendió saber que las enzimas utilizan radicales", dijo Martin Högbom, investigador de la Universidad de Estocolmo que dirigió la investigación. “En aquel momento, la idea de determinar el aspecto de un radical proteico parecía incluso teóricamente descabellada. Pero esta curiosidad me siguió a lo largo de mi carrera científica”. A lo largo de los años, se ha reconocido que muchos sistemas enzimáticos utilizan química radical, pero hasta ahora no ha sido posible observar la estructura de las proteínas en este estado reactivo debido a su sensibilidad inherente a la medición.
"Usamos rayos X para medir la estructura de las proteínas, pero los radicales son extremadamente sensibles al daño por radiación inducido por estos haces de rayos X". dijo el científico y colaborador de SLAC Roberto Alonso-Mori. "Los rayos X pueden generar muchos electrones y otros radicales que pueden anular el estado radical de la proteína que queremos investigar". Utilizando el láser de rayos X Linac Coherent Light Source (LCLS) de SLAC, el equipo empleó una técnica de vanguardia llamada cristalografía en serie de femtosegundos, que permite a los investigadores observar proteínas y otras moléculas a la temperatura a la que se encuentran en la naturaleza, junto con difracción antes de la destrucción, que permite a los investigadores recopilar información precisa de muestras delicadas en el instante antes de que el láser las destruya. Esto les permitió capturar imágenes de la proteína en su estado radical activo por primera vez, proporcionando información directa sobre cómo se comporta cuando es funcional.
Más allá de su importancia fundamental en biología, el descubrimiento tiene potencial terapéutico ya que la RNR es esencial para la división celular.
Colaborador Jan Kern, científico del Laboratorio Nacional Lawrence Berkeley. dijo: "Con este nuevo método, podemos comprender el control natural y la utilización de estos estados reactivos, ofreciendo avances potenciales en tratamientos, especialmente para afecciones como el cáncer". Para el seguimiento, los investigadores esperan ampliar sus estudios a otras formas de esta enzima.
"Nuestro objetivo es estudiar otros tipos de ribonucleótidos reductasas, ampliando nuestra comprensión de la formación de radicales en diferentes tipos de enzimas", dijo el colaborador Hugo Lebrette, ex investigador postdoctoral en la Universidad de Estocolmo y ahora líder de grupo de investigación en el CNRS-Universidad de Toulouse.
"Compararlos podría proporcionar información sobre cómo atacar enzimas específicas en organismos relevantes", añadió el colaborador Vivek Srinivas, investigador postdoctoral en la Universidad de Estocolmo. "Esto abriría la puerta a la observación de diferentes proteínas en sus formas activas, con la esperanza de que esto pueda remodelar el tratamiento de enfermedades". métodos." Si bien la recopilación de datos en sí se ejecutó en una hora, las bases para este hito se sentaron a lo largo de varias décadas, marcadas por un trabajo preliminar meticuloso, la identificación de sistemas modelo adecuados y la preparación de muestras.
"Mi fascinación por los radicales proteicos comenzó hace casi 30 años durante mis estudios universitarios", dijo Högbom. “El concepto de una enzima que genera y mantiene un radical fue una revelación. Nuestro objetivo es comprender esta familia de proteínas de manera integral, y cada experimento, cada artículo, nos acerca a ese objetivo.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- Fuente: https://www.nanowerk.com/news2/biotech/newsid=63832.php



