Propiedades de la biopelícula
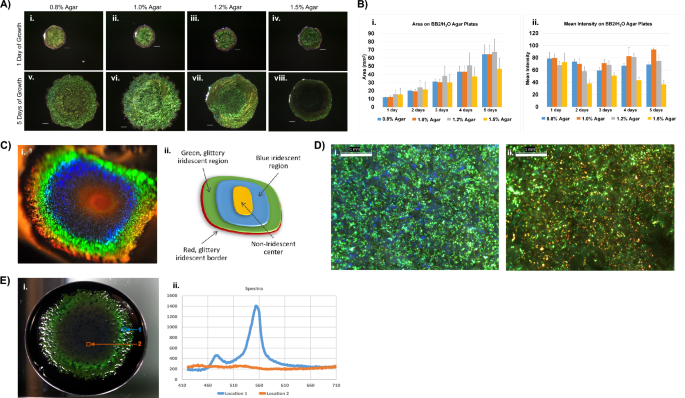
celulofaga lytica 7489 biopelículas cultivadas durante 24 h en BB2/H2Se compararon medios O que contenían varias concentraciones de agar (Fig. 1A, B). Los patrones de color diferían después de 5 días y el agar al 1.0% sostenía las colonias más brillantes. Los medios de cultivo que contenían más de 1.2% de agar permitieron el crecimiento, aunque la propagación de las colonias fue limitada en comparación con aquellos que contenían 1% de agar o menos. Las biopelículas de agar al 1.5% eran más pequeñas con una intensidad media de píxeles más baja. A menos que se indique específicamente, los datos restantes de este estudio se basaron en biopelículas de placas de agar al 1 % que contenían BB2/H.2O. La incubación continua en agar al 1% dio como resultado biopelículas con una coloración en gradiente concéntrica (Fig. 1C). Aunque las dimensiones e intensidades relativas de estas regiones variaron entre las muestras, el orden de coloración en las biopelículas maduras no cambió. Además, los centros de la biopelícula a menudo adquirieron un color naranja dorado, posiblemente debido al pigmento zeaxantina que se sabe que está presente en C.lytica29. Avanzando radialmente hacia afuera, las siguientes bandas de color eran azules, seguidas de un verde brillante y una estrecha banda roja alrededor del perímetro de las biopelículas. La ampliación reveló que los colores son mosaicos donde el color predominante en estos dominios milimétricos determina el color macroscópico percibido (Fig. 1D). Es importante destacar que los mosaicos muestran el potencial de C.lytica biopelículas para reflejar una gama de colores.
Dadas las condiciones particulares de crecimiento, C.lytica 7489 produce biopelículas intensamente iridiscentes, aunque anteriormente se informó que carecía de color. (A) Representante C.lytica Se cultivaron 7489 biopelículas a 27 °C en BB2/H.2O placas de agar que contengan 0.8%, 1.0%, 1.2% o 1.5% de agar. Se tomaron imágenes de las biopelículas cada día durante 5 días. La concentración de agar afecta la saturación del color y la expansión de DSM 7489 C.lytica biopelículas. Barra de escala = 1 mm. (B) Las mediciones de áreas (i) e intensidad media (ii) de biopelículas en A se registraron diariamente utilizando ImageJ. Los datos se presentan como promedios para cada momento y la desviación estándar se muestra como ±error (n = 10 para cada momento). (C) C.lytica 7489 es capaz de generar una gama de colores intensos como se muestra en esta fotografía de una biopelícula adquirida desde un ángulo de visión oblicuo (i) y un esquema que muestra la coloración concéntrica (ii). (D) Imágenes ópticas que muestran que las regiones de la biopelícula que aparecen macroscópicamente verdes (i) y rojas (ii) son mosaicos de colores puntillistas. (barra = 1 mm) (E) Un cubo de datos hiperespectral representativo revela variaciones regionales específicas en la intensidad de la señal en biopelículas maduras. (i) La biopelícula se cultivó en una placa de Petri de 10 cm sobre agar nutritivo que contenía tinta negra. Tenga en cuenta que el detector es normal a la superficie de la biopelícula. Su posición es la razón de la reducción de la intensidad de reflexión en comparación con la biopelícula en (C-i). Las regiones exteriores de la biopelícula generan un pico especialmente agudo centrado cerca de 550 nm, lo que sugiere una reflexión constructiva y coherente a través de la biopelícula. (ii, ubicación 1) Por el contrario, los reflejos en la región central permanecen cerca de la línea de base. (ii, ubicación 2)
Se utilizó un sistema hiperespectral de mesa Resonon para generar cubos de datos que representan respuestas ópticas masivas de seres vivos. C.lytica biopelículas (Fig. 1MI). Se recolectaron espectros que abarcan el rango visible y muestran intensidades aumentadas centradas cerca de 550 nm. El pico agudo sugiere que se producen reflexiones constructivas y coherentes a través de la biopelícula. Por el contrario, las intensidades asociadas con el centro de la biopelícula permanecen cerca de los niveles iniciales. En otros experimentos, utilizando geometría retrodispersada y ángulos de excitación variables, se estableció una dependencia del ángulo de detección (Fig. 1).
Disposición celular, empaquetamiento y morfología dentro. C.lytica 7489 biopelículas
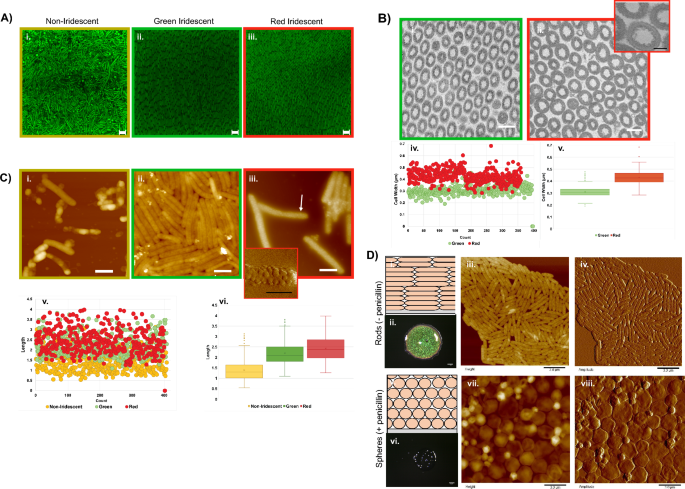
Estudios previos de Flavobacterium Las biopelículas revelaron que el espaciado y la morfología celular afectaban las longitudes de onda reflejadas.21,30. Para comprender las diferencias de color en C.lytica 7489 biopelículas, se aplicaron técnicas de microscopía complementarias. la disposición de C.lytica Dentro de las biopelículas se visualizó mediante microscopía confocal de biopelículas fijadas teñidas con SYTO9 (Fig. 2A). Las regiones de la biopelícula no asociadas con la iridiscencia contienen células orientadas al azar, aunque también se observaron pequeños grupos de células alineadas. Las estructuras esféricas, también presentes en esta región, aumentaron en número a medida que el plano de imagen se acercaba al sustrato (Fig. 2A). Por el contrario, las células en las regiones iridiscentes estaban muy empaquetadas y ordenadas en capas policristalinas planas, como se confirma en la transformada rápida de Fourier (FFT) de la imagen de la región iridiscente verde (Fig. 2B). El orden persistió a lo largo de decenas de micrones con los límites de los granos indicados por un cambio en las direcciones de las celdas.
Microscopía de células de biopelículas. (A) Imágenes confocales de biopelículas teñidas con SYTO9 que muestran que la organización celular difiere entre regiones no iridiscentes (i) e iridiscentes (ii, iii) (barra = 2.0 µm). (B) Imágenes de secciones transversales de microscopía electrónica de transmisión (TEM) de las regiones verde (i) y roja (ii). (barra = 0.5 µm) Recuadro (iii) que muestra pequeñas protuberancias que rodean las paredes celulares (barra = 200 nm). Las medidas de ancho (iv, v) también difieren según la región. (C) Imágenes de altura de microscopía de fuerza atómica (AFM) de regiones no iridiscentes (i), verdes iridiscentes (ii) y rojas iridiscentes (iii) que muestran que distintas morfologías celulares están asociadas con cada región (barra = 1.0 µm). El recuadro (iv) es una imagen de amplitud AFM de la región indicada por la flecha (barra = 0.5 µm). Mediciones de longitud de regiones de biopelículas específicas (v, vi). (D) Biopelículas de 2 días cultivadas en condiciones ambientales en BB2/H2O agar (barras de escala óptica = 1 mm; barras AFM = 3 µm). Esquema que muestra la disposición típica de las células en biopelículas iridiscentes (i). Imagen óptica de biopelícula iridiscente. (ii) Imágenes de altura (iii) y amplitud (iv) de AFM de células de biopelícula iridiscente que muestran una morfología típica en forma de varilla. Esquema que muestra la disposición prevista de las células en biopelículas que crecen cuando se agrega penicilina subletal (v). Imagen óptica de una biopelícula que muestra que la penicilina subletal altera la coloración estructural. (vi) Las imágenes de altura (vii) y amplitud (viii) de AFM de las células confirman la conversión a esferas debido al tratamiento con penicilina.
Los eucariotas incorporan componentes que contribuyen a la iridiscencia en tejidos que pueden manipularse durante el estudio. C.lytica Sin embargo, la iridiscencia se deriva de células independientes y poco asociadas que se separan fácilmente mediante alteraciones mecánicas, incluida la turbulencia debida a una hidratación excesiva. La reticulación de las células con glutaraldehído conservó la iridiscencia y permitió la eliminación de biopelículas intactas del agar para su caracterización mediante microscopía electrónica de transmisión (TEM). Micrografías electrónicas transversales de fijos. C.lytica 7489 biopelículas confirmaron la periodicidad en áreas iridiscentes (Fig. 2B). Las células en las regiones verde y roja tenían anchos medios de 310 nm y 428 nm, respectivamente, lo que indica que los cambios en el ancho de las células contribuyeron a las variaciones de color. Además, las imágenes TEM de mayor aumento de las células de la región roja revelaron pequeñas protuberancias que rodeaban las paredes celulares (Fig. 2B-iii). Las imágenes laterales de biopelículas, adquiridas mediante microscopía electrónica de barrido (SEM), muestran que el orden se produce en todo el espesor de las biopelículas, que oscila entre 15 y 60 µm (Figura complementaria. 2C).
Dadas las diferencias en el ancho observadas en los datos TEM y la asociación con regiones específicas de la biopelícula, buscamos comparar las morfologías de las células utilizando microscopía de fuerza atómica (AFM) (Fig. 2C). Las células de la región no iridiscente eran irregulares, estaban asociadas con protuberancias esféricas y a menudo parecían desinfladas. Por el contrario, las células de las regiones iridiscentes roja y verde mantuvieron morfologías y dimensiones regulares, como se esperaba de bacterias sanas con forma de bastón. A pesar de los repetidos intentos de alterar los agregados, las células de las regiones verdes iridiscentes permanecieron estrechamente asociadas, lo que indica que las propiedades de la superficie celular también variaron según la región (Fig. 2C-ii). En marcado contraste, las células de la región roja a menudo estaban cubiertas por vesículas de membrana (Figs. 2C-iii y iv y Fig. complementaria. 3). Bacterias Gram negativas, incluidas C.lytica Se sabe que generan vesículas de membrana externa.31,32. Sin embargo, llamó la atención la cobertura total de la superficie por parte de las vesículas. Las imágenes AFM mejor definidas sugirieron que las protuberancias de membrana observadas en las secciones transversales de TEM eran vesículas. Una comparación de las longitudes de las células de las diferentes regiones reveló que las células no iridiscentes son más cortas que las de las regiones verde o roja con valores medios de 1.39 µm, 2.20 µm y 2.42 µm, respectivamente (Fig. 2Cv,vi). En conjunto, los datos de las imágenes indicaron distintos tamaños y topologías de superficie dependiendo de la ubicación de las células dentro de la biopelícula.
El peptidoglicano en las bacterias Gram negativas es un polímero en forma de jaula que proporciona la estabilidad mecánica de la célula. Situada entre la membrana citoplasmática y la membrana externa, su forma determina la morfología de las bacterias. Se sabe ampliamente que los antibióticos lisozima y betalactámicos alteran el peptidoglicano y provocan la lisis celular. Sin embargo, en dosis subletales, las bacterias Gram negativas, incluidas E. coli sobreviven al tratamiento pero se convierten de varillas a esferas33,34,35. Para determinar si la coloración requiere peptidoglicano intacto, se agregaron 30 µg/ml de penicilina a las placas de agar antes de la inoculación con C.lytica (Higo. 2D). Después de 48 h, las biopelículas tratadas carecían de iridiscencia debido a la conversión de C.lytica en esferas, lo que indica la importancia del peptidoglicano para la iridiscencia. Estos resultados también mostraron que se pueden utilizar reactivos modificadores de forma exógenos para influir en las propiedades ópticas de las biopelículas.
Escalabilidad y sintonizabilidad de biopelículas para la fabricación.
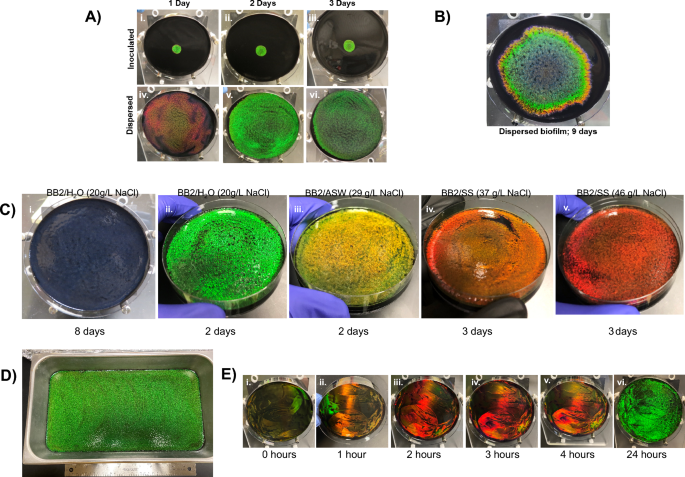
celulofaga lytica Las biopelículas se expandieron radialmente desde el punto de inoculación y mostraron bandas de colores (Fig. 1A). Este patrón probablemente fue una consecuencia de diferencias temporales en las morfologías celulares inducidas por cambios en el entorno local (por ejemplo, disponibilidad de nutrientes, pH, metabolitos, etc.) durante el crecimiento celular. Dado que las biopelículas monocromáticas indicarían morfologías consistentes, razonamos que agregar suficientes células a la vez a toda la superficie del agar expondría todas las células al mismo ambiente simultáneamente y sincronizaría el color reflejado. Esta hipótesis se probó comparando biopelículas iniciadas con un inóculo localizado de 100 µl con aquellas en las que el mismo volumen de inóculo se dispersó sobre el agar utilizando un esparcidor de células. (Higo. 3A) Fotografías representativas muestran que después de 1 día de crecimiento en condiciones ambientales, las biopelículas inoculadas reflejaban una iridiscencia verde brillante alrededor del centro de la placa, mientras que las biopelículas dispersas eran de color rojo difuso en toda la superficie de la placa. Después de 2 días de crecimiento, ambas preparaciones produjeron una iridiscencia verde brillante, aunque biopelículas dispersas cubrieron toda la superficie del agar. La iridiscencia en biopelículas dispersas disminuyó considerablemente después de 3 días. Con el tiempo adicional, las biopelículas inoculadas se expandieron hasta cubrir la mayor parte de la superficie del agar (Fig. 3B). Por lo tanto, la dispersión de las células acortó el tiempo hasta la iridiscencia óptima y amplió el área de la placa cubierta con bacterias monocromáticas ordenadas.
Desde Kientz et al. demostró que la salinidad afecta la coloración de las biopelículas CECT 8139, las biopelículas DSM 7489 se probaron de manera similar27 (Higo. 3C). El medio se amplió con un análogo de sal marina Instant Ocean (BB2/ASW) o Lake Products Sea Salt ASTM D1141-98 (BB2/SS). En comparación con las biopelículas dispersas en BB2/H2O, el crecimiento en BB2/ASW y BB2/SS generó colonias casi monocromáticas con desplazamientos al rojo que se correlacionan con la cantidad del análogo de sal marina agregado al medio. Dado que los análogos difieren principalmente en las concentraciones de NaCl, probamos si aumentar la concentración de NaCl es suficiente para generar los colores rojos desplazados mediante el crecimiento de biopelículas en BB2/H.2O placas suplementadas con cantidades variables de NaCl (Fig. 4A). Las concentraciones crecientes de NaCl en placas localizadas provocaron cambios de color hacia el rojo, lo que permitió manipular de forma exógena las propiedades de la biopelícula. Las bandas mostradas en la Fig. 1 reflejar el distancia de colores que pueden ser generados por C.lytica biopelículas. Aquí mostramos que ese rojo, uno de los primeros colores de BB2/H2Las placas de agar O se generaron aumentando la salinidad de los medios de crecimiento, mientras que las placas de agar azul se generaron extendiendo el período de crecimiento. En conjunto, llegamos a la conclusión de que el aspecto temporal de la coloración se deriva de las respuestas celulares al entorno local.
Biopelículas monocromáticas. (A) Una comparación de biopelículas inoculadas (i–iii) versus dispersas (iv–vi) a temperatura ambiente. Las biopelículas dispersas alcanzan su punto máximo en color monocromático y llenan la placa a los 2 días (v). (B) Mientras que las biopelículas inoculadas desarrollan una coloración en bandas y requieren mucho más tiempo para cubrir la superficie. (C) Fotos que muestran que la dispersión C.lytica Las células conducen a biopelículas monocromáticas de varios colores, presumiblemente al exponer simultáneamente todas las células a condiciones de crecimiento homogéneas (nutrientes, metabolitos, etc.). Se puede acceder a la gama de colores extendiendo el período de crecimiento (i) o cambiando la salinidad del medio (ii - v) utilizando simulantes de agua de mar. NaCl eficaz en la receta que figura entre paréntesis. Las placas se cultivaron en condiciones ambientales durante el tiempo indicado. (D) Se generó una gran biopelícula verde en 3 días en condiciones ambientales dispersando un inóculo proporcional en la superficie de un recipiente de 41 x 23 cm. (E) La aplicación secuencial y la dispersión de alícuotas de cultivo concentradas 50 veces reducen la formación de biopelículas monocromáticas a 24 h o menos, lo que sugiere que las células comienzan a organizarse inmediatamente y que la densidad celular será una consideración importante para las aplicaciones de fabricación industrial. Las placas se incubaron a 27 °C entre aplicaciones celulares. Ensayos adicionales mostrados en la figura complementaria 4E, F.
La dispersión de un inóculo proporcionalmente más grande a través de una superficie de agar de 41 cm × 23 cm generó una biopelícula monocromática que llenaba la superficie después de 3 días de incubación a temperatura ambiente, mientras que un inóculo localizado condujo a un área iridiscente restringida (Figs. 3D, suplementario 4B). Para reducir aún más el tiempo necesario para generar biopelículas monocromáticas de área grande, probamos si el aumento de células en el inóculo conduce a una iridiscencia más rápida. Específicamente, los cultivos nocturnos se concentraron antes de dispersar las células en el agar. La velocidad con la que apareció la iridiscencia se correlacionó con la concentración del inóculo disperso a través de la superficie (Fig. 4C). Una estrategia de capas aceleró aún más la formación de iridiscencia cuando se aplicaron en serie células concentradas 50 veces a las placas de agar (Figs. 3E, figuras suplementarias. 4E, 4F, 5, 6) En particular, aparecieron temprano reflejos amarillos y rojos vibrantes, consistentes con la secuencia de coloración en las biopelículas inoculadas donde el rojo se ve transitoriamente en la periferia de la placa inoculada seguido del verde. A las 24 h, toda la placa reflejaba color verde. En conjunto, estos resultados muestran que las células pueden organizarse rápidamente en estructuras fotónicas y que el número de células es un factor limitante para la formación de biopelículas iridiscentes.
Incorporación de biopelículas en materiales.
Se probó el crecimiento en sustratos porosos, incluido papel de filtro cualitativo (Whatman, grado 2), membranas de poliéster para grabado en huellas (Sterlitech), tela de algodón y seda sobre agar nutritivo. La retención de medios y la difusión de nutrientes permitieron el crecimiento y la expansión de biopelículas en estos sustratos. Es importante destacar que los patrones de color reflejados eran similares a los de las biopelículas cultivadas directamente en las placas de agar (Fig. 4). De los sustratos probados, se seleccionó el papel de filtro para estudios adicionales debido a la calidad de la biopelícula iridiscente, el bajo costo del sustrato y la flexibilidad. Después del crecimiento, las biopelículas asociadas al papel (PAB) se transfirieron a agar que contenía glutaraldehído para su fijación y preservar la iridiscencia. El papel facilitó el manejo de la biopelícula durante la caracterización y posterior procesamiento. La iridiscencia de los PAB se perdió después del secado, pero se restableció rápidamente con la adición de agua (Fig. 4C). Los PAB toleraron múltiples ciclos de secado y rehidratación con una pérdida mínima de iridiscencia. Las imágenes AFM de las biopelículas de papel fijadas confirmaron la disposición cristalina de las células (Fig. 7B).
El crecimiento ambiental de biopelículas iridiscentes sobre sustratos porosos, incluido el papel, facilita el manejo para la caracterización y el procesamiento posterior. (A) C.lytica Las biopelículas se cultivaron en condiciones ambientales sobre una variedad de sustratos porosos. (B) El papel de filtro Whatman 2 colocado sobre agar nutritivo es uno de varios sustratos porosos que permiten C.lytica para formar colonias iridiscentes. Al igual que en las placas de agar, las biopelículas vivas asociadas al papel (PAB) son verdes después de 3 días de crecimiento sobre BB2/H.2Agar O (Ai) y desplazamiento al rojo cuando aumenta la salinidad como en BB2/SS (A-ii). (C) Los PAB conservan su iridiscencia después de retirarlos del agar y fijarlos con glutaraldehído (Bi). Secar los PAB fijados con nitrógeno hace que pierdan su iridiscencia (B-ii). Sin embargo, el color estructural se restablece tras la rehidratación (B-iii). (D) Los PAB vivos conservan su capacidad de responder a señales ambientales. PAB de BB2/H2El agar O refleja principalmente verde hasta que se traslada a placas BB2/SS donde los reflejos cambian al rojo (Ci y C-ii, respectivamente). De manera similar, los PAB que se originan en placas de agar BB2/SS son rojos pero cambian a verde cuando se colocan en BB2/H.2O (C-iv y Cv, respectivamente). En ambos casos, las biopelículas pueden volver a su color original cuando se devuelven a la condición del medio original (C-iii y C-vi). Las biopelículas fijas no muestran este comportamiento dinámico (C-vii y C-viii).
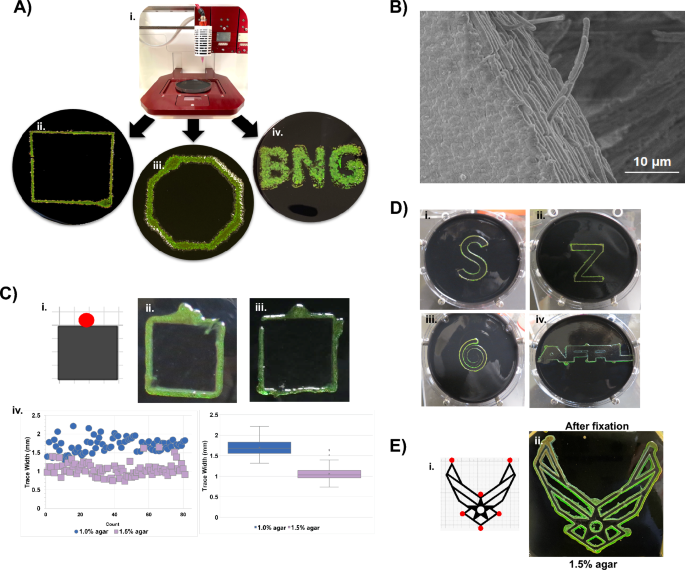
C.lytica se puede utilizar como biotinta iridiscente. (A) Diseños impresos en 3D que contienen C.lytica se generaron en agar usando una configuración Allevi 3 Bioprinter (Ai a A-iv). Como se demostró anteriormente para las biopelículas dispersas, el aumento de la salinidad desplaza hacia el rojo la C.lytica El reflejo de la tinta. (Fig. complementaria. 9) (B) Imagen SEM del borde de una biopelícula impresa en 3D que muestra células ordenadas de la biopelícula impresa. (C, D) C.lytica trazar los bordes de una plantilla de papel (por ejemplo, un esquema en Ci). El círculo rojo en el diseño de la plantilla indica el sitio de inoculación. Las células se comportan como una biotinta autoimpresa para escribir varios patrones en condiciones ambientales. (B) El aumento de la concentración de agar del 1.0% (C-ii) al 1.5% (C-iii) reduce el ancho del trazado como se revela en las mediciones de Keyence (C-iv). Este resultado sugiere que la motilidad de deslizamiento está modulada de una manera que confina las células más cerca de la plantilla en el agar de mayor concentración. (D) Los calcos adicionales muestran que BACTracing se puede utilizar con formas de diferente complejidad, ángulos y conexiones. La concentración de agar se puede utilizar para confinar las trazas cuando la distancia entre las características es pequeña, como es el caso de patrones intrincados como el símbolo de la Fuerza Aérea (Fig. 6C). (E) Plantilla de un patrón complejo (i) y su contraparte BACTraced (ii) después de la fijación, lo que muestra que el patrón iridiscente se puede conservar.
Los PAB vivos (es decir, sin fijación) conservaron su capacidad de responder a señales ambientales. Por ejemplo, PAB en BB2/H2Las placas de agar O reflejaron principalmente en verde hasta que se trasladaron a placas BB2/SS donde la reflexión se desplazó al rojo y viceversa (Fig. 4D). En ambos casos, las biopelículas volvieron a su color original cuando volvieron a la condición del medio original (Figura complementaria. 8A). Esta reversión no ocurrió cuando las células se fijaron con glutaraldehído, lo que confirma que la capacidad de las células vivas para detectar y responder era necesaria para los cambios de color. Al igual que con las biopelículas localizadas y dispersas, se pueden administrar reactivos exógenos como la penicilina y la lisozima a la biopelícula a través del sustrato de papel para controlar las propiedades de la biopelícula (Fig. 8B).
celulofaga lytica biopelículas como tintas iridiscentes
Buscando desarrollar tintas bacterianas ordenadas basadas en C.lytica, se empleó una bioimpresora Allevi 3™ para depositar las células en patrones preprogramados y Google SketchUp para crear archivos de diseño STL que van desde formas hasta letras. Los cultivos impresos mantuvieron los patrones deseados en BB2/H2O placas después de la incubación y crecimiento a 27 °C (Fig. 5A). Los patrones también se imprimieron en placas de agar BB2/ASW donde el aumento de la salinidad nuevamente hizo que el rojo cambiara el color. (Figura complementaria. 9A) Las imágenes SEM posteriores de las biopelículas reticuladas mostraron que las bacterias estaban muy empaquetadas y ordenadas en las formas impresas (Fig. 5B).
Se requiere motilidad en bacteriodetes para generar biopelículas iridiscentes.20,30. Las imágenes confocales de este estudio muestran la alineación entre las células que probablemente resulte de un flujo direccional de células en la superficie del agar combinado con interacciones de interfaz. Nuestra hipótesis es que los obstáculos en el camino de las células deslizantes alterarían la dirección del flujo celular y que esta dirección obstructiva podría dar como resultado un tipo de tinta bacteriana "autoimpresa". Para probar esta idea, se colocaron plantillas de papel en placas de agar nutritivo antes de agregar un inóculo adyacente al papel (Figs. 5C, figura complementaria. 9B) Durante la incubación, las células generaron rastros iridiscentes a lo largo de los bordes de las plantillas mediante un proceso que llamamos rastreo colectivo autónomo bacteriano (también conocido como "BACTracing"). El trazado BACT se produjo tanto en placas de agar al 1 % como en placas de agar al 1.5 %, sin embargo, la mayor concentración de agar dio lugar a trazas más estrechas. La temperatura también afecta la calidad de los patrones generados con BACTracing (Fig. 10). Se imprimieron patrones cada vez más complejos utilizando un pequeño número de sitios de inoculación, lo que sugiere que BACTracing puede ser un enfoque sencillo para la impresión avanzada de material vivo (Fig. 5MI).
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Automoción / vehículos eléctricos, Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- ChartPrime. Eleve su juego comercial con ChartPrime. Accede Aquí.
- Desplazamientos de bloque. Modernización de la propiedad de compensaciones ambientales. Accede Aquí.
- Fuente: https://www.nature.com/articles/s41598-023-38797-0