Estimado editor,
Las características biológicas únicas de los murciélagos, incluida la longevidad, las propiedades antivirales, la hibernación y la ecolocalización, han atraído una importante atención por parte de la comunidad científica. Para mejorar la utilización de murciélagos en experimentación biológica, los investigadores han realizado esfuerzos para generar células madre pluripotentes inducidas (iPSC) a partir de fibroblastos de murciélago.1,2. Sin embargo, sigue siendo incierto si las iPSC libres de transgenes pueden diferenciarse in vivo, lo que indica un alto grado de calidad de las células madre y amplía enormemente su potencial para diversas aplicaciones.
Para generar iPSC libres de transgenes, se utilizan fibroblastos embrionarios de murciélago (BEF) de Myotis lucifugo fueron transfectados con un conjunto de 8 factores de reprogramación (OCT4, SOX2, cMYC, KLF4, nanog, LIN28, NR5A2, Y un miR302/367 cluster) en el medio 3i/LIF que contiene inhibidores de moléculas pequeñas (PD0325901, CHIR99021 y A8301) (Fig. 1a, b). Después de la selección positiva (neomicina) y negativa (timidina quinasa) de iPSC, se seleccionaron células monoclonales para la detección de factores exógenos. Empleamos 20 conjuntos de pares de cebadores para amplificar la secuencia del plásmido.3. Los resultados mostraron que se obtuvieron dos clones de iPSC libres de transgenes (Fig. 1c).
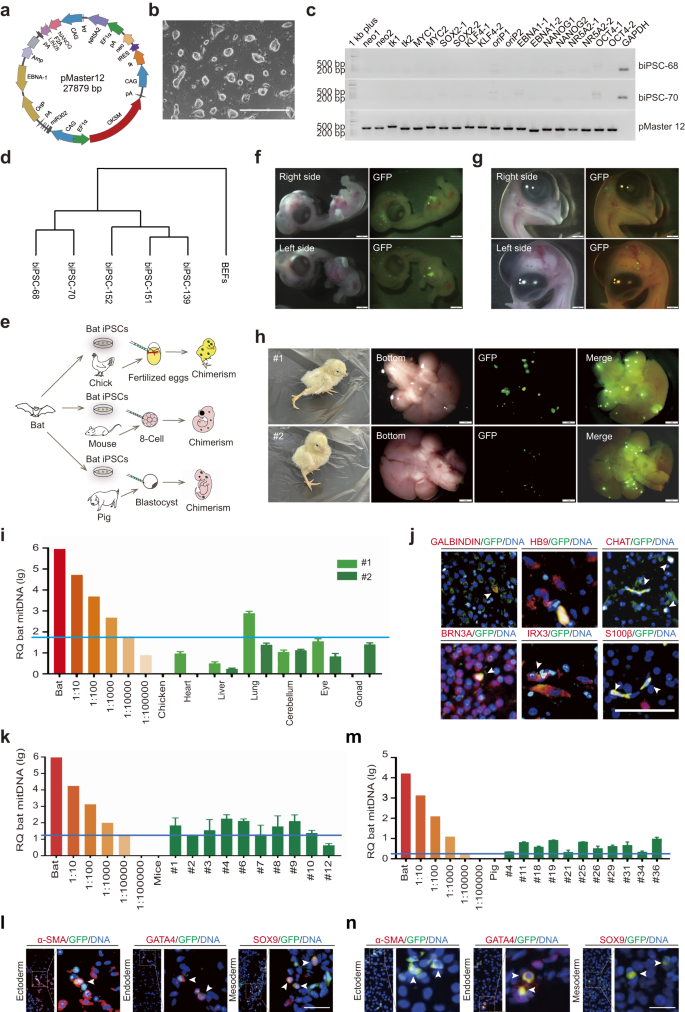
a Diagrama esquemático del vector inducible, pMaster12, que codifica 8 factores de reprogramación con genes de selección positiva/negativa. b Imagen de biPSC; barra de escala, 1000 µm. c El análisis por PCR confirmó la ausencia de secuencias del vector pMaster12 en biPSC-68 y biPSC-70. GAPDH se utilizó como gen de referencia interna y el ADN pMaster12 purificado sirvió como control positivo. d Agrupación de dendrogramas de perfiles de expresión génica: BEF, transgenes y biPSC libres de transgenes. e Modelo ilustrativo: las biPSC libres de transgenes generan quimeras entre especies (ratón, cerdo, polluelo) in vivo. f Imágenes representativas de embriones quiméricos de murciélago/pollo D6.5 con fluorescencia de GFP en la cabeza/pecho. Barras de escala, 1 mm. g Imágenes representativas de embriones quiméricos de murciélago/pollo D9.5 que muestran fluorescencia de GFP en la cabeza. Barras de escala, 1 mm. h Imágenes representativas de quimeras interespecies de murciélagos y polluelos nacidos vivos 3 días después del nacimiento, que muestran fluorescencia de GFP en la cabeza. Barras de escala, 1 mm. i Análisis cuantitativo por PCR genómica del ADNmt de murciélago en polluelos neonatales quiméricos (#1 y #2). Para el análisis se utilizaron diluciones de células de murciélago y polluelo. La línea azul representa el nivel de detección de ADNmt de murciélago (1 célula de murciélago por cada 10,000 células de polluelo). j Imágenes representativas de tinción IF de la cabeza de la quimera n.º 2 de murciélago/pollo, que muestran tinción positiva para marcadores neuronales (GALBINDIN, HB9, CHAT, BRN3A, IRX3, S100β). Las flechas blancas indican células positivas tanto para GFP como para marcadores neurales. Barras de escala, 50 μm. k Análisis cuantitativo por PCR genómico del ADNmt de murciélago en tejidos de embriones de ratón quimérico E8.5 utilizando diluciones de células de murciélago y ratón. La línea azul representa el nivel de detección de ADNmt de murciélago (1 célula de murciélago por cada 10,000 células de ratón). l Imágenes representativas de tinción IF que muestran la integración de biPSC que expresan GFP en capas germinales de ratón. Las flechas blancas indican células positivas tanto para GFP como para marcadores de linaje (α-SMA, GATA4, SOX9). Barra de escala, 50 µm. m Análisis cuantitativo por PCR genómico del ADNmt de murciélago en embriones porcinos quiméricos E25 utilizando diluciones de células de murciélago y cerdo. La línea azul representa el nivel de detección de ADNmt de murciélago (1 célula de murciélago por cada 10,000 células porcinas). n Imágenes representativas de tinción IF que muestran la integración de biPSC que expresan GFP en capas de germen de cerdo. Las flechas blancas indican células doblemente positivas para GFP y marcadores de linaje (α-SMA, GATA4, SOX9). Barra de escala, 50 µm.
Nuestras iPSC de murciélago (biPSC) expresaron marcadores de pluripotencia tanto a nivel de ARN como de proteína (Fig. S1a,b). Para confirmar la pluripotencia, transfectamos las biPSC con hOCT4–GFP y las células mostraron una expresión brillante de GFP (Fig. S1c), lo que indica el mantenimiento de la pluripotencia en biPSC. Las biPSC mostraron tinción positiva de fosfatasa alcalina (AP) y mantuvieron un cariotipo normal (42 + XY) después de 37 pases (Fig. S1d, mi). Podrían cultivarse en Matrigel en condiciones sin comederos (Figura complementaria. S2a-c). In vitro, las biPSC podrían formar cuerpos embrioides y luego diferenciarse en tres capas germinales embrionarias (Fig. S3a,b). El análisis de secuenciación de ARN reveló una agrupación distinta de expresión génica entre las biPSC y los BEF (Fig. 1d), con alta expresión de genes de pluripotencia en biPSC (Fig. S3c). Estos resultados sugieren que las biPSC no tienen transgenes y son pluripotentes.
Para evaluar el quimerismo y la capacidad de desarrollo de las biPSC, las etiquetamos con GFP/tdTomato (Fig. S4a-d) para el seguimiento de células. Se seleccionaron embriones de pollo como plataforma para estudios de quimerismo de células heterólogas debido a su facilidad de manipulación. Inyectamos 5×105 BiPSC marcadas con GFP en vasos sanguíneos de embriones de pollo fertilizados 52 h después de la eclosión (Fig. 1e). Para el día 6.5 (D6.5), se observó una fluorescencia verde significativa en la cabeza y el pecho de los embriones de pollo quiméricos (Fig. 1f), confirmado por tinción con GFP en secciones de parafina (Fig. S5a). La cotinción de secciones quiméricas de embriones de pollo con GFP y marcadores de la capa germinal confirmó la integración de biPSC diferenciadas en las tres capas germinales (Fig. S5b). En D9.5, la fluorescencia verde se limitó a la cabeza de los polluelos quiméricos (Fig. 1g).
Se obtuvieron dos polluelos quiméricos vivos después de la incubación y se observó una fluorescencia significativa de GFP en sus cerebros (Fig. 1h). Para determinar las proporciones quiméricas en otros órganos, realizamos análisis de ADN mitocondrial (ADNmt). Nuestros resultados indicaron un grado variable de quimerismo en diferentes tejidos, que van desde 1/100,000 a 1/1000. Detectamos la integración de células verdes en las gónadas de los polluelos quiméricos, un polluelo no mostró quimerismo y el otro exhibió menos de 1/10,000 quimerismo (Fig. 1i). Además, la tinción por inmunofluorescencia (IF) para secciones de parafina cerebral (#2) demostró la diferenciación de biPSC en varios tipos de células neuronales (Fig. 1j). Estos hallazgos sugieren que las biPSC pueden diferenciarse en células neuronales funcionales en el modelo quimérico de pollo.
Para examinar el potencial de formación de quimeras de las biPSC en dos modelos de mamíferos diferentes, ratones y cerdos, primero introdujimos 10 biPSC marcadas con GFP en embriones de ratón en una etapa de 8 a 16 células. Entre ellos, el 98.09% de los embriones inyectados exhibieron una fluorescencia GFP significativa, con un promedio de 17.78 ± 0.95 biPSC por blastocisto (Figura complementaria. S6a-c). Las biPSC se integraron en la masa celular interna (ICM) de los blastocistos quiméricos, con un promedio de 2.93 ± 0.37 células por ICM (Figura complementaria. S6d, mi). También evaluamos la integración de las biPSC en el trofectodermo del ratón, revelando su contribución tanto al ICM como al trofectodermo (Figura complementaria). S7a). En particular, las biPSC individuales exhibieron una proliferación robusta dentro de embriones de ratón, y el 31.25% de los embriones quiméricos mostraron proliferación unicelular (Figura complementaria. S7b y mesa S1). Además, la coinyección de biPSC marcadas con tdTomato y células madre embrionarias de ratón (mESC) marcadas con GFP dio como resultado una superposición espacial de señales de fluorescencia rojas y verdes (Figura complementaria. S7c), lo que sugiere un potencial de desarrollo compartido entre las biPSC y las mESC dentro del microambiente embrionario.
A continuación, evaluamos el potencial quimérico de las biPSC en embriones de ratón postimplantación (Fig. 1e). Implantamos 553 blastocistos quiméricos derivados de biPSC marcadas con GFP en 33 ratones sustitutos. Se produjeron embarazos exitosos y se recolectaron embriones quiméricos en el día embrionario 8.5 (E8.5). El quimerismo se confirmó mediante PCR genómica con cebadores específicos de murciélagos (Fig. S8a), y el análisis de ADNmt reveló altas proporciones de quimerismo en 8 de cada 10 fetos, y 3 de ellos excedieron 1/1000 (Fig. 1k). El ensayo IF en E10.5 mostró una expresión significativa de GFP en muestras quiméricas (Fig. S8b), con coexpresión de GFP y marcadores de linaje que indican la diferenciación de biPSC en las tres capas germinales en los embriones de ratón quiméricos (Fig. 1l). Nuestros hallazgos demuestran el notable potencial quimérico de las biPSC en embriones tempranos de ratón, aunque este potencial puede disminuir a medida que avanza el desarrollo del ratón y, por lo tanto, no logramos quimeras interespecíficas neonatales.
Luego exploramos el potencial quimérico de las biPSC en embriones porcinos. Se inyectaron biPSC marcadas con GFP en embriones partenogénicos porcinos E5. Entre los embriones inyectados, el 92.79% exhibió fluorescencia de GFP, con un promedio de 14.14 ± 1.14 biPSC por blastocisto (Fig. S9a-c). La tinción IF demostró la contribución de las biPSC al ICM, con un promedio de 3.78 ± 0.31 biPSC por ICM (Fig. S9d, mi). Estos resultados resaltan la viabilidad y la capacidad de integración de las biPSC en el ICM de embriones de cerdo tempranos.
También evaluamos el potencial quimérico de las biPSC en embriones porcinos postimplantación. Trasplantamos 610 blastocistos quiméricos fertilizados in vitro en 4 cerdas sustitutas. Las 4 madres sustitutas quedaron embarazadas, lo que resultó en un total de 39 embriones recolectados entre E25 y E27. El genotipado del ADNmt confirmó que 11 embriones eran quimeras, con un quimerismo de biPSC superior a 1/10,000 (Fig. 1m). La tinción IF con anticuerpo GFP en secciones de estos embriones quiméricos confirmó aún más la presencia de células de murciélago (Fig. S10). La tinción IF de marcadores de linaje demostró la diferenciación de biPSC en las tres capas germinales embrionarias dentro de los embriones quiméricos de cerdo (Fig. 1n). Estos hallazgos sugieren que las biPSC exhiben una mayor eficiencia quimérica en embriones porcinos tempranos y poseen la capacidad de diferenciarse en las tres capas germinales embrionarias in vivo.
En este estudio, observamos la integración exitosa de biPSC en embriones de ratón y cerdo previos a la implantación. Sin embargo, el quimerismo observado en embriones postimplantación fue limitado, lo que puede verse influenciado por factores como la distancia evolutiva, el período de gestación y la competencia celular. Estudios anteriores han demostrado que las ESC de rata y las iPSC de ratón no pudieron contribuir a los embriones de cerdo, y la contribución de las PSC humanas a los embriones postimplantación de cerdo fue muy limitada.4. Esta limitación puede atribuirse a la distancia evolutiva entre especies.5. La divergencia evolutiva entre murciélagos y ratones, que se estima ocurrió hace aproximadamente 94 y 81 millones de años (http://www.timetree.org/), respectivamente, pueden afectar significativamente la eficiencia del xenoquimerismo.
En este estudio, se observó la mayor proporción de quimerismo y la generación exitosa de polluelos quiméricos vivos cuando se inyectaron biPSC en embriones de pollo. Los pollitos quiméricos exhibieron diferenciación de biPSC en células funcionales en el sistema nervioso, lo que proporcionó información valiosa sobre el desarrollo y la diferenciación de biPSC en huéspedes heterólogos. El embrión de pollo es un modelo experimental bien establecido para xenoinjertos, que ofrece un sistema conveniente para estudiar el desarrollo y la diferenciación embrionaria.6. El embrión de pollo proporciona un sistema eficaz de evaluación del potencial de desarrollo in vivo de las xenocélulas, ya que estudios previos han demostrado la pluripotencia de las PSC humanas en embriones de pollo.7. La mayor eficiencia de la quimera murciélago/pollo puede deberse a un mayor número inicial de células inyectadas y a que el sistema inmunológico no está completamente desarrollado en los embriones de pollo.8, lo que resultó en una reducción del rechazo de células exógenas. El quimerismo gonadal limitado se debió a la inyección en una etapa de desarrollo más avanzada (HH14-HH15) en comparación con la etapa de blastocisto. Probar diferentes etapas, sitios y métodos de inyección en estudios futuros puede mejorar el resultado del quimerismo.
En general, generamos biPSC libres de transgenes mediante electroporación de plásmidos episomales. Estas biPSC exhibieron potencial quimérico en tres animales modelo. Las iPSC libres de transgenes son de mayor calidad, ya que no tienen sesgo de diferenciación de linaje celular y evitan el riesgo de formación de tumores y muerte en descendientes quiméricos.9,10,11. También pueden diferenciarse en un amplio espectro de tipos de células u organoides.12 bajo condiciones apropiadas. Nuestras biPSC tienen el potencial de diferenciarse en organoides relevantes in vitro, lo que permite investigaciones mecanicistas de la longevidad de los murciélagos, la defensa antiviral y la ecolocalización.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Automoción / vehículos eléctricos, Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- ChartPrime. Eleve su juego comercial con ChartPrime. Accede Aquí.
- Desplazamientos de bloque. Modernización de la propiedad de compensaciones ambientales. Accede Aquí.
- Fuente: https://www.nature.com/articles/s41421-023-00587-3