Los fibroblastos heterogéneos contribuyen al nuevo crecimiento de la cola de lagarto
Para investigar la complejidad y heterogeneidad de cada estado de regeneración durante el nuevo crecimiento de la cola, realizamos una secuenciación de ARN unicelular (scRNAseq) en muestras de cola en etapas del lagarto anolis verde. anolis carolinensis. Utilizando la plataforma scRNAseq de 10x Genomics, las muestras de cola se dividieron en uno de los cuatro grupos de muestras siguientes: cola original (día 0 después de la amputación, DPA), etapa inflamatoria (1, 3 y 7 DPA), etapa de blastema (14 y 21 días). DPA), o homeostasis regenerada (28 DPA). Las muestras de las etapas inflamatoria y blastema incluyeron múltiples puntos de tiempo de muestra para garantizar la coherencia entre los grupos de muestra considerando la variabilidad inherente en la regeneración de la cola entre individuos.41. Además de rastrear el DPA de la muestra, se evaluaron las muestras para determinar su morfología y fenotipos característicos de la etapa de regeneración.42, lo que da como resultado múltiples puntos de tiempo utilizados en las etapas inflamatorias y de blastema (los fenotipos/morfologías detallados para cada etapa de la cola se describen en Métodos). Los resultados de la secuenciación se analizaron utilizando el 10x Genomics Cell Ranger43 paquetes de pipeline y R Seurat44 y Armonía45.
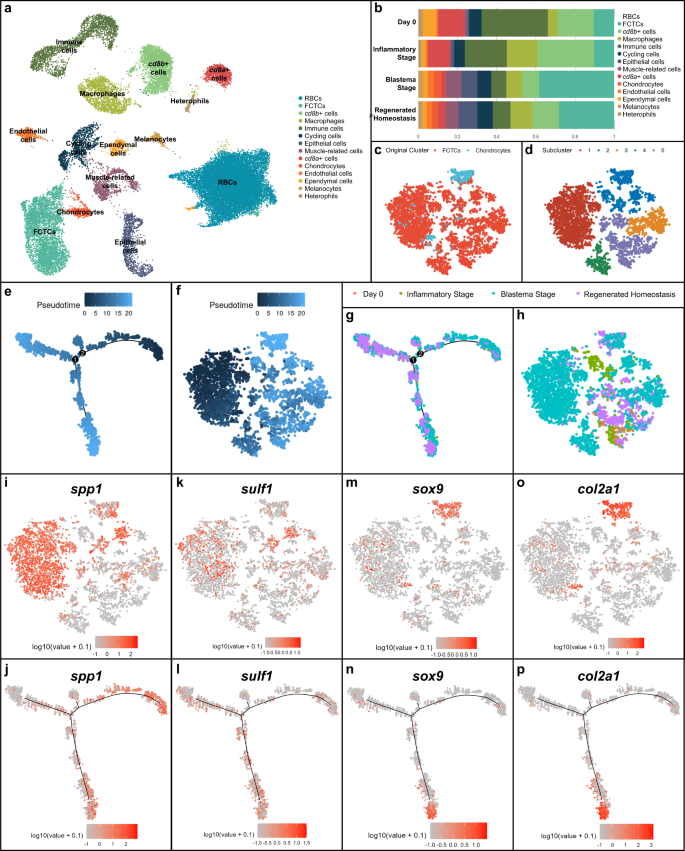
La agrupación UMAP no supervisada del curso del tiempo de regeneración reveló 14 grupos de células distintas (Fig. 1a). Se analizaron los grupos para detectar los principales genes expresados diferencialmente y los tipos de células clave se validaron mediante hibridación in situ (ISH) e histología para la expresión de genes tisulares correspondientes en muestras de cola en regeneración (Fig. 1). Se identificaron varios grupos de células inmunes y sanguíneas, incluida la catepsina B (ctsb+) macrófagos9, grupos delineados por altos niveles de subunidad A CD8 (cd8a+) y subunidad CD8 B (cd8b+) expresión y glóbulos rojos nucleados. Queratina tipo II citoesquelética 5 (krt5+) células epiteliales, factor von Willebrand (vwf+) células endoteliales, proteína fijadora de ácidos grasos 7 (fabp7+) células ependimarias46, células en ciclo caracterizadas por un alto marcador de proliferación Ki-67 (mki67) expresión, creatina quinasa tipo M (ametralladora pesada+) células relacionadas con los músculos15, proteína premelanosoma (pmel+) melanocitos, factor de transcripción SRY-box 9 (sox9+) condrocitos47, y cadena alfa 1 de colágeno tipo I (col1a1+) también se identificaron grupos de células de tejido conectivo fibroblástico (FCTC) mediante análisis diferencial de expresión génica e identificación de ortólogos de mamíferos.
a UMAP de agrupación no supervisada de resultados de secuenciación de ARN unicelular (scRNAseq) para lagarto (anolis carolinensis) curso temporal de regeneración de la cola compuesto por muestras de cola de lagarto del día 0 ileso (0 días después de la amputación o DPA), etapa inflamatoria (1, 3 y 7 DPA), etapa de blastema (14 y 21 DPA) y homeostasis regenerada (28 DPA) . b Cuantificación de las proporciones relativas de la composición del tipo celular por etapa de la muestra de la cola, excluyendo los glóbulos rojos. c TSNE de células de tejido conectivo fibroblástico (FCTC) y condrocitos aislados, integrados y subagrupados del conjunto de datos scRNAseq en (a). d TSNE de agrupación no supervisada de FCTC y subconjunto de células de condrocitos. e Análisis de trayectoria en pseudotiempo de Monocle2 para FCTC y subconjunto de células scRNAseq de condrocitos de (c). f Pseudotiempo superpuesto al subgrupo de células de condrocitos/TSNE FCTC. g Punto de tiempo de regeneración superpuesto en la trayectoria pseudotemporal para el subconjunto FCTC/condrocitos. h FCTC/TSNE de condrocitos analizados por punto de tiempo de regeneración. i, j Spp1, k, l sulf1, m, n sox9y o, p col2a1 expresión génica en la trayectoria pseudotemporal del subgrupo TSNE de FCTC/condrocitos y del subgrupo de condrocitos/FCTC, respectivamente.
Cuando se analiza por etapa de regeneración, las contribuciones proporcionales de cada tipo de célula en comparación con el total de células en la muestra (Fig. 1b) reveló una gran expansión en la población de FCTC en la etapa de blastema, similar al análisis scRNAseq de ajolote mencionado anteriormente36. Este grupo de CMCT estaba estrechamente asociado con el grupo de células de condrocitos, los precursores esqueléticos para la regeneración de la cola de lagarto. Las contribuciones proporcionales del tipo de célula se validaron mediante ISH fluorescente (FISH) utilizando genes marcadores que definen grupos (Fig. 2), lo que representa un aumento significativo en los CMCT de 14 DPA en comparación con los de 0 y 7 DPA. Dada la expansión de los FCTC en la etapa de blastema y su estrecha agrupación con los condrocitos, el grupo FCTC y el grupo de condrocitos se aislaron, integraron computacionalmente y se subagruparon (Fig. 1c, d) para determinar si existían poblaciones distintas de fibroblastos dentro del grupo FCTC y revelar posibles firmas genéticas que condujeran al potencial condrogénico del FCTC.
Análisis de trayectoria en pseudotiempo, un método computacional utilizado para inferir transiciones biológicas o relaciones de linaje celular basadas en perfiles de expresión del gen scRNAseq48, se realizó en el subgrupo FCTC/condrocitos (Fig. 1e,f) usando el paquete R Monocle249,50,51 y reveló un punto de ramificación menor y dos principales del posible cambio en la trayectoria del destino celular durante el curso de la regeneración. Al analizar por punto de tiempo de regeneración (Fig. 1g, h y Fig. Suplementaria. 3), las poblaciones de células del pseudotiempo anterior se correspondían principalmente con poblaciones de células en etapa de blastema, mientras que los puntos de ramificación del pseudotiempo posteriores estaban dominados por la homeostasis regenerada y las células de la cola originales, lo que sugiere que la etapa de blastema y el pseudotiempo temprano representan un tipo de célula menos diferenciada terminalmente y más plástica, mientras que la homeostática regenerada las células en el pseudotiempo tardío pueden tener un destino celular más restringido/definido.
Un análisis más detallado de los genes expresados diferencialmente (DEG) en el subgrupo FCTC/condrocitos reveló altos niveles de osteopontina, también conocida como fosfoproteína 1 secretada (spp1), expresión (Fig. 1i,j), particularmente en el subgrupo 1 del conjunto de datos FCTC/condrocitos, dentro de la muestra de etapa de blastema y pseudotiempo temprano. Spp1 Se describió por primera vez por su papel en la mineralización ósea y el depósito de matriz extracelular.52, pero un trabajo más reciente sugiere spp1 Puede actuar como una citocina y desempeñar un papel en la respuesta a las lesiones.53,54,55,56. Por ejemplo, spp1 ha sido implicado en la modulación de la señalización de las vías Wnt y Hedgehog (Hh)57,58 y puede ayudar a que poblaciones de células críticas sobrevivan en entornos de heridas debido a actividades antiapoptóticas59.
Sulfatasa 1 (sulf1) expresión (fig. 1k, yo) abarcó blastema y puntos de tiempo regenerados, así como la mayor parte del pseudotiempo, con expresiones que varían en el pseudotiempo temprano, medio y tardío. Como sulfato de heparina 6-O-endosulfatasa que elimina selectivamente los grupos 6-O-sulfato de los proteoglicanos de sulfato de heparina (HSPG), sulf1 La actividad enzimática modula la unión y la señalización posterior de muchos receptores HSPG para factores de crecimiento y citocinas que se unen a heparina.60,61. Se ha demostrado que las endosulfatasas son necesarias para activar la señalización de Wnt y BMP durante la esqueléticagénesis de mamíferos y aves y para amortiguar la señalización de FGF.61,62,63, mientras sulf1 También se ha demostrado específicamente que modula la señalización de Hh mejorando el erizo sónico local (shh) concentraciones y disponibilidad64.
Marcadores de condrocitos sox9 (Higo. 1m, norte) y cadena alfa 1 de colágeno tipo II (col2a1)15 (Higo. 1o, pág.) se concentraron en gran medida en el subgrupo 2, en células homeostáticas regeneradas, y se expresaron específicamente en la rama inferior del pseudotiempo tardío. Por lo tanto, la rama derecha de la trayectoria pseudotemporal temprana estuvo dominada por spp1+ Los fibroblastos en etapa de blastema y la rama inferior del pseudotiempo tardío representaron más diferenciados. sox9+ Condrocitos en regeneración y diferenciados terminalmente. col2a1+ cartílago en homeostasis regenerada. Proteína de transferencia de fosfolípidos DEG (pltp) y spalt como factor de transcripción 1 (sal1) También se analizaron mediante análisis de trayectoria en pseudotiempo (Fig. 4) pero no reveló patrones de expresión distintos que correlacionaran el pseudotiempo con etapas de regeneración específicas.
En conjunto, el análisis de la trayectoria en pseudotiempo sugirió que los fibroblastos adquirieron la expresión del gen marcador FCTC durante el transcurso de la regeneración, lo que eventualmente condujo a una capacidad condrogénica potencial y al destino de las células de los condrocitos. Muchos CMCT sobre blastema expresan spp1. Algunos, pero no todos, de esos fibroblastos pueden llegar a expresar sulf1 a medida que continúan a lo largo del proceso de regeneración de la cola, y más tarde, pueden convertirse sox9+ condrocitos y forma col2a1+ cartílago. Este estudio de scRNAseq representa un análisis crítico del curso temporal de la regeneración de la cola de lagarto y, a través de una trayectoria pseudotemporal, propone una relación potencial entre la expresión del gen marcador FCTC y la condrogénesis del FCTC de blastema, que se investiga más adelante.
Los blastemas de cola de lagarto consisten en CMCT
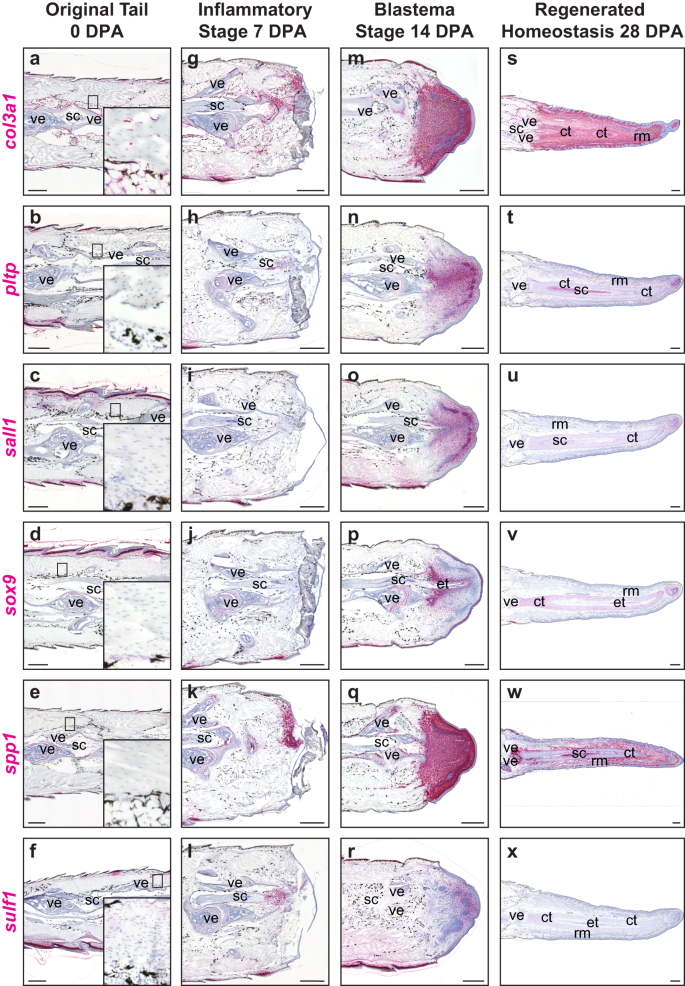
Utilizando el análisis de datos unicelulares, se identificaron varios genes de fibroblastos con regulación positiva diferencial dentro del grupo de FCTC, muchos de ellos con implicaciones en otros organismos para la condensación del mesénquima, la formación de cartílago y las funciones de remodelación y deposición ósea.52,65,66. Estos genes marcadores FCTC se tiñeron para su expresión durante la regeneración de la cola, revelando cambios en los patrones de expresión del gen de los fibroblastos de manera espaciotemporal (Fig. 2 y Fig. Suplementaria. 5). En las colas originales ilesas, la cadena alfa 1 de colágeno tipo III (co13a1+) FCTC homeostáticos recubren el periostio, el pericondrio, la epidermis y otros tejidos conectivos (Fig. 2a–f), y muchos CMCT también expresan niveles bajos de cadherina 11 (cdh11), (Figura complementaria. 5a-e), como se informó anteriormente67. Hacia el día 7 DPA, se activaron varios genes de fibroblastos adicionales en comparación con el día 0 DPA y se relocalizaron desde las vértebras terminales hasta los sitios de la herida distal. Estos CMCT en estados de lesión exhibieron niveles elevados spp1 (Higo. 2k), tanto como col3a1 (Higo. 2g), cdh11, colágeno tipo XII cadena alfa 1 (col12a1), midkine (mdk), proteína secretada ácida y rica en cisteína (sparc), y similar a la tenascina (tnl) expresión (Fig. 5f–j). sulf1 comenzó a localizarse en regiones adyacentes a médulas espinales amputadas (Fig. 2l), mientras que la proteína de transferencia de fosfolípidos (pltp), spalt como factor de transcripción 1 (sal1)y sox9 (Higo. 2 h – j) exhibió poca o ninguna expresión 7 DPA.
Secciones sagitales representativas del lagarto original y en regeneración (carolinensis) muestras de cola analizadas mediante hibridación in situ RNAscope™. a–f Colas originales (0 DPA) con inserción ampliada de fibroblastos homeostáticos, g–l etapa inflamatoria colas 7 DPA, m–r etapa de blastema colas 14 DPA, y s–x colas de etapa de homeostasis regenerada 28 DPA analizadas para col3a1, pltp, sall1, sox9, spp1y sulf1. n = 5 animales/muestras por momento. ct tubo de cartílago, tubo ependimario, músculo regenerado rm, médula espinal sc, vértebra. Barra = 500 µm.
Durante la formación del blastema, el 14 DPA, los FCTC se agregaron en las puntas distales de la cola y aumentaron la expresión de varios genes marcadores. Extenso sparc La expresión se observó en todos los blastemas, incluidos los haces de músculos en regeneración (Fig. 5n), mientras col3a1, spp1, col12a1, mdky tnl etiquetó todo el tejido blastémico recién formado, pero con una expresión notablemente menor en los haces de músculos en regeneración (Fig. 2m,q y Fig. Suplementaria. 5l, m, o). Varios marcadores del FCTC exhibieron patrones de expresión más localizados dentro de los blastemas de la cola. medias9 expresión, el gen marcador conservado del potencial condrogénico y la regeneración del cartílago en lagartos47, mesénquima procondrogénico marcado que se condensa alrededor de las médulas espinales regeneradas centrales y exhibe una expresión medial alta a una expresión lateral baja y organizaciones proximales (altas) a distales (bajas) (Fig. 2p). El mesénquima condrogénico condensado también fue etiquetado por pltp, sal1, sulf1y cdh11 expresión (fig. 2n, o, r y Fig. Suplementaria. 5k). sulf1 también etiquetó poblaciones de FCTC en las puntas distales del blastema, que exhiben organizaciones de medial a lateral y proximodistal, inversas a las de sox9 (Higo. 2r).
A los 28 DPA, el tejido conectivo regenerado mantuvo una alta expresión de spp1, cdh11, mdky tnl, pero estos marcadores fueron en gran medida excluidos de los elementos diferenciados de músculos y cartílagos (Fig. 2w y Fig. Suplementaria. 5p,r,t). col12a1 y sparc se expresaron altamente en tejidos conectivos y cartílago regenerado, pero específicamente excluidos de los haces de músculos regenerados (Fig. 5q,s). Solo col3a1 mantuvo una alta expresión en poblaciones de FCTC en cada etapa de regeneración de 0 a 28 DPA en tejidos conectivos dentro de la epidermis, haces de músculos, elementos cartilaginosos e intersticio (Fig. 2s). medias9 La expresión marcó específicamente los tubos del cartílago y disminuyó proximodistalmente (Fig. 2v). pltp y sal1 se expresaron más en forma medial, rodeando los tubos cartilaginosos y distalmente en las puntas de la cola, pero se perdieron en gran medida en otros tejidos conectivos (Fig. 2t, tu). sulf1 La expresión estuvo notablemente ausente el 28 DPA, y solo permaneció una expresión mínima en los tubos del cartílago (Fig. 2x). En general, las colas regeneradas 14 y 28 DPA estuvieron dominadas por poblaciones FCTC a pesar de sus nichos relativamente pequeños y restringidos dentro de las colas originales (0 DPA), mientras que varios genes FCTC se activaron durante el estado de lesión de la regeneración de la cola 7 DPA.
sulf1 + CMCT de blastema estimulados por cartílago de forma Hh
Los resultados de ScRNAseq descritos anteriormente indicaron distintos grupos de FCTC de cartílago y blastema, y estudios previos de nuestro laboratorio han identificado la señalización de Hh aportada por el epéndima como la señal crítica para inducir la formación de cartílago de blastema.14. Se utilizaron agentes farmacológicos para probar los efectos de la inhibición y activación de Hh sobre la condrogénesis de las células de blastema (Fig. 6). Los lagartos fueron tratados con el inhibidor de Hh ciclopamina, un agonista suavizado de Hh (SAG) o un vehículo de control durante 28 días. Luego se recolectaron y analizaron las colas según su morfología general (Figura complementaria). 6a – c) e histología/FISH para la expresión de col2a1, un marcador de diferenciación del cartílago maduro, shh, la señal Hh predominante dentro de las colas regeneradas, y fabp7, un marcador de células ependimarias (Fig. 6d–l).
Los lagartos tratados con control de vehículos desarrollaron colas regeneradas típicas con forma cilíndrica. col2a1+ tubos de cartílago que rodean shh+ fabp7+ tubos ependimarios (Fig. 6a, d, g, h). A los lagartos tratados con ciclopamina les volvieron a crecer colas de longitud normal, pero carecían por completo de cartílago a pesar del mantenimiento de shh expresión por tubos ependimarios (Fig. 6b, e, i, j). Por el contrario, el tratamiento con SAG resultó en colas bulbosas y atrofiadas llenas de abundante col2a1+ regiones de cartílago ectópico además de los tubos de cartílago endógeno (Fig. 6c, f, k, l). No se produjo ni la inhibición ni la activación de Hh. shh expresión por fabp7+ células ependimarias (Fig. 6 h, j, l), lo que indica que los cambios en la condrogénesis del FCTC del blastema fueron el resultado directo de los tratamientos farmacológicos. El cartílago inducido por SAG no se observó en ningún otro lugar del lagarto y fue específico de las regiones de la cola derivadas del blastema. Estos resultados sugirieron que la señalización de Hh es necesaria y suficiente para inducir la condrogénesis en los FCTC de blastema y que una gran parte de las células de blastema son capaces de diferenciar el cartílago. Las señales exógenas de Hh del tratamiento con SAG extienden las áreas procondrogénicas más allá de las regiones que normalmente forman cartílago en respuesta a la señalización endógena.
A continuación, se compararon los efectos de los activadores/inhibidores de Hh sobre la expresión genética de los FCTC de las extremidades y la cola de los lagartos y el potencial condrogénico. Se recogieron colas y extremidades de lagarto el 28 DPA de animales tratados con ciclopamina, SAG o control de vehículo y se analizaron mediante histología/ISH para determinar col2a1, spp1, y dedo de zinc de la familia GLI 1 (gli1) expresión (Fig. 7). Como se describió anteriormente, se desarrollaron colas de control. col2a1+ tubos cartilaginosos. El desarrollo del tubo de cartílago fue inhibido por el tratamiento con ciclopamina y expandido por el tratamiento con SAG, lo que resultó en una formación extensa de cartílago ectópico (Fig. 7a, g, m). Se mantienen los CMTC de cola spp1 expresión 28 DPA, y la expresión no se vio afectada por el tratamiento con ciclopamina o SAG (Fig. 7b,h,n).
En contraste directo con las células de blastema de la cola, los fibroblastos de las extremidades no expresaron col2a1 o sufrir condrogénesis en cualquiera de las condiciones probadas (Fig. 7d – f, j – l, p – r). Específicamente, no se formó cartílago ectópico en los grupos tratados con SAG (Fig. 7p). Además, el CMCT spp1 La expresión no se mantuvo el 28 DPA y no fue sensible a la señalización de Hh (Fig. 7e,k,q). Gli1, un informador posterior de la vía de señalización de Hh y una lectura establecida de la activación de la vía de Hh68, se expresó de forma nativa en las colas de control (Fig. 7c), mientras que la expresión estuvo ausente en las extremidades de control (Fig. 7f) y en muestras de tratamiento con ciclopamina con inhibidor de Hh de las extremidades y la cola (Fig. 7i,l). La cola y las extremidades tratadas con SAG exhibieron altos niveles de gli1 activación (Fig. 7°,r), validando el tratamiento con SAG como activador de la vía Hh tanto en la cola como en las extremidades. Estos resultados indicaron que, a diferencia de los FCTC blastémicos de la cola, los fibroblastos de miembros amputados carecían de potencial condrogénico sensible a Hh, a pesar de la evidencia de una activación suficiente de la vía de Hh con el tratamiento con SAG.
Se identificaron los resultados de la secuenciación unicelular descritos anteriormente sulf1, pltp, sal1y spp1 como marcadores de blastema FCTC de cola de lagarto. sulf1 Se informa que está regulado por la estimulación Hh en otros sistemas.60,64,69, y aquí, probamos los efectos de la inhibición y activación de Hh en la expresión del marcador de blastema de la cola (Fig. 3). En los análisis se incluyeron extremidades de lagarto amputadas, que no forman blastemas de forma natural, para distinguir los marcadores específicos del blastema de las respuestas curativas no específicas.8,70,71,72 (Higo. 3m–x). Se recolectaron muestras de blastema de cola y extremidades el 14 DPA de los mismos lagartos tratados con ciclopamina, SAG o control de vehículo y se analizaron mediante histología/ISH para determinar sulf1, pltp, sal1y spp1 para proporcionar contexto para cualquier dependencia de señalización de Hh observada entre los patrones de expresión de marcadores.
Secciones sagitales representativas de Alabama cola y m–x muestras de extremidades recolectadas de lagartos (carolinensis) 14 DPA tratados con a–d, m–p control de vehículos, e–h, q–t Ciclopamina inhibidora de Hedgehog y i–l, u–x Agonista suavizado de Hedgehog, SAG, y analizado por histología/ISH para sulf1, spp1, pltpy sal1. n = 5 lagartos por condición de tratamiento. et tubo ependimario, sc médula espinal, tb tibia, ve vértebra. Barra = 500 µm.
Controlar los blastemas de la cola expresados. sulf1, spp1, pltpy sal1 (Higo. 3a–d). spp1 se expresó en niveles altos en todos los blastemas, mientras que pltp y sal1 se expresaron en niveles relativamente más bajos (Fig. 3b–d). sulf1 exhibió el patrón de expresión más definido, localizándose en áreas que rodean los tubos ependimarios, especialmente blastemas apicales y condensaciones de tubos precartílagos (Fig. 3a). El tratamiento con ciclopamina redujo significativamente el blastema en la cola sulf1 expresión (fig. 3e) pero no afectó a otros marcadores probados (Fig. 3f-h). Por el contrario, el tratamiento con SAG resultó en un aumento y expansión sulf1+ áreas de blastema (Fig. 3i), especialmente en las áreas dorsal y proximal del blastema, pero no afectó spp1, pltpo sal1 expresión (fig. 3j–l).
Los CMCT de miembros amputados expresaron altos niveles de spp1 (Higo. 3n), Pero sulf1, pltpy sal1 estuvieron ausentes de las extremidades en condiciones de control (Fig. 3m, o, p). La expresión de los marcadores genéticos analizados no se vio afectada ni por los tratamientos con ciclopamina ni con SAG en las extremidades (Fig. 3q-x) y, a diferencia de las células de blastema de la cola, los FCTC de miembros amputados no aumentaron sulf1 expresión en respuesta al tratamiento con SAG (Fig. 3u). Estos resultados se confirmaron cuantitativamente mediante análisis de reacción en cadena de la polimerasa (RT-PCR) en tiempo real de muestras de cola 14 DPA para sulf1, spp1, pltp y sal1 (Fig. complementaria. 8). En conjunto, estos resultados identificaron sulf1, pltpy sal1 como marcadores específicos de blastema. sulf1 fue el único marcador de blastema probado que respondió particularmente a la estimulación e inhibición de Hh. Spp1 Se confirmó además como un marcador general de FCTC en estado de lesión estimulados por la cicatrización de heridas.
sulf1 marca los FCTC de blastema con potencial condrogénico
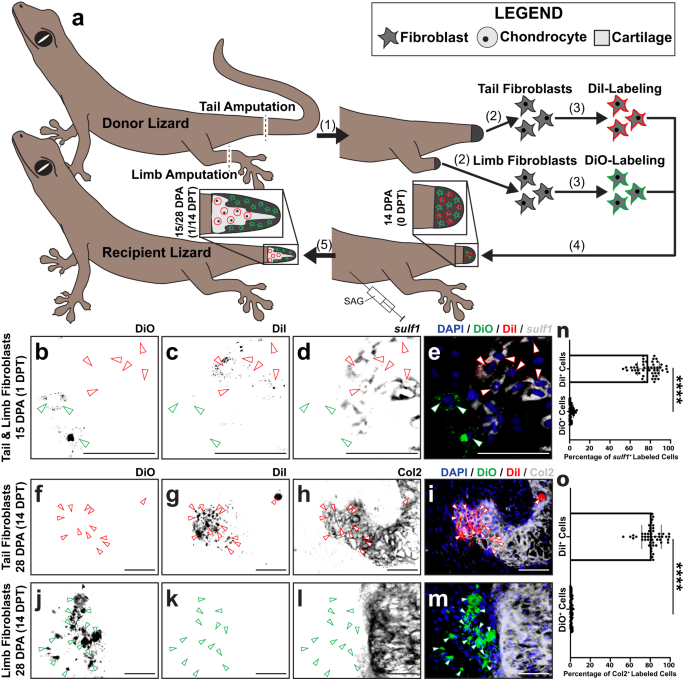
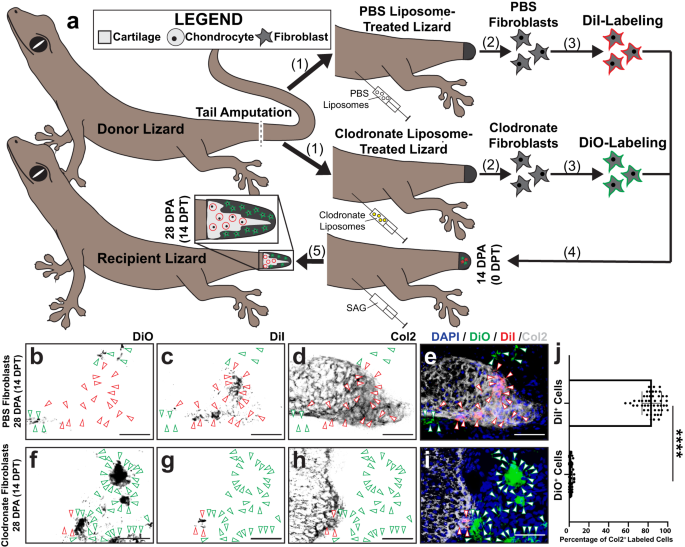
A continuación, evaluamos la capacidad condrogénica de los FCTC de etapas específicas de regeneración de la cola, para determinar qué FCTC eran competentes para formar cartílago, independientemente de la señalización ambiental local de la cola in vivo, utilizando un modelo de trasplante previamente establecido para rastrear el destino de las células durante la regeneración de la cola del lagarto.73. Células recolectadas del lagarto partenogenético. Lepidodactylus lugubris reconstituir estructuras regeneradas tras el trasplante en muñones de cola amputados de lagartos pertenecientes a la misma población clonal sin necesidad de tratamientos con fármacos inmunosupresores74, previamente demostrado que impacta negativamente en la regeneración24,75,76 (Higo. 4). Se aislaron fibroblastos del donante. L. lugubris colas originales, colas de blastema 14 DPA y colas regeneradas 28 DPA, y los grupos de células aisladas resultantes se enriquecieron para poblaciones FCTC usando digestión celular física y enzimática, así como tratamientos con perlas MACS® (Figura complementaria. 9). Cada conjunto del FCTC se marcó con DiI y se inyectó, por separado, en colas de blastema receptores tratados con SAG durante 14 DPA. 14 días después del trasplante (14 DPT, lagartos receptores 28 DPA), se analizaron las colas de los receptores para detectar Col2 mediante tinción por inmunofluorescencia (IF) (Fig. 4a). Ni los fibroblastos de cola originales ni los regenerados se incorporaron a Col2+ cartílago a los 28 DPA (Fig. 4b-d, h-k), mientras que la mayoría de los fibroblastos de blastema trasplantados tiñeron conjuntamente la etiqueta DiI y la expresión de Col2, incorporándose a los elementos del cartílago a un ritmo significativamente mayor que los fibroblastos de cola originales y regenerados (Fig. 4e-g, k). Esto sugirió que los fibroblastos de blastema eran excepcionalmente competentes para formar cartílago en respuesta a la estimulación Hh, en comparación con los fibroblastos homeostáticos originales y regenerados de la cola.
a Esquema experimental para Lepidodactylus lugubris Trasplantes de fibroblastos de cola. (1) Se amputan las colas de los lagartos donantes. Los FCTC se aíslan de colas originales (0 DPA), colas de blastema (14 DPA) y colas regeneradas (28 DPA). (2) Cada grupo final del FCTC está etiquetado con DiI fluorescente, por separado. (3) Los grupos FCTC etiquetados se trasplantan en blastemas de cola (14 DPA) de lagartos receptores tratados con SAG, por separado. (4) Después de 14 días de tratamiento con SAG después del trasplante (14 DPT), las colas regeneradas se analizan mediante tinción por inmunofluorescencia (IF) con Col2 y microscopía de fluorescencia. b–j Análisis histológico y fluorescente representativo de colas regeneradas por lagartos tratados con SAG preinyectados con FCTC de cola marcados con DiI derivados de (b–d) cola original, e–g colas de blastema, o h–j colas regeneradas, analizadas por Col2 IF 14 DPT/28 DPA. Las señales DiI y Col2 se presentan por separado y juntas para resaltar la colocalización o la falta de ella. Las puntas de flecha verdes indican DiI+ células. Barra = 50 µm. k Cuantificación de células marcadas con DiI incorporadas dentro de Col2+ regiones del cartílago 14 DPT. n = 50 recuentos de células medidos a partir de cinco imágenes entre 10 animales/muestras de cola diferentes para cada condición. Los datos se presentan como valores medios +/− desviación estándar. Se utilizó el ANOVA unidireccional de Welch para varianzas desiguales y la prueba de comparaciones múltiples T3 de Dunnett. ****equilibrado P < 0.0001 (pruebas de comparaciones múltiples T3 de Dunnett). Los datos de origen se proporcionan como un archivo de datos de origen.
Trabajos anteriores han indicado que la señalización de Hh regula la condrogénesis del blastema de lagarto.14y sulf1 Se informa que se expresa en el mesénquima precondensado durante la condrogénesis.77, 78. Aquí, probamos la co-localización de sulf1 sox9, el factor de transcripción que regula la condrogénesis, dentro de los blastemas de cola de lagarto 14 DPA en respuesta al tratamiento con ciclopamina, SAG y control de vehículo. (Figura complementaria. 10). Los blastemas de la cola de control exhibieron gradientes proximodistales de sulf1 y sox9 expresión en FCTC que rodean los tubos ependimarios (Fig. 10a, b). sulf1 expresión localizada en las regiones distales del blastema apical y reducida proximalmente a medida que fue reemplazada por sox9. medias9 exhibió su expresión más fuerte en elementos esqueléticos proximales adyacentes a las vértebras de la cola originales en los planos de amputación. El tratamiento con ciclopamina redujo ambos sulf1 y sox9 expresión y localizaciones interrumpidas de marcadores proximodistales (Fig. 10c, d). En las colas tratadas con SAG, ambas sulf1+ y sox9+ Las áreas se expandieron periféricamente hacia regiones extraídas de los tubos ependimarios, pero las relaciones de expresión proximodistal se mantuvieron (Fig. 10e,f).
Los resultados anteriores sugirieron una relación entre la señalización Hh, sulf1 expresión y condrogénesis. Aquí, probamos esta relación comparando las habilidades de sulf1+ y sulf1- fibroblastos de lagarto para experimentar condrogénesis in vivo usando el L. lugubris modelo de trasplante (Fig. 11). Primero, los FCTC de cola y extremidades originales del donante (0 DPA) se marcaron previamente con los tintes fluorescentes DiI y DiO, respectivamente. Los FCTC de cola y extremidades etiquetados se mezclaron y se cotrasplantaron en colas de lagarto receptor en el momento de la amputación de la cola del lagarto receptor (0 DPA). Los lagartos receptores fueron tratados con SAG y se recolectaron las colas 14 y 28 DPT para la evaluación de la integración (Fig. 11a). FISH y el análisis histológico de 14 muestras de DPT mostraron DiI+ cola y DiO+ fibroblastos derivados de extremidades expresados sulf1 (Fig. complementaria. 11b–e,j). De manera similar, tanto DiI+ y DiO+ Los fibroblastos formaron Col2.+ cartílago en 28 muestras de DPT evaluadas por IF (Figura complementaria. 11f–yo, k). Estos resultados sugirieron que tanto los fibroblastos de la cola como los de las extremidades poseen la capacidad de sulf1 expresión y condrogénesis cuando se exponen al proceso de formación de blastema y al nicho de señalización.
Finalmente, comparamos los resultados anteriores con los observados cuando se trasplantaron FCTC de extremidades y blastema de cola exógenos a colas de receptores que ya habían formado blastemas. Fibroblastos aislados de donante L. lugubris Los blastemas de la cola y las extremidades 14 DPA, preetiquetados con DiI y DiO, respectivamente, se trasplantaron conjuntamente en blastemas de la cola de lagarto receptores tratados con SAG (Fig. 5). Las colas se recolectaron 1 y 14 DPT y se analizaron como se describe anteriormente para comparar porcentajes de blastema exógeno de la cola y fibroblastos de las extremidades que expresaban sulf1 vía FISH o Col2 vía IF (Fig. 5a).
a Esquema experimental para L. lugubris blastema de cola y trasplantes de fibroblastos de miembros amputados. (1) Se amputan las colas de lagarto donante y las extremidades traseras izquierdas. (2) Los FCTC se aíslan de blastemas de la cola y muñones de las extremidades el 14 DPA. (3) Los FCTC de la cola están etiquetados con DiI, mientras que los FCTC de las extremidades están etiquetados con DiO. (4) Los FCTC marcados se cotrasplantan en blastemas de cola (14 DPA) de lagartos receptores tratados con SAG. (5) Después de 1 y 14 días de tratamiento con SAG después del trasplante, las colas regeneradas se analizan mediante sulf1 FISH, Col2 IF y microscopía de fluorescencia. b–m Análisis histológico y fluorescente representativo de colas regeneradas por lagartos tratados con SAG preinyectados con FCTC de cola marcados con DiI y FCTC de extremidades marcados con DiO, analizados por b–e sulf1 FISH 1 día postrasplante (DPT)/15 DPA y f–m Col2 SI 14 DPT/28 DPA. DiI, DiO y sulf1 o las señales Col2 se presentan por separado y juntas para resaltar la co-localización o la falta de la misma. Las puntas de flecha rojas marcan DiI+ celdas y puntas de flecha verdes indican DiO+ células. Barra = 50 µm. n, o Cuantificación de células marcadas con DiI y DiO (n) coexpresando sulf1 1 TED y o incorporado dentro de Col2+ regiones del cartílago 14 DPT. n = 50 recuentos de células medidos a partir de cinco imágenes entre diez animales/muestras de cola diferentes para cada condición. Los datos se presentan como valores medios +/− desviación estándar. Bidireccional no emparejado t Se utilizaron pruebas con corrección de Welch para varianzas desiguales. ****P < 0.0001. Los datos de origen se proporcionan como un archivo de datos de origen.
En muestras de 1 DPT, DiI+ fibroblastos derivados del blastema de la cola colocalizados con sulf1 expresión, mientras que DiO+ los fibroblastos derivados de extremidades no lo hicieron (Fig. 5b–e, norte). 14 muestras de DPT analizadas mediante IF para la expresión de Col2 revelaron porcentajes significativamente más altos de FCTC de blastema de cola que forman Col2+ cartílago que los fibroblastos de las extremidades (Fig. 5f–o). Los fibroblastos de la cola y las extremidades también se trasplantaron por separado en blastemas receptores tratados con control de vehículo o tratados con SAG como controles (Fig. 12). Sólo los fibroblastos de la cola estimulados por SAG coexpresaron DiI y Col2 (Fig. 12d–f, metro), mientras que los FCTC de cola y extremidades trasplantados a receptores de control de vehículos y los fibroblastos de extremidades trasplantados a blastemas receptores tratados con SAG no expresaron Col2 ni formaron cartílago (Fig. 12a – c, g – m). En conjunto, estos resultados confirmaron las capacidades de sulf1+ CMCT de blastema, pero no sulf1– FCTC de las extremidades, para sufrir condrogénesis en respuesta a la estimulación Hh.
El nuevo crecimiento de la cola implica distintas localizaciones de fagocitos.
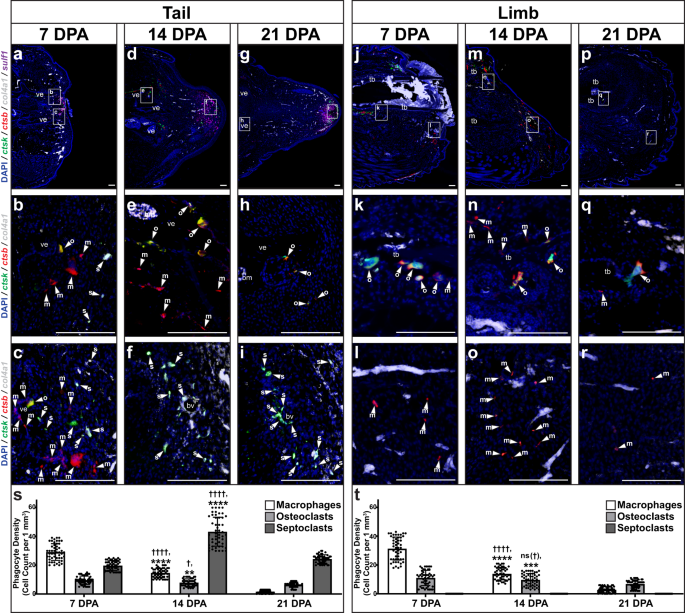
Otros análisis de secuenciación unicelular de la regeneración de la cola de lagarto investigaron macrófagos y otras células fagocíticas, revelando heterogeneidad y poblaciones de células distintas delineadas por la expresión de genes marcadores diferenciales y la agrupación de vecinos más cercanos (Fig. 13a – c). ctsb+ catepsina K-negativa (ctsk–) macrófagos y ctsb+ ctsk+ Los osteoclastos se agruparon con otras células inmunes, como se esperaba (Figura complementaria. 13a, b). Sin embargo, una distinta ctsb– ctsk+ población agrupada con cadena alfa 1 de colágeno tipo IV (col4a1+) pericitos (Fig. 13a–d). Se ha demostrado previamente que las poblaciones de septoclastos, células fagocíticas derivadas de un linaje pericítico en lugar de mieloide, regulan el desarrollo y la curación del esqueleto en mamíferos.79, y planteamos la hipótesis de que ctsb– ctsk+ col4a1+ Las células representaban células fagocíticas similares a septoclastos de lagarto (en el presente documento, denominadas septoclastos).
Los resultados de la secuenciación unicelular se validaron mediante histología/FISH en colas y extremidades de lagarto recolectadas a los 7, 14 y 21 DPA. (Higo. 6). ctsb+ ctsk- col4a1- Los niveles de macrófagos alcanzaron su punto máximo en las colas a los 7 DPA (Fig. 6a-c, s) antes de disminuir en 21 DPA (Fig. 6g-i, s). ctsb+ ctsk+ col4a1- Los números de población de osteoclastos fueron más altos en las colas a los 7 y 14 DPA antes de disminuir a los 21 DPA (Fig. 6a-i, s). Los osteoclastos de la cola se asociaron exclusivamente con las vértebras, ocupando criptas clásicas a lo largo de las superficies periósticas (Fig. 6a-yo). ctsb– ctsk+ col4a1+ Los niveles de septoclastos alcanzaron su punto máximo en las colas durante la formación del blastema a los 14 DPA (Fig. 6a-i, s) y fueron detectados entre sulf1+ poblaciones de fibroblastos de blastema (Fig. 6a-yo). Además, se confirmaron las colas recolectadas en 0, 1, 3, 7 y 14 DPA. ctsb+ Las poblaciones de macrófagos y osteoclastos alcanzaron su punto máximo en 7 DPA dentro del lapso de tiempo de la etapa inflamatoria activa de células inmunes, puntos 1 a 7 DPA (Fig. 14). Sin embargo, a diferencia de los macrófagos y los osteoclastos de la cola, los números elevados de septoclastos en las colas persistieron más allá de las etapas de blastema y, a los 21 DPA, ocuparon sulf1+ regiones apicales en las puntas de la cola en regeneración (Fig. 6g–yo). En conjunto, estos resultados sugirieron una relación entre los septoclastos y el estado de las células del blastema.
Secciones sagitales representativas de lagarto (carolinensis) a–i colas y j–r extremidades recogidas a–c, j–l 7 DPA, d–f, m–o 14 DPA, y g–i, p–r 21 DPA analizados por histología/FISH para ctsb, ctsk, col4a1y sulf1 expresión. Vistas de mayor aumento de las regiones correspondientes en (a, d, g, j, m, p) destacando ctsb+ ctsk– col4a1– macrófagos (m, punta de flecha), ctsb+ ctsk+ col4a1- osteoclastos (o, punta de flecha), y ctsb– ctsk+ col4a1+ septoclastos (s, punta de flecha) en regiones proximales a b, e, h vértebra, k, n, q tibia, c, f, i cola distal y l, o, r miembro distal. bm médula ósea, bv vaso sanguíneo, tb tibia, ve vértebra. Barra = 100 µm. s, t Cuantificación de las densidades de macrófagos, osteoclastos y septoclastos medidas en lagartos. s colas y t Las extremidades se recolectaron a los 7, 14 y 21 DPA. n = 50 densidades celulares medidas a partir de cinco imágenes entre 10 animales/muestras diferentes para cada punto temporal. Los datos se presentan como valores medios +/− desviación estándar. Se utilizaron ANOVA unidireccional de Welch para varianzas desiguales y pruebas de comparaciones múltiples T3 de Dunnett. †equilibrado P = 0.0139; ††††equilibrado P < 0.0001; norte (†), no significativo (ajustado P = 0.4663), en comparación con el correspondiente tipo de célula 7 DPA (pruebas de comparaciones múltiples de T3 de Dunnett). **equilibrado P = 0.0024; ***equilibrado P = 0.0005; ****equilibrado P < 0.0001, en comparación con el tipo de célula 21 DPA correspondiente (pruebas de comparaciones múltiples de T3 de Dunnett). Los datos de origen se proporcionan como un archivo de datos de origen.
Las extremidades exhibieron poblaciones de macrófagos y osteoclastos que siguieron tendencias espaciotemporales similares a las poblaciones de células de la cola coincidentes en el tiempo (Fig. 6). Los macrófagos de las extremidades se asociaron con la epidermis de la herida y, junto con los osteoclastos asociados al hueso, alcanzaron su punto máximo antes del 14 DPA antes de disminuir aún más a los 21 DPA (Fig. 6j–r,t). Sin embargo, las extremidades no exhibieron septoclastos identificables en ningún momento analizado y no expresaron sulf1 (Higo. 6j–r,t). Dada la falta de condrogénesis sensible a Hh exhibida por las extremidades amputadas de lagarto descrita anteriormente, estos resultados respaldaron aún más los vínculos entre los septoclastos de los lagartos, la formación de blastema, sulf1 expresión, sensibilidad Hh y formación de cartílago, que se investigan más adelante.
La formación de blastema y la condrogénesis dependen de los fagocitos.
Anteriormente validamos los tratamientos con liposomas de clodronato como métodos eficaces para agotar las poblaciones de fagocitos/macrófagos de lagarto e inhibir la formación de blastema en carolinensis9. Aquí, probamos el efecto del tratamiento con liposomas de clodronato sobre los niveles de población de macrófagos, osteoclastos y septoclastos y la expresión de marcadores de fibroblastos durante la formación de blastema de cola de lagarto (Figura complementaria. 15). Los lagartos se trataron previamente con clodronato o liposomas de solución salina tamponada con fosfato (PBS) de control de vehículo 72 y 48 h antes de la amputación de la cola, y las colas se recolectaron en la etapa de blastema 14 DPA para su análisis.
La histología reveló que el tratamiento con liposomas con clodronato inhibió la formación de blastema en comparación con los controles (Figura complementaria). 15a, b, f, g) y resultó en el agotamiento de ctsb+ ctsk- macrófagos, ctsb+ ctsk+ osteoclastos y ctsb- ctsk+ col4a1+ septoclastos (Fig. 15c-e, h-j), como se esperaba. Las colas tratadas con clodronato también se perdieron spp1 y sulf1 expresión en los CMCT (Fig. 15a, b, f, g). El blastema de control reveló macrófagos y osteoclastos localizados en sulf1- áreas del blastema, mientras que los septoclastos solo se detectaron distales a sulf1+ áreas de la cola (Fig. 15c-e). Co-tinción de spp1 y sulf1 a los 7 y 14 DPA en blastema no tratado revelado spp1 expresión tanto a los 7 como a los 14 DPA, mientras que grandes áreas de sulf1+ células de blastema coexpresadas spp1, lo que confirma que ambos marcadores están activos en una subpoblación de blastema FCTC (Fig. 16). En conjunto, estos resultados establecieron un vínculo entre los linajes fagocíticos de lagartos y la adquisición del gen marcador FCTC.
A continuación, probamos los efectos del pretratamiento con liposomas de clodronato sobre la capacidad de respuesta del FCTC de lagartos a la señalización de Hh en L. lugubris Estudios de trasplante de fibroblastos de blastema (Fig. 7). Se descubrió que este modelo es particularmente aplicable para probar el potencial condrogénico exógeno del FCTC in situ cuando las condiciones endógenas no son propicias para la formación de blastema/cartílago. L. lugubris Los lagartos fueron pretratados con liposomas de clodronato (validados en la Fig. 17), o liposomas de PBS de control antes de la amputación, y se aislaron fibroblastos de las colas 14 DPA. Los fibroblastos recolectados de lagartos tratados con PBS y liposomas con clodronato se marcaron previamente con DiI o DiO, respectivamente, antes de cotrasplantarlos en una cohorte separada de blastemas de lagarto receptores tratados con SAG (Fig. 7a).
a Esquema experimental para la aplicación de tratamientos con liposomas de clodronato y trasplantes de fibroblastos en lagartos (L. lugubris) para investigar las dependencias de la condrogénesis de las células de blastema en las poblaciones de fagocitos. (1) Se amputan las colas de lagartos donantes tratados con liposomas de PBS y clodronato. (2) Los fibroblastos de la cola se aíslan de colas de lagarto tratadas con liposomas de PBS y liposomas de clodronato 14 DPA. (3) Los fibroblastos derivados de lagarto PBS están marcados con DiI, mientras que los fibroblastos de clodronato están marcados con DiO. (4) Las células marcadas se cotrasplantan en blastema de cola de 14 DPA de lagartos receptores tratados con SAG. (5) Después de 14 días de tratamiento con SAG después del trasplante, las colas regeneradas se analizan mediante Col2 IF y microscopía de fluorescencia. b–i Análisis histológico representativo de colas regeneradas por lagartos tratados con SAG, preinyectados con FCTC tratados con liposomas de PBS marcados con DiI y FCTC tratados con liposomas de clodronato marcados con DiO y analizados por histología, fluorescencia de DiI y DiO, y Col2 IF 14 DPT/28 DPA. . Barra = 50 µm. j Cuantificación de células marcadas con DiI y DiO que coexpresan Col2 14 DPT. n = 50 recuentos de células medidos a partir de cinco imágenes entre diez animales/colas diferentes para cada condición. Los datos se presentan como valores medios +/− desviación estándar. Bidireccional no emparejado t Se utilizó la prueba con corrección de Welch para varianzas desiguales. ****P < 0.0001. Los datos de origen se proporcionan como un archivo de datos de origen.
Se recolectaron colas 14 DPT y se analizaron para determinar la contribución de DiO.+ y DiI+ células a la formación de cartílago (Fig. 7b-j). Niveles significativamente más altos de DiI+ Los FCTC de la cola de control experimentaron condrogénesis y se incorporaron a Col2+ áreas de cartílago de condensación, en comparación con DiO+ FCTC tratados con clodronato, lo que sugiere que los fibroblastos de blastema contribuyeron a las regiones del cartílago, mientras que los fibroblastos derivados de colas tratadas con clodronato, que carecen de blastemas, no (Fig. 7b-j). Los fibroblastos tratados con clodronato y liposomas de PBS trasplantados por separado en blastemas receptores tratados con SAG o con control de vehículo revelaron resultados similares (Fig. 18), y solo los fibroblastos tratados con liposomas de PBS se incorporan a Col2+ cartílago (Fig. 18d–f, metro), mientras que los fibroblastos de liposomas de clodronato en receptores tratados con SAG y los fibroblastos tratados con PBS o liposomas de clodronato trasplantados en blastema de control de vehículo no expresaron Col2 (Fig. 18a – c, g – m). En conjunto, estos resultados establecieron una dependencia de la condrogénesis sensible a Hh de las células de blastema de lagarto del precondicionamiento de las poblaciones de fagocitos.
Los medios condicionados por fagocitos rescatan la formación de blastema
Anteriormente hemos establecido protocolos para aislar y diferenciar poblaciones de fagocitos de múltiples tejidos de lagarto.9. Dada la evidencia descrita anteriormente que vincula los septoclastos con los pericitos, planteamos la hipótesis de que los vasos sanguíneos de la cola ricos en pericitos representaban fuentes efectivas de septoclastos. Se aislaron vasos sanguíneos caudales de colas de lagarto y se sometieron a protocolos de aislamiento de fagocitos. La médula ósea de lagarto se utilizó como fuente de macrófagos, como se validó previamente9. Los fagocitos diferenciados de los vasos sanguíneos caudales y las células de la médula ósea se analizaron mediante ensayos de fagocitosis, citometría de flujo y IF/FISH para Ctsk, ctsb, subunidad alfa M de la integrina (itgam/cd11b)y col4a1 expresión (Fig. 19).
Tanto las células derivadas de los vasos caudales como las de la médula ósea exhibieron niveles igualmente altos de fagocitosis (Fig. 19a-c, g) y expresado itgam/cd11b (Fig. complementaria. 19d,h), validando sus identidades como fagocitos. Sin embargo, los fagocitos de los vasos sanguíneos y de la médula ósea exhibieron expresiones de marcadores diferenciales que reflejaban las diferencias observadas in vivo (Fig. 19d–f, h–j); Los fagocitos de la médula ósea expresan el marcador de macrófagos. ctsb (Fig. complementaria. 19d-f), mientras que los fagocitos de los vasos caudales expresaron los marcadores de septoclastos Ctsk y col4a1 (Fig. complementaria. 19 h – j). La citometría de flujo confirmó la pureza de las respectivas poblaciones de macrófagos y septoclastos, con un promedio del 94.5% de las células dentro de los grupos de fagocitos de la médula ósea que expresan Ctsb.+ ctsk- firmas de macrófagos y más del 98% de las células de fagocitos de los vasos caudales expresaron Ctsb- ctsk+ firmas de septoclastos (Fig. 19k-p). En conjunto, estos resultados validaron ctsb- ctsk+ col4a1+ cultivos de fagocitos derivados de vasos sanguíneos caudales como septoclastos y ctsb+ ctsk- col4a1- cultivos de fagocitos derivados de médula ósea como macrófagos.
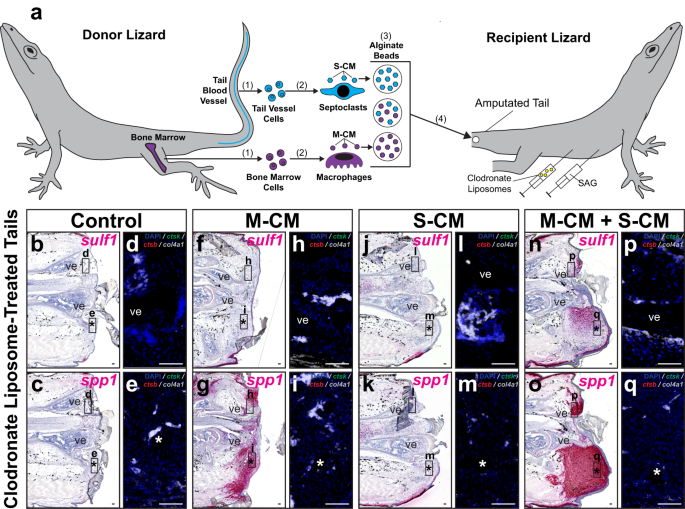
A continuación, probamos las capacidades de las poblaciones de septoclastos para rescatar el estado de potencial condrogénico de las células de blastema de cola de lagarto, definido por respuesta a Hh. sulf1 expresión, después del tratamiento con liposomas de clodronato (Fig. 8 y Fig. Suplementaria. 20). Se recogieron medios condicionados por macrófagos (M-CM) y medios condicionados por septoclastos (S-CM) de fagocitos derivados de la médula ósea y de los vasos caudales, respectivamente, y se concentraron. Se implantaron perlas de alginato empapadas en M-CM y/o S-CM concentrado en colas amputadas de lagartos cotratados con liposomas de clodronato y SAG (Fig. 8a) o control del vehículo (Fig. 20a). Las colas se recogieron 14 días después de la implantación y se analizaron mediante histología/ISH/FISH para sulf1 y spp1 expresión y marcadores de células fagocíticas (Fig. 8b–q y Fig. Suplementaria. 20b–q).
a Esquema experimental para probar los efectos de las biomoléculas secretadas por poblaciones de macrófagos y septoclastos sobre la expresión del gen FCTC en lagartos tratados con liposomas de clodronato (carolinensis) colas. (1) Se aíslan células de la médula ósea y de los vasos sanguíneos de la cola de lagartos donantes y (2) se diferencian en macrófagos y septoclastos in vitro, respectivamente. (3) Los medios condicionados por macrófagos y septoclastos (M-CM y S-CM, respectivamente) se recogen, concentran y absorben mediante perlas de alginato, tanto por separado como en conjunto. (4) Se implantan perlas de alginato en colas amputadas de lagartos (0 DPA) cotratadas con liposomas de clodronato y SAG. b–q Secciones sagitales representativas de colas de lagarto 14 DPA cotratadas con SAG y liposomas de clodronato, implantadas con perlas de M-CM y/o S-CM, y analizadas mediante histología/ISH/FISH para sulf1, spp1, ctsk, ctsby col4a1 expresión. Vistas fluorescentes de mayor aumento de (b, c, f, g, j, k, n, o), respectivamente, representan regiones indicadas alrededor d, h, l, p vértebra y e, i, m, q cuentas implantadas. n = 8 lagartos/muestras por condición de tratamiento analizada. *, ubicación de la perla implantada; ve, vértebra. Barra = 50 µm.
Spp1 La señal se detectó en las colas tratadas con M-CM independientemente del tratamiento de control de vehículo/SAG (Fig. 8g y Fig. Suplementaria. 20g), pero estuvo ausente en las condiciones tratadas solo con S-CM (Fig. 8k y Fig. Suplementaria. 20k). sulf1 La expresión solo se detectó en colas cotratadas con SAG y tanto en M-CM como en S-CM (Fig. 8n y Fig. Suplementaria. 20n). Spp1+ y sulf1+ regiones de la cola concentradas alrededor de perlas implantadas en muestras tratadas con M-CM y S-CM (Fig. 8g, n, o). Endógeno ctsb+ ctsk- col4a1- macrófagos, ctsb+ ctsk+ col4a1- osteoclastos y ctsb- ctsk+ col4a1+ No se detectaron septoclastos en ninguna de las condiciones analizadas, como se esperaba debido al tratamiento con liposomas de clodronato (Fig. 8 y Fig. Suplementaria. 20).
Se utilizaron perlas empapadas en medios de cultivo no acondicionados como control y se implantaron en colas tratadas con liposomas de clodronato (Fig. 21), no revelando cambios en spp1 or sulf1 Expresión en el control del vehículo o colas receptoras tratadas con SAG (Figura complementaria. 21a–d), lo que significa que los tratamientos con medios condicionados por fagocitos fueron responsables de los cambios en la expresión genética en lugar de la implantación de perlas o los medios de cultivo solos. En conjunto, estos resultados sugirieron que las biomoléculas secretadas por los septoclastos de los lagartos eran necesarias para rescatar las características distintivas de la formación de blastema, incluidas sulf1 expresión en respuesta a la estimulación de Hh incluso cuando las poblaciones de septoclastos endógenos se habían agotado. Si bien los factores secretados por macrófagos fueron suficientes para inducir el CMCT spp1 expresión sulf1 solo se detectó en colas tratadas con medios condicionados tanto por macrófagos como por septoclastos, lo que indica una adición secuencial de la expresión del gen marcador FCTC durante el establecimiento del blastema.
Septoclast-CM induce la formación de cartílago en miembros amputados
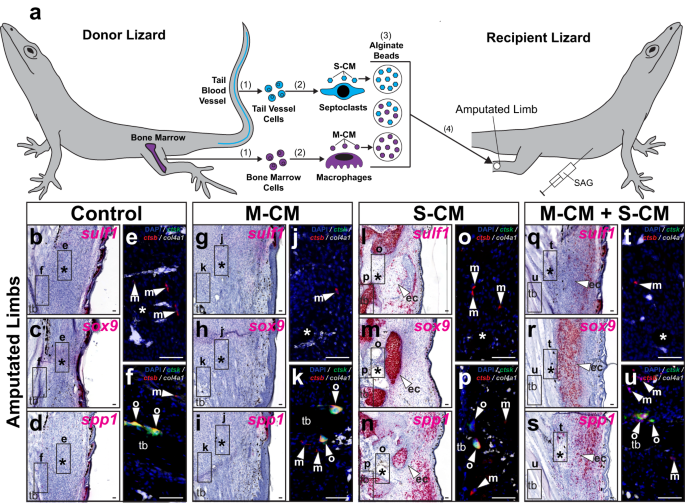
Las comparaciones anteriores de la curación de extremidades y colas de lagartos amputadas sugirieron un vínculo entre la condrogénesis del FCTC y las poblaciones de septoclastos y, aquí, los efectos de la S-CM en las extremidades de los lagartos. sulf1, spp1, y sox9 Se probó la expresión (Fig. 9 y Fig. Suplementaria. 22). Se implantaron perlas empapadas en S-CM y/o M-CM en extremidades de lagarto el 7 DPA. Después de 21 días de tratamiento con SAG (Fig. 9) o control del vehículo (Fig. 22), las extremidades se recolectaron y analizaron mediante histología/ISH para FCTC y expresión de marcadores de condrogénesis y mediante FISH para marcadores de fagocitos (Fig. 9a y Fig. Suplementaria. 22a).
a Esquema experimental para probar los efectos de los medios condicionados por macrófagos y septoclastos sobre fibroblastos nativos en lagartos (carolinensis) extremidades. (1) Se aíslan células de la médula ósea y de los vasos sanguíneos de la cola y (2) se utilizan para derivar macrófagos y septoclastos in vitro, respectivamente. (3) Los medios condicionados por macrófagos y septoclastos (M-CM y S-CM) se recogen, concentran y absorben mediante perlas de alginato, tanto por separado como en conjunto. (4) Se implantan perlas de alginato en extremidades amputadas de lagartos tratados con SAG 7 DPA. b–u Secciones sagitales representativas de extremidades de lagarto 28 DPA tratadas con SAG, implantadas con perlas de M-CM y/o S-CM y analizadas mediante histología/ISH/FISH para sulf1, sox9, spp1, ctsk, ctsby col4a1 expresión. Vistas fluorescentes de mayor aumento de (b–d, g–i, l–n, q–s), respectivamente, representan regiones indicadas alrededor e, j, o, t cuentas implantadas y f, k, p, u tibia. n = 8 lagartos/muestras por condición de tratamiento analizada. *, ubicación de la perla implantada; ec (punta de flecha), cartílago ectópico; m (punta de flecha), macrófago; o (punta de flecha), osteoclasto; tuberculosis, tibia. Barra = 50 µm.
Los FCTC en miembros de control y miembros implantados con perlas de M-CM sin S-CM no expresaron sulf1, sox9o spp1 independientemente de los tratamientos de control del vehículo/SAG (Fig. 9b – d, g – i y Fig. Suplementaria. 22b – d, g – i). Perlas de S-CM implantadas, con y sin M-CM, indujeron FCTC sulf1 y sox9 expresión alrededor de los sitios de implantación de las perlas, pero solo en respuesta al tratamiento conjunto con SAG (Fig. 9l, m, q,r y Fig. Suplementaria. 22l, m, q,r). Las perlas de S-CM, nuevamente, independientemente de la adición de M-CM, indujeron spp1 Expresión en extremidades de lagartos tratados tanto con SAG como con control de vehículo (Fig. 9n,s y Fig. Suplementaria. 22n,s). Se detectaron macrófagos y osteoclastos endógenos, pero no septoclastos, en todas las condiciones analizadas y los niveles no se vieron afectados por el tratamiento con fármacos o perlas, independientemente del tipo de medio condicionado (Fig. 9 y Fig. Suplementaria. 22).
El tratamiento con medios no condicionados no indujo cambios en la expresión genética o condrogénesis en el control del vehículo o en las extremidades receptoras tratadas con SAG (Figura complementaria. 21e-j). Estos resultados sugirieron que las señales exógenas derivadas de septoclastos eran necesarias y suficientes para complementar el entorno de las extremidades amputadas naturalmente deficientes en septoclastos, introduciendo condrogénesis sensible a Hh en las extremidades de lagarto amputadas. También se mantienen los factores de células de septoclastos de lagarto spp1 expresión en extremidades de lagarto hasta al menos el 28 DPA. (Higo. 9n,s y Fig. Suplementaria. 22n,s). Desde la pérdida de spp1 La expresión de los FCTC de extremidades de lagarto el 28 DPA coincide con la formación de cicatrices en el 28 DPA (Fig. 7k), estos resultados sugieren un papel de las poblaciones de septoclastos de lagarto en la inhibición de la fibrosis.
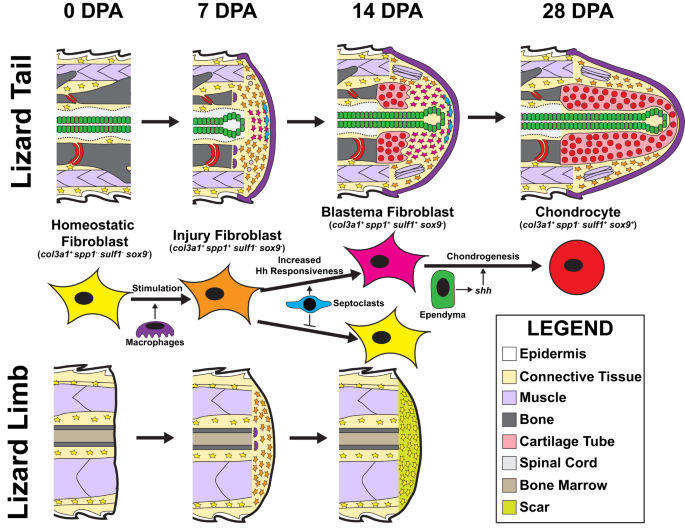
En resumen, los resultados descritos anteriormente sugieren los siguientes mecanismos de adquisición secuencial del gen marcador de fibroblastos durante la formación blastémica de la cola de lagarto (Fig. 10). col3a1+ Los fibroblastos en reposo tanto en la cola como en las extremidades responden a la lesión de amputación con expresión de spp1, junto con otros genes marcadores FCTC de estado de lesión, como col12a1 y mdk. Los FCTC en estado de lesión migran a los sitios de amputación luego de la infiltración de poblaciones de macrófagos y la señalización de factores secretados por macrófagos. Las colas de los lagartos, pero no las extremidades, exhiben poblaciones de células septoclastos después de lesiones de amputación que inducen una mayor sensibilidad al FCTC Hh. Los FCTC expuestos a factores secretados por septoclastos mantienen spp1 y expresa sulf1 y sox9 después de la estimulación por shh, producido por células ependimarias. Este patrón espacial da como resultado la formación de cartílago alrededor de los tubos ependimarios del blastema. Sin septoclastos, los CMCT de miembros amputados no mantienen spp1 expresión y permanecen insensibles a la señalización Hh. Los CMCT de miembros no expresan sulf1 o sufrir condrogénesis, incluso cuando se tratan con señales Hh exógenas, formando finalmente cicatrices en lugar de cartílago.
col3a1+ Los FCTC de cola originales homeostáticos (0 DPA) son estimulados por señales paracrinas de macrófagos y expresan spp1 en respuesta a una lesión por el 7 DPA. Los factores secretados por los septoclastos de la cola mantienen spp1 expresión en FCTC y mejorar la sensibilidad del FCTC a las señales de Hedgehog (Hh) aportadas por los tubos ependimarios del blastema. La estimulación Hh induce sulf1 Expresión en FCTC de blastema estimulados por septoclastos antes del 14 DPA. sulf1+ Los FCTC entran en un programa condrogénico en respuesta a señales Hh y expresan sox9 y col2a1, diferenciándose en condrocitos a los 28 DPA. Las extremidades amputadas de lagarto proporcionan un contexto para la formación y el recrecimiento del blastema de la cola como apéndices no regenerativos que exhiben movilización FCTC y cambios de estado, pero no condrogénesis. col3a1+ Los fibroblastos homeostáticos de las extremidades expresan spp1 a las 7 DPA en respuesta a la infiltración de macrófagos después de la amputación. Sin embargo, spp1 la expresión no se mantiene sin la estimulación de los septoclastos, que están ausentes en las extremidades de lagarto amputadas. Sin exposición a factores secretados por septoclastos, los FCTC de las extremidades pierden spp1 expresión a los 14 DPA, no responden a la señalización de Hh y no expresan sulf1 o sufrir condrogénesis. En cambio, las extremidades amputadas de lagarto forman cicatrices.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Automoción / vehículos eléctricos, Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- ChartPrime. Eleve su juego comercial con ChartPrime. Accede Aquí.
- Desplazamientos de bloque. Modernización de la propiedad de compensaciones ambientales. Accede Aquí.
- Fuente: https://www.nature.com/articles/s41467-023-40206-z