Un ensayo sencillo para detectar proteínas clasificadoras de vehículos eléctricos
En busca de proteínas clasificadoras de vehículos eléctricos eficientes, se compiló una lista de candidatas basada en revisiones de la literatura y bases de datos de proteómica. Los candidatos potenciales se derivaron de (1) proteínas que se encontraron enriquecidas en vehículos eléctricos en las células NCI-6029, (2) proteínas abundantes en los vehículos eléctricos producidas por células epiteliales de riñón embrionario humano (HEK) -293T34, (3) informaron proteínas de clasificación de vehículos eléctricos como referencias a estudios previos32,33y (4) todas las proteínas de la superfamilia de tetraspaninas. Se excluyeron las proteínas de más de 130 kDa para facilitar la sobreexpresión/ingeniería. Se incluyeron un total de 244 candidatos con un tamaño medio de 38 kDa, de los cuales 129 eran proteínas no transmembrana y 115 (Fig. 1a; consulte el archivo de origen de datos para obtener una lista completa).
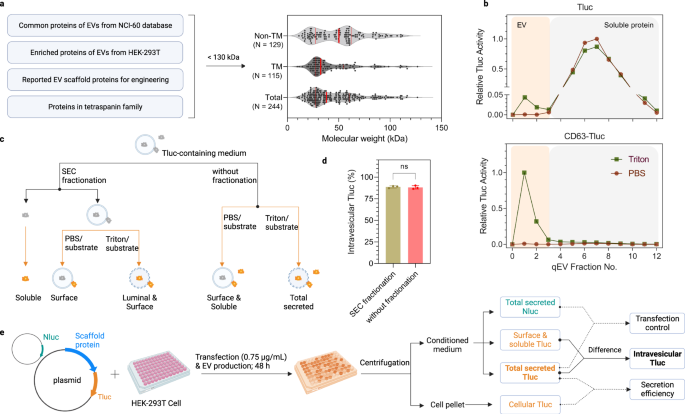
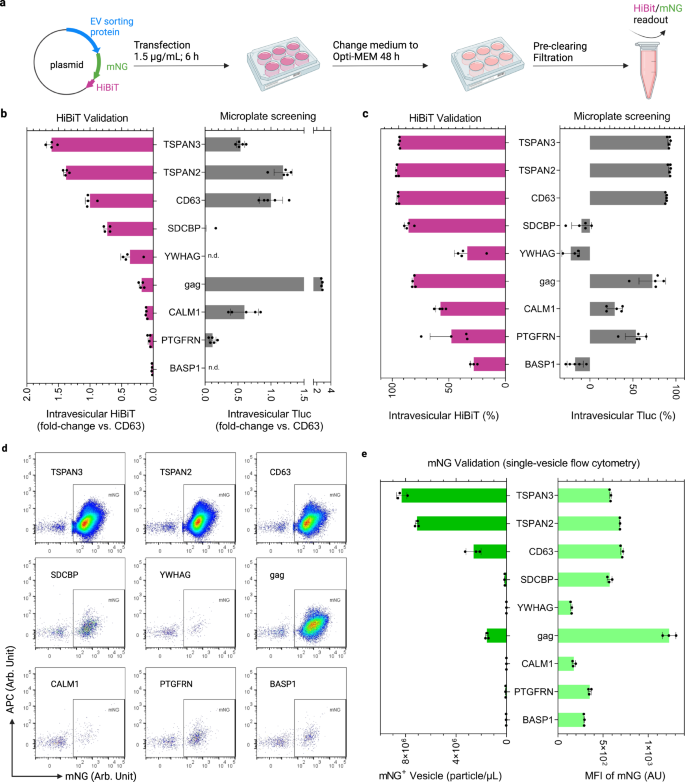
a Criterios de selección y descripción general de las proteínas candidatas a clasificar vehículos eléctricos. Las líneas continuas rojas indican los valores percentiles del 25%, 50% y 75%. b Perfiles de elución SEC de medios condicionados de células HEK-293T que expresan Tluc o CD63-Tluc. La actividad Tluc en cada fracción se cuantificó directamente (grupo PBS) o después de la lisis de membrana (grupo Triton) y se normalizó a la fracción con la señal más alta. Los vehículos eléctricos y las proteínas solubles se recuperaron en las fracciones 0-3 y 4-12, respectivamente. c Esquema de diferenciación de formas Tluc en medios condicionados. d Porcentaje de Tluc intravesicular para CD63-Tluc utilizando medios fraccionados y no fraccionados. Los resultados se muestran como la media ± desviación estándar de tres réplicas biológicas. Estudiante de dos caras t prueba (P > 0.9999). ns: no significativo. e Esquema del procedimiento de selección y análisis de datos. Se cultivaron células HEK-293T en microplacas de 96 pocillos y se cotransfectaron con plásmido de fusión Tluc y plásmido Nluc. Los cultivos celulares se centrifugaron y se midió la actividad Tluc en el sedimento celular y en el medio acondicionado. La actividad de Nluc solo se cuantificó en los medios condicionados. c, e Creado con BioRender.com. Los datos de origen se proporcionan como un archivo de datos de origen. Cromatografía de exclusión por tamaño SEC.
Para evaluar la capacidad de carga luminal de los candidatos en vehículos eléctricos, desarrollamos un ensayo basado en el indicador de luciferasa ThermoLuc (Tluc; 60.5 kDa).18. En resumen, Tluc se fusionó con los extremos C de todos los candidatos, teniendo en cuenta que los extremos N suelen ser el sitio para los péptidos señal y las modificaciones postraduccionales. Los plásmidos que codifican las proteínas de fusión se transfectaron en células HEK-293T. Después de 48 h, los medios condicionados se recogieron y procesaron adicionalmente antes de las mediciones de bioluminiscencia. Inicialmente, para evaluar la viabilidad de este ensayo, se analizaron los medios condicionados de células que expresan Tluc solo y CD63-Tluc. Ambos fueron fraccionados con columnas de cromatografía de exclusión molecular (SEC) para separar las vesículas de las proteínas libres (Fig. 1b)35. Las fracciones se trataron con PBS para determinar la Tluc soluble/asociada a la superficie o con el detergente Triton X-100 para detectar la Tluc total secretada (Fig. 1c). En comparación con Tluc solo, la fusión con CD63 resultó en un cambio prominente de Tluc hacia la fracción EV (Fig. 1b). En particular, la actividad de Tluc en las fracciones de EV solo se detectó tras la lisis de la membrana, lo que indica que el sustrato de Tluc no puede cruzar la membrana de EV y reaccionar con la luciferasa luminal. Esto implica que el fraccionamiento SEC es prescindible para cuantificar proteínas luminales. Esto se ve respaldado por la comparación de medios fraccionados y no fraccionados de células que expresan CD63-Tluc, que no revelaron diferencias significativas en el porcentaje de Tluc intravesicular (Fig. 1d). En conjunto, estos datos muestran que este ensayo se puede utilizar en un formato de alto rendimiento para identificar posibles andamios de carga de vehículos eléctricos.
En el futuro, el principio para seleccionar a los 244 candidatos fue el mismo que el anterior. Para los análisis posteriores, las proteínas se evaluaron principalmente en función de la cantidad absoluta de Tluc intravesicular, derivada de la diferencia en la señal de Tluc detectada con y sin lisis de membrana, o el porcentaje relativo de la misma (Fig. 1e). La información sobre la expresión de la proteína de fusión se obtuvo midiendo Tluc en las células productoras de EV. Además, cuando se especificó, los datos se normalizaron a un control de transfección en forma de un plásmido que codifica la luciferasa NanoLuc (Nluc) que se añadió a la mezcla de transfección para tener en cuenta posibles variaciones de transfección.
El cribado identifica docenas de proteínas clasificadoras de vehículos eléctricos
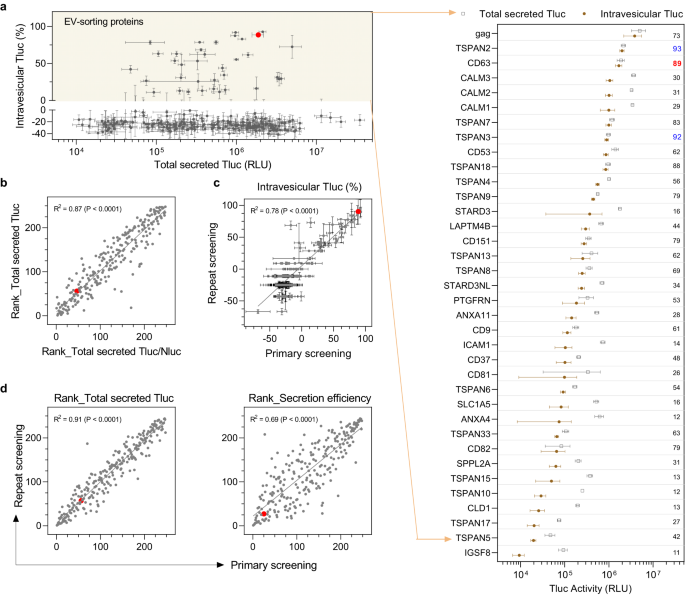
El examen de los 244 candidatos en células HEK-293T no reveló una correlación obvia entre la Tluc intravesicular y la Tluc celular o total secretada (Figura complementaria. 1a, b), lo que indica que ni la expresión celular ni la secreción general predicen completamente la capacidad de clasificación de EV. Para la mayoría de los candidatos, el porcentaje de Tluc intravesicular fue inferior a cero, lo cual es inesperado pero podría atribuirse a una actividad enzimática atenuada y/o a la vida útil de los fotones en presencia del detergente Triton. Sin embargo, proporcionó un límite razonable y práctico para las proteínas con capacidad de clasificación de vehículos eléctricos. Según esta definición, se encontró que un total de 36 proteínas exhibían capacidad de clasificación de EV en células HEK-293T (Fig. 2a). Entre ellas se encontraban cinco proteínas de clasificación de EV conocidas, incluidos tres marcadores de EV (CD9, CD63, CD81), una proteína identificada recientemente (PTGFRN)32y la mordaza de la glicoproteína viral, lo que corrobora la validez de nuestro protocolo de detección. Hasta donde sabemos, esta es la primera vez que se informa que las 31 proteínas restantes son capaces de cargar carga luminal en vehículos eléctricos.
a Descripción general de los 244 candidatos que representan el total de Tluc secretado frente al porcentaje de Tluc intravesicular. Se definió que las proteínas de clasificación EV tenían un porcentaje de Tluc intravesicular superior a cero (área amarilla) y se muestran en el diagrama de puntos agrupados. El valor se refiere al porcentaje de Tluc intravesicular. Las proteínas están marcadas con nombres de genes. b Correlación entre el rango respecto de Tluc total secretada y el rango respecto de la relación Tluc/Nluc total secretada. c Correlación del porcentaje de Tluc intravesicular obtenido del cribado primario y repetido. d Correlación del rango con respecto a Tluc secretada o eficiencia de secreción entre el cribado primario y repetido. Resultados en (a, b) fueron del cribado primario y se muestran como media ± desviación estándar de cinco réplicas biológicas. Los datos de la evaluación repetida se muestran como media ± desviación estándar de tres réplicas biológicas. En los diagramas de dispersión, cada punto se refiere a un candidato y el punto rojo indica el CD63 de referencia. El grado de correlación se analizó con regresión lineal y se muestra como bondad de ajuste (R2) y significado de la pendiente distinta de cero (P). Los datos de origen se proporcionan como un archivo de datos de origen.
De las cuatro proteínas clasificadoras de vehículos eléctricos no virales conocidas, la CD63 mostró el porcentaje más alto de Tluc intravesicular, con el 89% del total de Tluc secretada localizada dentro de los vehículos eléctricos. En particular, TSPAN2 superó a CD63 no solo en términos de Tluc intravesicular relativo (93% frente a 89%) sino también en cantidad absoluta (2.0e6 frente a 1.7e6; consulte el archivo de datos fuente para obtener información detallada). Aparte de eso, tres proteínas calmodulina (CALM1, CALM2, CALM3) clasificaron cantidades considerables de Tluc en EV pero con porcentajes moderados de Tluc intravesicular (29-31%).
Para descartar que factores no deseados interfirieran con la secreción de Tluc, se implementaron controles de calidad adecuados. En primer lugar, todos los candidatos se clasificaron según la Tluc total secretada y la relación entre la Tluc total secretada y la Nluc. La normalización contra la señal de Nluc no afectó la secreción de Tluc (Fig. 2b), descartando así un papel confuso del procedimiento de transfección. En segundo lugar, una repetición del cribado reveló resultados consistentes para el porcentaje de Tluc intravesicular (Fig. 2c), así como los rangos de Tluc total secretada y la eficiencia de secreción (Fig. 2d). Finalmente, los rangos de Tluc total secretada y la eficiencia de secreción mostraron un alto grado de correlación lineal entre dos dosis diferentes de plásmido (0.75 µg/mL frente a 1 µg/mL; Fig. 1c). En conjunto, estos resultados corroboran la confiabilidad de los hallazgos obtenidos con nuestro método de detección.
Las proteínas de clasificación de vehículos eléctricos se conservan en gran medida en diferentes tipos de células
Además de HEK-293T, otros tipos de células se utilizan regularmente como fuentes de EV, lo que nos lleva a evaluar la capacidad de clasificación de EV de nuestros candidatos en (1) células HEK adaptadas a suspensión (Freestyle 293-F), (2) células derivadas de sangre del cordón umbilical humano. células madre mesenquimales (MSC), (3) células de carcinoma derivadas de hepatocitos humanos (Huh-7) y (4) células epiteliales de riñón de ratón (TCMK-1). Para este propósito, se examinaron como se indicó anteriormente 95 candidatos que se habían mostrado prometedores en la selección inicial, en cualquiera de estas categorías: porcentaje de Tluc intravesicular, Tluc total secretada y eficiencia de secreción (consulte el archivo de datos fuente para obtener información detallada).
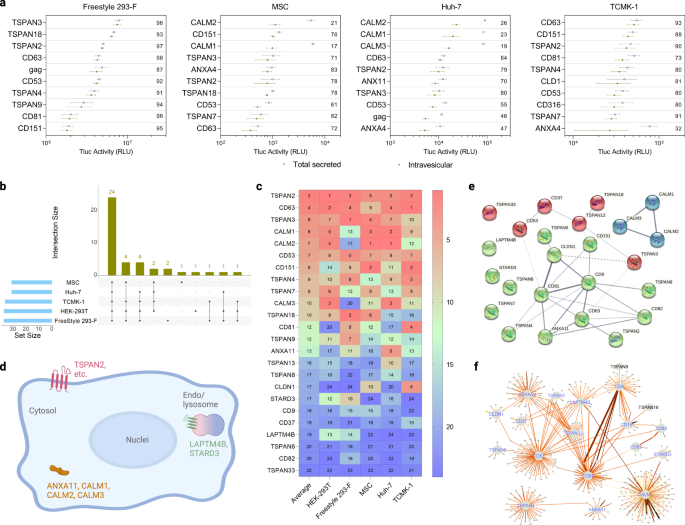
En Freestyle 293-F, la proteína con la mayor capacidad de clasificación de EV en términos de porcentaje de Tluc intravesicular fue TSPAN3. En MSC y Huh-7, CALM2 ocupó el rango más alto, y en TCMK-1 fue CD63 (Fig. 3a). Si bien no se encontró que el procedimiento de transfección afectara sustancialmente la secreción de Tluc en todas las células adherentes analizadas, Freestyle 293-F parecía más propenso a la variación (Fig. 2). Se identificaron entre 30 y 37 proteínas con capacidad de clasificación EV (porcentaje de Tluc intravesicular superior a cero) para cada tipo de célula (Fig. 3b). De ellas, 24 proteínas se conservaron en los cinco tipos de células, lo que indica su sólida capacidad de clasificación en diferentes contextos celulares (consulte el archivo de datos fuente para obtener una lista completa). Las proteínas en el subconjunto conservado se clasificaron según su actividad Tluc intravesicular absoluta (Fig. 3c). En promedio, TSPAN2, CD63 y TSPAN3 demostraron las mejores capacidades de clasificación en diferentes tipos de células.
a Diez proteínas de andamio principales con respecto a Tluc intravesicular en diferentes tipos de células productoras. El valor dentro de la parcela se refiere al porcentaje de Tluc intravesicular. Los resultados se muestran como media ± desviación estándar de tres réplicas biológicas. b Número de proteínas de clasificación de EV identificadas para cada tipo de célula productora y superposición entre tipos de células. c Rango de las 24 proteínas clasificadoras de EV conservadas con respecto a la Tluc intravesicular en cada tipo de célula. El valor indica el rango en cada tipo de celda así como el promedio del mismo. d Topología y ubicación subcelular de las 24 proteínas clasificadoras de EV conservadas. Creado con BioRender.com. (ef) Red de interacción de las 24 proteínas de clasificación de EV conservadas recuperadas de STRING (e) y IntAct (f) bases de datos. Grosor de línea en paneles (e, f) indica la solidez del respaldo de los datos, y la línea más gruesa indica evidencia más sólida. Las proteínas están marcadas con nombres de genes. Los datos de origen se proporcionan como un archivo de datos de origen.
Para obtener una comprensión más profunda de los mecanismos potenciales que gobiernan la capacidad de clasificación de vehículos eléctricos del subconjunto conservado, se realizaron estudios bioinformáticos. Según la anotación disponible en UniProtKB, solo las tres proteínas calmodulina y ANXA11 son citosólicas, mientras que las proteínas restantes son miembros de la superfamilia de tetraspaninas y se encuentran en el plasma o en la membrana de los endosomas/lisosomas (Fig. 3d). A continuación, evaluamos posibles interacciones entre las 24 proteínas clasificadoras de EV. El interactoma experimental y predicho disponible en la base de datos STRING mostró evidencia débil de la interacción de TSPAN2/TSPAN3 con CD63, y las proteínas calmodulina parecen operar independientemente del resto (Fig. 3e). De manera similar, los resultados de la base de datos IntAct, que incluye interacciones directas e indirectas, sugirieron que el interactoma de TSPAN2 se superpone pobremente con el de las tres tetraspaninas bien caracterizadas CD9/CD63/CD81 (Fig. 3f). Estas predicciones indican que TSPAN2 y TSPAN3 operan en gran medida independientemente entre sí y de otras tetraspaninas.
Los candidatos a clasificación de vehículos eléctricos resultan sólidos en medio de la producción estandarizada de vehículos eléctricos
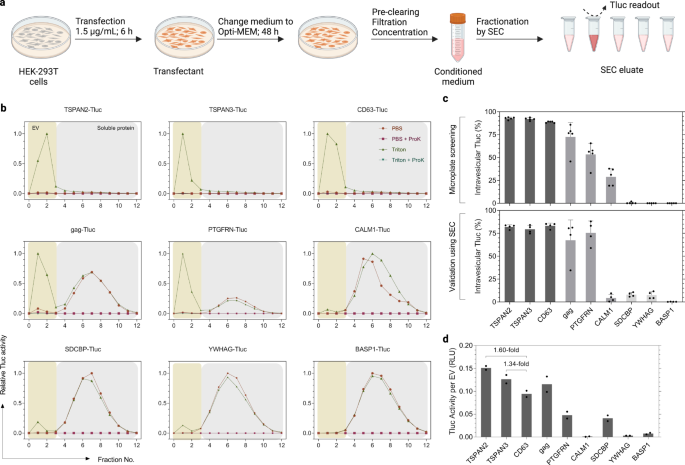
En la selección, las células HEK-293T se cultivaron y se transfectaron en microplacas de 96 pocillos con el fin de lograr un mayor rendimiento. Sin embargo, esa escala no es viable para aplicaciones futuras que busquen producir mayores cantidades de vehículos eléctricos de ingeniería. Además, los medios acondicionados en el cribado se analizaron directamente después de la centrifugación sin ninguna técnica de separación definida. En este caso, estábamos particularmente interesados en los vehículos eléctricos pequeños (sEV, ≤ 200 nm) debido a su potencial terapéutico en muchas enfermedades.36,37. Teniendo esto en cuenta, produjimos vehículos eléctricos según un protocolo estandarizado establecido recientemente por nuestro grupo.38. Las principales diferencias con el protocolo de detección inicial fueron (1) una dosis más alta de plásmidos y una duración de transfección más corta, (2) mantenimiento posterior en Opti-MEM y (3) filtración de medios condicionados a través de una membrana de 200 nm seguida de una concentración paso (Fig. 4a). Además, los sEV se separaron de las proteínas solubles mediante SEC antes de medir la actividad de Tluc y el recuento de vesículas (Fig. 4b). Cabe destacar que la Tluc en el eluato fue completamente desactivada por la Proteinasa K, lo que indica que los agregados de proteínas resistentes no eran motivo de preocupación (Fig. 4b).
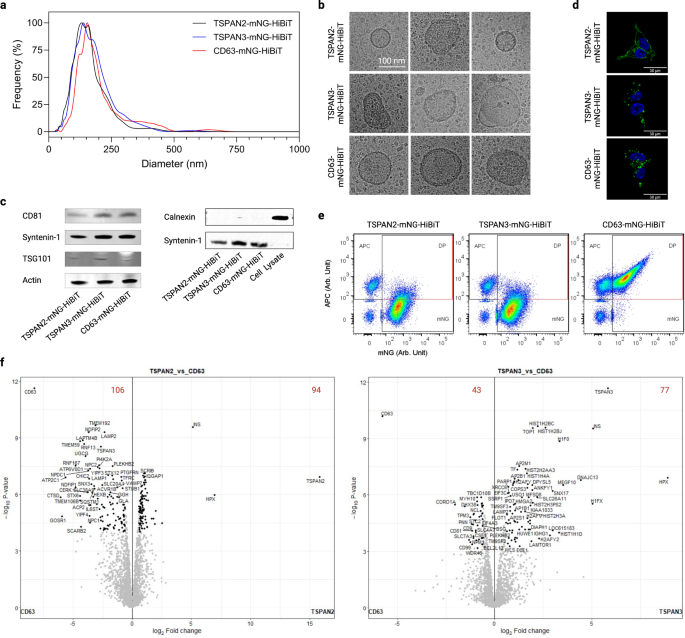
a Flujo de trabajo de producción de vehículos eléctricos y protocolo de fraccionamiento SEC. Creado con BioRender.com. b Perfiles de elución SEC de medios condicionados de células HEK-293T transfectadas. Los vehículos eléctricos y las proteínas solubles se recuperaron en las fracciones 0 a 3 y 4 a 12, respectivamente. La actividad Tluc en cada fracción se midió con y sin Triton y ProK, y se normalizó a la fracción con la señal más alta. c Porcentaje de Tluc intravesicular utilizando los protocolos de detección (panel superior; cinco réplicas biológicas) y estandarizados (panel inferior; cuatro réplicas biológicas). Media ± desviación estándar. d Actividad Tluc calculada por vesícula para preparaciones de EV purificadas. Los resultados se muestran como un promedio de dos réplicas biológicas. Las proteínas están marcadas con nombres de genes. Los datos de origen se proporcionan como un archivo de datos de origen. Cromatografía de exclusión por tamaño SEC.
Para obtener información sobre la capacidad de clasificación de sEV, se seleccionaron nueve candidatos representativos en función de su desempeño en la selección (Fig. 4c). El porcentaje de Tluc intravesicular generalmente coincidió con el cribado, mostrando una capacidad de clasificación de sEV alta (>80%; TSPAN2, TSPAN3 y CD63) y baja (<15%; SDCBP, YWHAG, BASP1) (Fig. 4c). Curiosamente, CALM1 clasificó solo el 3.7% de Tluc en sEV en comparación con el 28.9% en la selección (P < 0.01, Student de dos caras t prueba). Teniendo en cuenta el número de vesículas, observamos que TSPAN2 y TSPAN3 superaron a CD63 en términos de actividad Tluc por EV (1.60 veces y 1.34 veces, respectivamente; Fig. 4d). En general, estos resultados demuestran que la capacidad de clasificación de estos nueve candidatos se mantuvo prácticamente sin cambios cuando se siguió un protocolo de producción de sEV estandarizado.
Los candidatos a clasificación de vehículos eléctricos resultan versátiles para diferentes cargas
Luciferase es un reportero fácil para cuantificar vehículos eléctricos diseñados en masa. Sin embargo, para obtener más información sobre la cantidad de vehículos eléctricos diseñados y la abundancia de proteínas de carga por vehículo eléctrico, el método de elección es la citometría de flujo de imágenes de vesícula única.39,40. Por lo tanto, para las nueve proteínas candidatas exploradas anteriormente, Tluc se reemplazó con un indicador híbrido que consiste en la proteína fluorescente mNeonGreen (mNG; 26.6 kDa) fusionada a HiBiT.41, un péptido de 11 unidades de la luciferasa Nluc dividida (Fig. 5a).
a Flujo de trabajo de producción y análisis de vehículos eléctricos. Creado con BioRender.com. b HiBiT intravesicular en relación con el CD63 de referencia. y no detectado. c Porcentaje de HiBiT intravesicular. En b, c, los resultados se muestran como media ± desviación estándar de cuatro réplicas biológicas. Los resultados del cribado de las células HEK-293T se volvieron a representar gráficamente como referencia. d Gráficos de puntos de citometría de flujo de vesícula única de vehículos eléctricos marcados con mNG-HiBiT. e Concentración e intensidad de fluorescencia media (MFI) de vehículos eléctricos mNG positivos. Los resultados se muestran como media ± desviación estándar de tres réplicas biológicas. Las proteínas están marcadas con nombres de genes. Los datos de origen se proporcionan como un archivo de datos de origen.
La comparación de las actividades de luciferasa intravesicular de HiBiT y Tluc reveló eficiencias de ingeniería comparables para TSPAN3, TSPAN2 y CD63 en términos de cantidad (Fig. 5b) y porcentaje (Fig. 5c). Usando mNG para observar el nivel de vesícula única, TSPAN3 y TSPAN2 produjeron la mayor cantidad de vehículos eléctricos diseñados, superando a CD63 en aproximadamente tres veces y alcanzando niveles similares de mNG por vehículo eléctrico diseñado (Fig. 5d, e). Además, demostramos que mNG se co-localizó con las respectivas proteínas de clasificación en los vehículos eléctricos después de la tinción con anticuerpos, lo que es indicativo de proteínas de fusión intactas (Figura complementaria). 3). Sorprendentemente, las mediciones basadas en HiBiT y Tluc difirieron mucho para la mordaza (Fig. 5b, c); sin embargo, sus niveles de mNG no mostraron tal discrepancia (Fig. 5d, e). Esto nos llevó a postular que la configuración estérica de gag-mNG-HiBiT prohíbe que HiBiT forme complejos con su subunidad asociada para formar luciferasa funcional. Además, CALM1 mostró niveles bajos de HiBiT y mNG vesiculares, en línea con la tendencia observada para CALM1-Tluc en experimentos de validación SEC (Fig. 4c). Estos resultados sugieren que CALM1 se clasifica preferentemente en vesículas más grandes (>200 nm) que se eliminan durante el paso de filtración (Figura complementaria). 4).
Además, evaluamos el desempeño de estas proteínas seleccionadas en células Freestyle 293-F, que son una fuente importante para la producción de EV debido a un procedimiento de propagación menos tedioso. Nuevamente, TSPAN3 y TSPAN2 superaron a CD63 en un 82% y 50%, respectivamente, en términos de HiBiT intravesicular (Figura complementaria). 5a). A nivel de vesícula única, la concentración más alta de vesículas positivas para mNG fue producida por células Freestyle 3-F diseñadas con TSPAN2 y TSPAN293 (Figura complementaria. 5b). En conjunto, los resultados conciliados basados en los reporteros mNG-HiBiT y Tluc refuerzan la confiabilidad del protocolo de detección y resaltan la sólida capacidad de clasificación de EV de las proteínas candidatas para diferentes cargas.
Firmas moleculares distintas entre los vehículos eléctricos diseñados con tetraspanina
A lo largo de todos los experimentos, TSPAN2 y TSPAN3 aparecieron entre las mejores proteínas de clasificación de EV, aparentemente con un mejor rendimiento que la bien caracterizada tetraspanina CD63. En particular, diferentes isoformas de empalme de TSPAN2 y TSPAN3 no lograron retener la capacidad de clasificación de EV en las células HEK293-T (Fig. 6). Dado que, hasta donde sabemos, este es el primer informe de estas proteínas para la ingeniería endógena de vehículos eléctricos, caracterizamos con mayor detalle las características fisicoquímicas de los vehículos eléctricos diseñados con TSPAN2 y TSPAN3 en relación con los vehículos eléctricos diseñados con CD63.
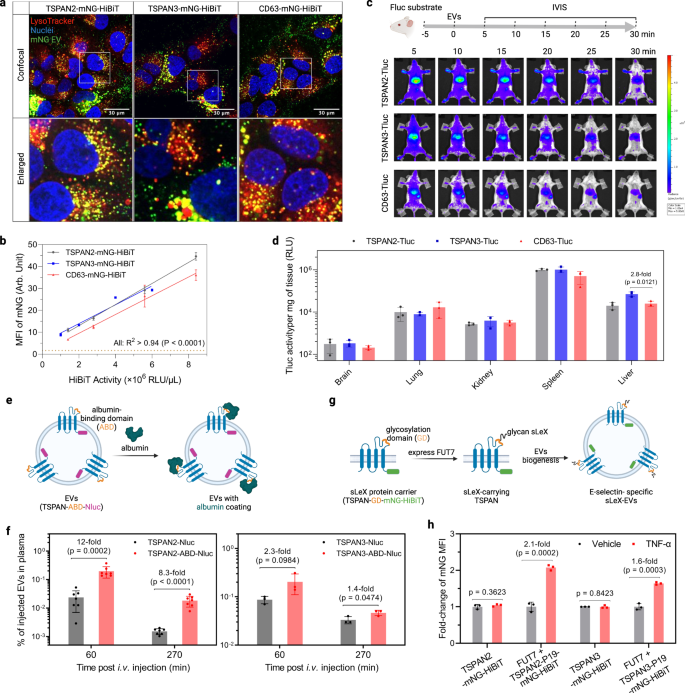
El análisis de seguimiento de nanopartículas de preparaciones de EV a partir de células HEK-293T transfectadas reveló una distribución de tamaño estrecha con diámetros hidrodinámicos medios de aproximadamente 120 nm (Fig. 6a). Además, sus apariencias morfológicas eran típicas de los vehículos eléctricos, como lo ejemplifica la estructura y el tamaño de la membrana (Fig. 6b). Además, se detectaron en los vehículos eléctricos marcadores EV comunes como CD81, syntenin-1 y TSG101, pero no el marcador negativo Calnexin (Fig. 6c). Aparte de eso, examinamos la ubicación de las tres proteínas tetraspaninas en células transfectadas para comprender mejor la biogénesis de los vehículos eléctricos. Mientras que TSPAN2 se localizó tanto en la membrana plasmática como en el citosol de las células productoras, TSPAN3 y CD63 se detectaron principalmente como señales puntiformes dentro de las células (Fig. 6d). Además, la producción de todos los tipos de vehículos eléctricos diseñados fue resistente a la inhibición de la ceramida (Figura complementaria). 7a), que es un impulsor de una vía reconocida de producción de exosomas1,42.
a Distribución de tamaño de vehículos eléctricos de células HEK-293T transfectadas. b Imágenes representativas de microscopía crioelectrónica de vehículos eléctricos. c Western blots de marcadores positivos y negativos de vehículos eléctricos. d Ubicación celular de tetraspaninas en células HEK-293T transfectadas. e Gráficos de puntos de citometría de flujo de vesícula única de vehículos eléctricos después de la tinción con anticuerpos de tetraspanina CD9/CD63/CD81 conjugados con APC. f Gráficos de volcanes que muestran proteínas enriquecidas diferencialmente en vehículos eléctricos. Los dígitos rojos indican el recuento de proteínas enriquecidas diferencialmente. Los resultados fueron de tres réplicas biológicas. Los datos de origen se proporcionan como un archivo de datos de origen. Los datos de proteómica de espectrometría de masas se depositaron en el Consorcio ProteomeXchange a través del repositorio de socios PRIDE con el identificador de conjunto de datos PXD043840.
Para comprender sus firmas proteicas, los vehículos eléctricos se tiñeron con los marcadores clásicos de superficie CD9/CD63/CD81 y se analizaron a nivel de una sola vesícula. La sobreexpresión de las tetraspaninas afectó de manera diferente el rendimiento de los EV totales (definidos como todos los eventos fluorescentes, figura complementaria. 7b) y vehículos eléctricos de ingeniería (definidos como mNG+ eventos, figura complementaria. 7c). Más interesante aún, sólo una pequeña fracción de los vehículos eléctricos diseñados con TSPAN2 y TSPAN3 mostraban los tres marcadores clásicos de vehículos eléctricos en la superficie (Fig. 6e). Además, análisis de expresión de superficie EV de 39 proteínas mediante citometría de flujo basada en perlas múltiples43 reveló que la composición del epítopo de superficie de los vehículos eléctricos positivos para TSPAN2 difería de la de los vehículos eléctricos positivos para CD9/CD63/CD81 (Fig. 7d). Además de las proteínas de superficie, los análisis proteómicos en profundidad de los vehículos eléctricos mostraron una gran cantidad de proteínas enriquecidas diferencialmente para TSPAN2 (106 enriquecidas y 94 enriquecidas) y TSPAN3 (43 desenriquecidas y 77 enriquecidas) en comparación con los vehículos eléctricos diseñados con CD63. CD9/CD63/CD81 se encontraban entre las proteínas que estaban significativamente reguladas a la baja en los vehículos eléctricos diseñados con TSPAN2/TSPAN3, lo que está en línea con los resultados obtenidos de la citometría de flujo de una sola vesícula y basada en perlas. Según el análisis de ontología genética, en comparación con los vehículos eléctricos de tipo salvaje de células HEK293T, los tres tipos de vehículos eléctricos diseñados (CD63, TSPAN2 y TSPAN3) se enriquecieron (>10 %) con enzimas de interconversión de metabolitos, enzimas modificadoras de proteínas y proteínas del metabolismo del ARN. , pero agotadas (>10%) de proteínas de la matriz extracelular (Fig. 8). A continuación, comparamos la composición proteica general con una herramienta de análisis de agrupamiento principal y observamos que los vehículos eléctricos diseñados eran diferentes de los vehículos eléctricos de tipo salvaje y, en menor medida, también entre sí (Figura complementaria. 7e). Curiosamente, en relación con los WT EV, la sobreexpresión de TSPAN2 afectó negativamente a los niveles de CD63 y TSPAN3, lo que podría indicar una relación competitiva. La sobreexpresión de TSPAN3, por otro lado, condujo a un ligero aumento en los niveles de CD63, lo que sugiere una regulación positiva (Figura complementaria). 7f). En general, estos hallazgos ilustran que la ingeniería basada en TSPAN2/TSPAN3 da lugar a subpoblaciones de vehículos eléctricos distintas de CD63.
Vehículos eléctricos diseñados por TSPAN2 y TSPAN3 como modalidades de entrega
Para explorar si los vehículos eléctricos diseñados con TSPAN2/TSPAN3 son adecuados para la administración celular, investigamos su potencial de administración in vitro e in vivo. Primero, las células Huh-7 se trataron con EV marcados con mNG para examinar su ubicación subcelular en las células receptoras. La fuerte señal punteada de color amarillo indicó claramente una internalización y tráfico eficientes hacia los lisosomas (Fig. 7a). La cuantificación del MFI celular mediante citometría de flujo reveló eficiencias de absorción ligeramente mejores para los vehículos eléctricos diseñados con TSPAN2/TSPAN3 en comparación con los vehículos eléctricos diseñados con CD63 (Fig. 7b). Para los estudios de distribución de EV en ratones, se administraron por vía intravenosa cantidades iguales de EV diseñados (basados en la actividad de Tluc) y se rastrearon en tiempo real con un sistema de imágenes in vivo (Fig. 9a y la figura 7c). Para los tres tipos de vehículos eléctricos diseñados, observamos una rápida distribución al hígado y al bazo en 5 minutos (Fig. 7c) y una disminución notable en la actividad de todo el cuerpo durante 30 minutos (Figura complementaria. 9c, P = 0.0006, prueba de Kruskal-Wallis). Los vehículos eléctricos diseñados con TSPAN2 y TSPAN3 parecían conferir una retención de todo el cuerpo ligeramente mayor que los vehículos eléctricos diseñados con CD63 (Figura complementaria). 9b). Los resultados de mediciones ex vivo posteriores respaldaron la acumulación hepática y esplénica dominante de vehículos eléctricos diseñados (Fig. 7d). En conjunto, al igual que los vehículos eléctricos diseñados con CD63, los vehículos eléctricos diseñados con TSPAN2 y TSPAN3 son absorbidos eficientemente por las células in vitro e in vivo.
a Las células Huh-7 se trataron con EV durante 4 h y se tiñeron con LysoTracker para visualizar los lisosomas. Se muestran imágenes de microscopía confocal de regiones representativas de todo el pozo. El experimento se realizó una vez. b Las células Huh-7 se trataron con vehículos eléctricos durante 8 h. La mNG MFI celular se cuantificó mediante citometría de flujo. Los datos se muestran como media ± desviación estándar de tres réplicas biológicas. El grado de correlación se analizó con regresión lineal y se muestra como bondad de ajuste (R2) y significado de la pendiente distinta de cero (P). c Biodistribución de vehículos eléctricos en ratones. A los ratones NMRI se les inyectó por vía intraperitoneal d-sustrato de luciferina. Cinco minutos más tarde, a los ratones se les inyectó por vía intravenosa la misma cantidad de vehículos eléctricos diseñados (según la actividad de Tluc) y se les tomaron imágenes con IVIS. Posteriormente, se recogieron los órganos principales para realizar mediciones de bioluminiscencia ex vivo. Se muestran imágenes IVIS representativas. N = 3. d Actividad de Tluc en órganos ex vivo después de IVIS. Los resultados se muestran como media ± desviación estándar de tres ratones. e Esquema de generación de vehículos eléctricos de unión a albúmina. Los vehículos eléctricos se recolectaron de células HEK-293T que expresaban de manera estable las proteínas de fusión. f Se inyectaron EV que se unen a albúmina por vía intravenosa y se determinó su concentración en plasma. Los datos se muestran como media ± desviación estándar. N = 7 (para relacionado con TSPAN2) o 3 (para relacionado con TSPAN3). g Esquema de visualización sLeX en vehículos eléctricos. Los vehículos eléctricos se recolectaron de células HEK-293T que expresaban de manera estable los componentes. h Las células HUVEC fueron activadas por TNF-α durante 2 h y tratadas con EV durante 6 h. El mNG MFI celular se cuantificó mediante citometría de flujo y se muestra como cambio en células no activadas. c, e, g Creado con BioRender.com. Los datos se muestran como media ± desviación estándar de tres réplicas biológicas. Estudiante de dos caras t prueba. Los datos de origen se proporcionan como un archivo de datos de origen.
Después de haber mostrado ampliamente la capacidad de carga y entrega de TSPAN2 y TSPAN3 para carga luminal, a continuación investigamos su potencial para aplicaciones de visualización de superficie de vehículos eléctricos. Los grandes bucles extracelulares (LEL) de algunas tetraspaninas ya se han explotado para tales aplicaciones y, dadas las similitudes topológicas de las proteínas tetraspaninas, intentamos diseñar los LEL de TSPAN2 y TSPAN3. Se ha demostrado que la inserción de un dominio de unión a albúmina (ABD) en el LEL de CD63, CD9 y CD81 extiende drásticamente el tiempo de circulación plasmática de los vehículos eléctricos.44. Utilizando la misma estrategia, se clonó un ABD en el LEL de TSPAN2 y TSPAN3 con Nluc en el extremo C para su cuantificación (Fig. 7e). Los vehículos eléctricos se recogieron de células HEK-293T que expresaban de forma estable proteínas de fusión TSPAN-ABD-Nluc (Fig. 9c) y evaluados por su capacidad de unión a albúmina. Como era de esperar, sólo los EV que muestran ABD se unen a la albúmina (Figura complementaria. 9d). A continuación, estos vehículos eléctricos se inyectaron por vía intravenosa en ratones y se midieron las concentraciones de vehículos eléctricos en plasma basándose en Nluc en diferentes momentos. En comparación con los vehículos eléctricos modificados con tetraspanina de tipo salvaje, los vehículos eléctricos con ABD tenían una concentración significativamente mayor en plasma, particularmente cuando se usaba TSPAN2 como proteína de andamio (Fig. 7f).
En otro ejemplo, nuestro objetivo fue lograr un direccionamiento específico de células endoteliales activadas mediante la visualización en superficie del ligando de glucano sialil Lewis X (sLeX).45. Por lo tanto, se insertó un portador peptídico sLeX de 19 unidades (P19) en el LEL de cada proteína tetraspanina con mNG-HiBiT en el extremo C-terminal. En presencia de fucosiltransferasa VII (FUT7), P19 se glicosila para mostrar sLeX (Fig. 7g). Con base en este razonamiento, se produjeron sLeX-EV a partir de células HEK-293T que expresaban de manera estable FUT7 y TSPAN-P19-mNG-HiBiT (Fig. 9c). Su absorción se evaluó en células endoteliales activadas por TNF-α, que expresan E-selectina, el principal receptor de sLeX. Los vehículos eléctricos modificados con tetraspanina de tipo salvaje se absorbieron de manera similar en células endoteliales activadas y no activadas, mientras que los vehículos eléctricos sLeX, que utilizaron TSPAN2 o TSPAN3 como armazón, demostraron una absorción preferible por parte de las células endoteliales activadas (Fig. 7h). En general, esto demuestra la viabilidad de TSPAN2 y TSPAN3 en términos de ingeniería simultánea del LEL para visualización en superficie y el extremo C para carga luminal, destacando así su potencial para aplicaciones terapéuticas.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Automoción / vehículos eléctricos, Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- Desplazamientos de bloque. Modernización de la propiedad de compensaciones ambientales. Accede Aquí.
- Fuente: https://www.nature.com/articles/s41467-023-40453-0