Introducción
En abril, investigadores en China informaron que habían iniciado embarazos en monos a través de un procedimiento aparentemente muy parecido a la fertilización in vitro (FIV), en el que los embriones creados en un plato se implantaron en los úteros de monos cynomolgus. No parecía nada extraordinario en eso, excepto que no se trataba de una FIV genuina, porque los embriones no habían sido producidos por fertilización. Habían sido construidos desde cero a partir de células madre embrionarias de mono, sin óvulos ni espermatozoides involucrados. No eran embriones reales en absoluto, sino lo que muchos investigadores llaman modelos de embriones (o, a veces, "embriones sintéticos").
El equipo multiinstitucional de investigadores, dirigido por zhenlu en el Laboratorio Estatal Clave de Neurociencia en Shanghái, crecieron los modelos de embriones in vitro a una etapa de desarrollo de aproximadamente nueve días, lo que los hace equivalentes a lo que se llama un blastocisto en embriones normales. Luego transfirieron los modelos a ocho monos hembra. En tres de los monos, los modelos se implantaron con éxito en el útero y continuaron desarrollándose. Sin embargo, ninguno de los embarazos duró más de unos pocos días antes de terminar espontáneamente.
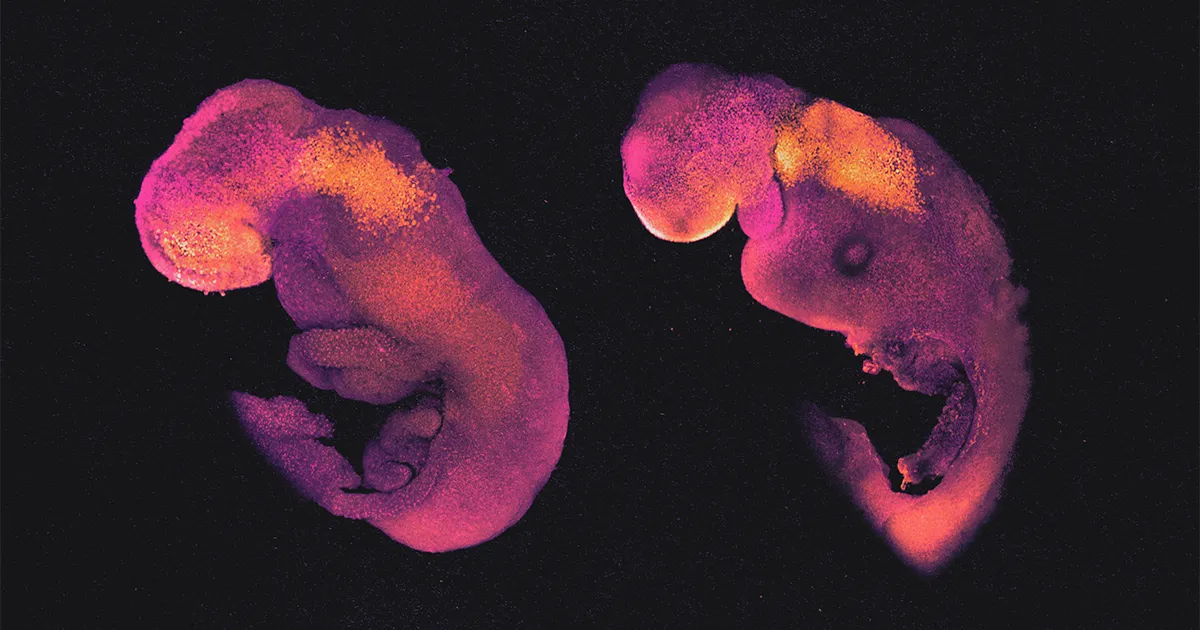
Mientras tanto, otros grupos de investigación mostraron el año pasado hasta qué punto estos modelos de embriones hechos de células madre pueden convertirse en organismos completos. Equipos dirigidos por Magdalena Zernicka-Goetz en la Universidad de Cambridge y por jacob hanna en el Instituto de Ciencias Weizmann en Rehovot, Israel, las hicieron a partir de células madre de ratón y las cultivaron en botellas de vidrio giratorias llenas de nutrientes, que actuaban como una especie de útero artificial tosco. Después de unos ocho días, fue posible distinguir el eje central que, en un embrión normal, se convertiría en una columna vertebral, junto con la burbuja bulbosa de la cabeza naciente e incluso un corazón palpitante primitivo. Tendrías que ser un experto para distinguir estas entidades vivas de los embriones de ratón reales en una etapa de desarrollo comparable.
Nadie está completamente seguro de qué son los modelos de embriones (biológica, ética o legalmente) o en qué podrían convertirse en última instancia. Podrían ser inmensamente útiles para la investigación, revelando aspectos de nuestros procesos de desarrollo que antes estaban fuera del alcance de los experimentos. Es posible que algún día incluso se utilicen para proporcionar tejidos y órganos en miniatura para trasplantes quirúrgicos. Pero también plantean profundas cuestiones éticas y filosóficas.
Introducción
Hasta hace poco, los modelos de embriones tenían solo un parecido incompleto con los embriones reales, y solo en las etapas más tempranas de crecimiento. Pero los últimos experimentos de Zernicka-Goetz, Hanna y otros, incluidos los experimentos de implantación en Shanghai, ahora nos obligan a preguntarnos qué tan bien y hasta qué punto estas entidades pueden recrear el crecimiento de embriones naturales. Incluso si actualmente es una perspectiva hipotética lejana, algunos investigadores no ven ninguna razón por la que los modelos de embriones no puedan eventualmente tener el potencial de convertirse en un bebé.
No hay una razón científica o médica clara para permitirles hacer eso, y muchas razones éticas y legales para no hacerlo. Pero incluso su uso como herramientas experimentales plantea preguntas urgentes sobre su regulación. ¿Hasta dónde se debe permitir que se desarrollen los modelos de embriones antes de que detengamos el trabajo? Actualmente no existen regulaciones claras que restrinjan su creación, ni ningún consenso sobre cómo deberían ser las nuevas regulaciones. Por prometedores que sean los modelos de embriones, plantean preocupaciones de que la investigación se está adelantando a nuestra capacidad para decidir sobre sus límites éticos.
“Los modelos de embriones tienen la promesa, o la amenaza, no solo de crear un modelo realista del desarrollo de algunas partes de órganos humanos importantes, sino de conducir a modelos realistas para todos los órganos y tejidos humanos”, dijo. Hank Greely, profesor de derecho y presidente del comité directivo del Centro de Ética Biomédica de la Universidad de Stanford, "y potencialmente, de crear nuevos bebés".
Pero más allá de las preocupaciones éticas, los modelos de embriones plantean preguntas sobre la definición misma de personalidad y lo que cuenta como humano. Ellos desafían la forma en que pensamos acerca de lo que somos.
Introducción
Repensar la regla de los 14 días
Los libros de texto describen con confianza cómo un óvulo humano fertilizado progresa gradualmente desde una bola uniforme de células hasta un embrión implantado con forma de camarón y un feto reconociblemente humano. Pero sabemos muy poco sobre ese proceso porque algunos detalles no se pueden estudiar en el útero sin comprometer la seguridad del embrión. Y en muchos países, es legal que los embriones humanos se cultiven y estudien in vitro solo hasta 14 días, después de lo cual deben eliminarse.
Ese punto de dos semanas es cuando ocurre una de las etapas más cruciales del desarrollo, llamada gastrulación. Como biólogo del desarrollo Luis Wolpert decirlo: "No es el nacimiento, el matrimonio o la muerte, sino la gastrulación, que es verdaderamente el momento más importante de su vida". Es entonces cuando la mancha casi sin rasgos distintivos de las células embrionarias comienza a plegarse y reorganizarse para adquirir los primeros indicios de la estructura corporal. Las células comienzan a especializarse en los tejidos que formarán los nervios, los órganos internos, el intestino y más. Un surco central llamado racha primitiva se desarrolla como precursor de la columna vertebral, definiendo el eje central de simetría bilateral del cuerpo naciente.
En 1990, siguiendo los informes del Departamento de Salud, Educación y Bienestar de EE. UU. y el Comité Warnock del Reino Unido años antes, muchos países decidieron que la formación de la racha primitiva a los 14 días debería marcar el límite del tiempo que los embriones humanos podrían mantenerse in vitro. . Esta regla de los 14 días se implementó posteriormente en las directrices de las Sociedad Internacional para la Investigación con Células Madre, que son ampliamente seguidos por científicos de todo el mundo. Durante décadas, fue una restricción cómoda, ya que los embriones humanos generalmente dejaban de crecer in vitro después de solo cinco o seis días, alrededor de la etapa en la que normalmente se implantarían en el revestimiento del útero.
Sin embargo, en 2016, el equipo de Zernicka-Goetz en Cambridge y el biólogo del desarrollo Ali Brivanlou en la Universidad Rockefeller y sus colegas demostraron que podían cultivar embriones de ratón FIV todo el camino hasta la etapa de gastrulación, utilizando una matriz de gel de polímero suave como una especie de sustituto uterino.
Además, Hanna y sus compañeros de trabajo demostraron en 2021 que podían cultivar embriones naturales de ratón in vitro. mucho más allá de la gastrulación. Usando su biorreactor rotatorio, en el que los embriones se mantuvieron en una solución nutritiva y una atmósfera con niveles de oxígeno y dióxido de carbono controlados con precisión, el equipo cultivó embriones de ratón durante 12 días, la mitad del período de gestación completo de los ratones. Hanna cree que la tecnología también podría funcionar con embriones humanos y tal vez podría hacerlos crecer durante muchas semanas, si los objetivos de la ciencia justifican el proyecto de manera responsable y la ley no lo prohíbe.
Reconociendo el nuevo potencial para encontrar información útil sobre cómo se desarrollan los embriones humanos después de la gastrulación, la Sociedad Internacional para la Investigación de Células Madre revisó sus pautas en 2021. Ahora recomienda que el límite de 14 días para la investigación con embriones humanos se relaje en un caso. caso por caso si se puede hacer un buen caso científico para extenderlo. Ningún país ha modificado aún sus leyes para aprovechar esa latitud.
Introducción
Los modelos de embriones podrían ofrecer una forma de seguir ese camino con aún menos restricciones legales y éticas. No se consideran legalmente embriones porque no tienen el potencial de convertirse en organismos viables. Entonces, incluso bajo las pautas y regulaciones actuales en muchos países, si los modelos de embriones se pueden cultivar a través de la gastrulación y más allá, podría ser legal por primera vez estudiar experimentalmente el desarrollo humano y tal vez conducir a una mejor comprensión de los defectos que causan abortos espontáneos o deformidades.
Pero si los modelos de embriones pueden crecer tanto, ¿en qué momento dejan de ser modelos y se vuelven equivalentes a la realidad? Cuanto mejores y más avanzados se vuelven los modelos, más borrosos se vuelven los límites biológicos y éticos.
Ese dilema era hipotético cuando los modelos de embriones solo podían recapitular las primeras etapas de desarrollo. ya no lo es
Convertir células madre en embriones
Los modelos de embriones generalmente se fabrican a partir de células madre embrionarias, células "pluripotentes" derivadas de embriones tempranos que pueden convertirse en cualquier tipo de tejido del cuerpo. Cuando un embrión alcanza la etapa de blastocisto, alrededor del día 5 o 6 en el desarrollo humano, consta de varios tipos de células. Su caparazón hueco está hecho de células que formarán la placenta (llamadas células madre trofoblásticas o CET) y el saco vitelino (el endodermo extraembrionario o células XEN). Las células pluripotentes que se convertirán en el feto están confinadas en una mancha en el interior de la pared del blastocisto, y es a partir de ellas que se pueden cultivar las células madre embrionarias.
Los experimentos realizados en la década de 1990 y principios de la de 2000 demostraron que las células madre embrionarias extraídas de un blastocisto y transferidas a otro aún pueden convertirse en un embrión capaz de desarrollarse hasta el nacimiento a término como un animal sano. Pero el apoyo proporcionado por las células TSC y XEN es esencial: las células madre embrionarias por sí solas no pueden pasar los primeros días de desarrollo a menos que estén en un blastocisto.
Sin embargo, investigaciones más recientes muestran que se pueden crear estructuras parecidas a embriones desde cero a partir de los respectivos tipos de células. En 2018, Zernicka-Goetz y sus colegas demostraron que los ensamblajes de células madre embrionarias, TSC y células XEN de ratones podían autoorganizarse en una forma hueca con forma de cáscara de maní y comparable en apariencia a un embrión normal en proceso de gastrulación. A medida que avanzaba la gastrulación, algunas de las células madre embrionarias mostraron signos de volverse más especializadas y móviles como preludio del desarrollo de los órganos internos.
Pero esos primeros modelos de embriones tenían fallas, dijo Zernicka-Goetz, porque las células XEN agregadas estaban en una etapa de desarrollo demasiado avanzada para cumplir completamente su función. Para resolver ese problema, en 2021 su grupo encontró una manera de convertir las células madre embrionarias en células XEN en etapa temprana. “Cuando colocamos [células madre embrionarias], TSC y estas células XEN inducidas juntas, ahora podrían someterse a la gastrulación correctamente e iniciar el desarrollo de los órganos”, dijo.
el verano pasado en Naturaleza, Zernicka-Goetz y sus colaboradores describieron cómo habían usado una incubadora de botellas giratorias para extender el crecimiento de sus modelos de embrión de ratón por otras 24 horas cruciales, hasta el día 8.5. Luego, los modelos formaron "todas las regiones del cerebro, corazones latiendo, etc.", dijo. Su tronco mostraba segmentos que surgían para desarrollarse en diferentes partes del cuerpo. Tenían un tubo neural, un intestino y los progenitores de óvulos y espermatozoides.
En un segundo artículo publicado casi al mismo tiempo en Cell Stem Cell, su grupo indujo células madre embrionarias convertirse en TSC así como células XEN. Esos modelos de embriones, cultivados en la incubadora rotatoria, se desarrollaron en la misma etapa avanzada.
Mientras tanto, el equipo de Hanna en Israel estaba cultivando modelos de embriones de ratón de manera similar, como describieron en un papel en Celular que se publicó poco antes que el artículo del grupo de Zernicka-Goetz. Los modelos de Hanna también se hicieron únicamente a partir de células madre embrionarias, algunas de las cuales habían sido manipuladas genéticamente para convertirse en TSC y células XEN. “Todo el embrión lleno de órganos sintéticos, incluidas las membranas extraembrionarias, puede generarse comenzando solo con células madre pluripotentes ingenuas”, dijo Hanna.
Los modelos de embriones de Hanna, como los realizados por Zernicka-Goetz, pasaron por todas las primeras etapas de desarrollo esperadas. Después de 8.5 días, tenían una forma tosca del cuerpo, con cabeza, brotes de extremidades, corazón y otros órganos. Sus cuerpos estaban unidos a una pseudoplacenta hecha de TSC por una columna de células como un cordón umbilical.
“Estos modelos de embriones recapitulan muy bien la embriogénesis natural”, dijo Zernicka-Goetz. Las principales diferencias pueden ser consecuencias de la formación incorrecta de la placenta, ya que no puede entrar en contacto con el útero. Las señales imperfectas de la placenta defectuosa pueden afectar el crecimiento saludable de algunas estructuras de tejido embrionario.
Sin un mejor sustituto de la placenta, "queda por ver cuánto más se desarrollarán estas estructuras", dijo. Es por eso que cree que el próximo gran desafío será llevar modelos de embriones a través de una etapa de desarrollo que normalmente requiere una placenta como interfaz para los sistemas sanguíneos circulantes de la madre y el feto. Nadie ha encontrado aún la forma de hacerlo in vitro, pero ella dice que su grupo está trabajando en ello.
Hanna reconoció que estaba sorprendido por lo bien que los modelos de embriones continuaron creciendo más allá de la gastrulación. Pero agregó que después de trabajar en esto durante 12 años, “estás emocionado y sorprendido en cada hito, pero en uno o dos días te acostumbras y lo das por sentado, y te enfocas en el próximo objetivo”.
junio wu, un biólogo de células madre del Centro Médico Southwestern de la Universidad de Texas en Dallas, también se sorprendió de que los modelos de embriones hechos solo con células madre embrionarias puedan llegar tan lejos. “El hecho de que puedan formar estructuras parecidas a embriones con una clara organogénesis temprana sugiere que podemos obtener tejidos aparentemente funcionales fuera del útero, basados únicamente en células madre”, dijo.
En otro problema, resulta que los modelos de embriones no tienen que crecer a partir de células madre embrionarias literales, es decir, células madre extraídas de embriones reales. También se pueden cultivar a partir de células maduras tomadas de usted o de mí y regresar a un estado similar al de las células madre. La posibilidad de tal "rejuvenecimiento" de los tipos de células maduras fue la descubrimiento revolucionario del biólogo japonés Shinya Yamanaka, que le valió una parte del Premio Nobel 2012 en Fisiología o Medicina. Estas células reprogramadas se denominan células madre pluripotentes inducidas y se fabrican mediante la inyección de células maduras (como las células de la piel) con algunos de los genes clave activos en las células madre embrionarias.
Hasta ahora, las células madre pluripotentes inducidas parecen ser capaces de hacer casi todo lo que pueden hacer las células madre embrionarias reales, incluido el crecimiento en estructuras similares a embriones in vitro. Y ese éxito parece cortar la última conexión esencial entre los modelos de embriones y los embriones reales: no se necesita un embrión para hacerlos, lo que los coloca en gran medida fuera de las regulaciones existentes.
Cultivo de órganos en el laboratorio
Incluso si los modelos de embriones tienen una similitud sin precedentes con los embriones reales, todavía tienen muchas deficiencias. Nicolás Rivron, bióloga de células madre y embrióloga del Instituto de Biotecnología Molecular de Viena y colaboradora de Zernicka-Goetz, reconoce que “los modelos embrionarios son rudimentarios, imperfectos, ineficientes y carecen de la capacidad de dar lugar a un organismo vivo”.
La tasa de fracaso para los modelos de embriones en crecimiento es muy alta: menos del 1% de los grupos de células iniciales llegan muy lejos. Anomalías sutiles, en su mayoría relacionadas con el tamaño desproporcionado de los órganos, a menudo las eliminan, dijo Hanna. Wu cree que se necesita más trabajo para comprender tanto las similitudes con los embriones normales como las diferencias que pueden explicar por qué los modelos de embriones de ratón no han podido crecer más allá de los 8.5 días.
Aún así, Hanna confía en que podrán extender ese límite mejorando el dispositivo de cultura. “Actualmente podemos cultivar embriones de ratón [FIV] ex utero hasta el día 13.5; el equivalente para los embriones humanos será alrededor del día 50 a 60”, dijo. “Nuestro sistema abre la puerta”.
Agregó: “Cuando se trata de estudiar el desarrollo humano temprano, creo que esta es la única forma posible”.
marta shahbazi, un biólogo celular de Cambridge que trabaja en embriogénesis, está de acuerdo. “Para los humanos, un sistema equivalente [a los modelos de embriones de ratón] sería realmente útil, porque no tenemos una alternativa in vivo para estudiar la gastrulación y la organogénesis temprana”, dijo.
Introducción
Queda por ver si esto se puede hacer con células humanas. “Todavía nos estamos recuperando del impacto de que se puede hacer en ratones”, dijo Hanna. Pero tanto él como Zernicka-Goetz dijeron que se sintieron alentados por los resultados que ya estaban viendo en sus respectivos laboratorios con modelos de embriones tempranos cultivados a partir de células madre humanas. “Este es solo el comienzo de un largo camino de aprendizaje y descubrimiento”, dijo Hanna.
En teoría, los modelos de embriones humanos que crecen hasta una etapa avanzada de desarrollo podrían convertirse en fuentes de órganos para trasplantes e investigación. “Aunque los embrioides sintéticos que hacemos se distinguen de los embriones naturales”, dijo Hanna, “todavía tienen todos los órganos y en la posición correcta”.
Las células madre embrionarias y pluripotentes inducidas in vitro actualmente pueden guiarse para que crezcan en órganos en miniatura rudimentarios (o "organoides”) de páncreas, riñón y incluso tejido cerebral. Pero los organoides normalmente no logran reproducir con precisión la estructura de los órganos reales, probablemente porque carecen de señales esenciales y componentes multicelulares que surgirían naturalmente en embriones reales. “Anticipamos que estos defectos podrían corregirse generando estructuras que recapitulen los procesos naturales que ocurren en el desarrollo”, dijo Zernicka-Goetz.
Hanna cree que los modelos de embriones también podrían usarse para identificar objetivos farmacológicos y detectar nuevas terapias, en particular para problemas reproductivos como infertilidad, pérdida de embarazos, endometriosis y preeclampsia. “Esto brinda una alternativa ética y técnica al uso de embriones, ovocitos o materiales derivados del aborto y es consistente con las últimas pautas de ISSCR”, dijo. Ya ha fundado una empresa para probar posibles aplicaciones clínicas de modelos de embriones humanos.
Pero Alfonso Martínez Arias, biólogo del desarrollo de Cambridge y la Universidad Pompeu Fabra de Barcelona que estudia el papel de las células madre embrionarias en el desarrollo de los mamíferos, subraya que tales aplicaciones siguen sin probarse. Piensa que es difícil ver cuánto se podría entender sobre las cuestiones del crecimiento embrionario real a partir del desarrollo de una versión tan distorsionada.
Además, dijo, nada de esto se ha demostrado aún en humanos. “No creo que debamos avanzar un campo con ilusiones, sino con hechos”, dijo.
La frontera ética
Mientras los modelos de embriones sigan siendo solo modelos, es posible que su uso en investigación y medicina no suscite mucha controversia. “Un principio ético básico llamado subsidiariedad estipula que un objetivo científico o biomédico debe lograrse de la manera menos moralmente problemática”, dijo Rivron. Para la investigación sobre problemas de salud global como la planificación familiar, dijo, los estudios de modelos de embriones parecen una alternativa menos desafiante desde el punto de vista ético que el trabajo con embriones de FIV.
“Debemos recordar que los embriones sintéticos no son embriones reales”, dijo Hanna. Hasta ahora, carecen del potencial crucial para convertirse en un verdadero feto, y mucho menos en un bebé: si se implantan en ratones, no se desarrollan más.
Pero la capacidad para un mayor desarrollo es fundamental para el estatus ético de los modelos de embriones, y no hay garantía de que persistirá su incapacidad actual para producir fetos y nacimientos vivos.
Rivron está de acuerdo en que el trabajo en modelos de embriones que él y otros están haciendo podría conducir a una nueva tecnología reproductiva. “Podemos prever que los modelos de embriones más completos en algún momento se volcarán para convertirse en embriones que darán lugar a individuos”, dijo. “Creo que estos individuos deberían tener pleno derecho como seres, independientemente de la forma en que se formaron”.
Por esa razón, está trabajando con especialistas en ética para dar forma a un marco ético para estos estudios. “Intentar utilizar embriones humanos formados a partir de células madre para la reproducción asistida podría ser posible algún día”, dijo, “pero requeriría una discusión previa exhaustiva y una evaluación sobre si es seguro, social y éticamente justificable y deseable”.
Pero los problemas éticos no surgen solo si la tecnología se usa para la reproducción humana. Greely cree que "si un modelo de embrión es 'suficientemente similar' a un embrión humano 'normal', debe tratarse como un embrión humano a efectos legales y reglamentarios, incluidos, entre otros, la regla de los 14 días o cualquier revisión de eso.”
¿Qué cuenta como suficientemente similar? Ese criterio se cumpliría, dijo, “si el modelo de embrión tiene una probabilidad significativa de poder producir un bebé humano vivo”.
El problema es que podría ser muy difícil saber con certeza si ese es el caso a menos que se implante un modelo de embrión humano en un útero. La única forma de determinar el estado ético de tal entidad podría entonces ser poco ético.
Sin embargo, un trabajo como el del equipo chino con modelos de embriones de mono podría eliminar esa incertidumbre. Si estas entidades similares a embriones pueden inducir embarazos y algún día producir descendencia en monos, podríamos inferir razonablemente que los modelos de embriones humanos equivalentes también podrían hacerlo. En un comentario en ese trabajo, Inso Hyun, el director de ética de la investigación en el Centro de Bioética de la Facultad de Medicina de Harvard, escribió: "Es en este punto que los modelos de embriones humanos podrían considerarse tan precisos que equivaldrían a ser funcionalmente reales".
Tal resultado, aunque solo sea en monos, podría llevar a los reguladores a decidir que los modelos de embriones humanos merecen ser tratados como embriones, con todas las restricciones correspondientes. Algunos investigadores sienten que necesitamos urgentemente una nueva definición de embrión para ofrecer claridad y seguir el ritmo de los avances científicos. Si hay una buena razón para suponer que un modelo de embrión tiene el potencial de generar descendencia viable, tendremos que aceptar las implicaciones regulatorias o encontrar formas de anular ese potencial.
Estos son los dilemas de una técnica que podría desdibujar nuestras viejas ideas sobre lo que califica como humano y sobre cómo se crean las personas. Bartha María Knoppers, profesor y catedrático de investigación en la Universidad McGill en Canadá y una autoridad en ética de la investigación, escribió un comentario para Ciencia: con Greely en el que describieron desarrollos como modelos de embriones como "mordiscos en la definición legal de lo que es un ser humano". Cuanto más descubrimos sobre cómo estamos hechos y cómo podríamos ser, menos claro está que la ciencia pueda aportar claridad a esa pregunta.
Corrección: June 13, 2020
Se agregó la mención del artículo de Zernicka-Goetz de 2016 sobre el cultivo de embriones de ratón FIV en una matriz de gel junto con la cita de un trabajo similar de Brivanlou.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- EVM Finanzas. Interfaz unificada para finanzas descentralizadas. Accede Aquí.
- Grupo de medios cuánticos. IR/PR amplificado. Accede Aquí.
- PlatoAiStream. Inteligencia de datos Web3. Conocimiento amplificado. Accede Aquí.
- Fuente: https://www.quantamagazine.org/embryo-models-challenge-legal-ethical-and-biological-concepts-20230613/



