Los nanomedicamentos basados en polímeros se han diseñado para administrar proporcionalmente tres fármacos diferentes a los tumores, lo que une la correlación in vitro-in vivo y produce una eficacia terapéutica sinérgica en modelos de ratones con mieloma múltiple.
La generación actual de vacunas de ARNm contra COVID-19 se basa en una mezcla de dos nanopartículas lipídicas (LNP) que contienen dos ARNm, coadministradas en una sola inyección. Un ARNm codifica para la proteína de pico viral original del SARS CoV-2 y el otro para la proteína de pico de la variante Omicron BA.1 (o más recientemente, la variante BA.4–5). Estas vacunas bivalentes coadministradas minimizan el escape de anticuerpos y amplían la protección contra el COVID-19 (ref. 1). La coformulación de dos ARNm en un LNP, en lugar de la administración conjunta de dos LNP cargados individualmente con un ARNm, sería posible en principio, pero es probable que esto no agregue mucho valor en las configuraciones de vacunación. Sin embargo, cuando se trata de producir simultáneamente proteínas a nivel de una sola célula, se ha demostrado que "juntos es mejor", especialmente cuando se trata de controlar la expresión de proteínas de forma proporcional.2. Además, la coformulación de dos ARN en un LNP es crucial para la edición eficiente de genes basada en CRISPR. Como se ha demostrado para el tratamiento de la amiloidosis por transtiretina (TTR) en ratones y en pacientes, es necesario coformular en un único LNP el ARN guía único contra la TTR y el ARNm que codifica Cas9 para garantizar la codisponibilidad temporal y espacial de ambos componentes. de la maquinaria de edición de genes3,4.
La coencapsulación de múltiples fármacos en una formulación de nanomedicina no es nueva, ni lo es la coadministración de múltiples nanofármacos de una sola vez. Un ejemplo clave del primero es Vyxeos (CPX-351), que es un liposoma multilamelar que contiene citarabina y daunorrubicina en una relación "ratiométrica" fija de 5:1. En comparación con la combinación convencional de citarabina libre 7+3 más daunorrubicina libre, el doble fármaco liposomal produce una supervivencia general significativamente más prolongada en pacientes con leucemia mieloide aguda secundaria.5. Un ejemplo prototípico de este último, además de las vacunas bivalentes contra el COVID-19, es Copaxone (acetato de glatiramer). Copaxone y su sustituto genérico Glatopa son mezclas estadísticas de polipéptidos de 5 a 9 kDa, basados en los aminoácidos ácido glutámico, lisina, alanina y tirosina, copolimerizados en rangos de fracciones molares fijas. Este ejemplo clásico de un fármaco complejo no biológico (NBCD (ref. 6)) imita partes de la proteína básica de mielina y suprime el daño nervioso mediado por células inmunitarias al promover la autotolerancia. Debido a la complejidad de su composición, los polipéptidos individuales de Copaxone y Glatopa son imposibles de caracterizar. Sin embargo, esto no ha impedido que estas nanoformulaciones de múltiples fármacos se conviertan en medicamentos útiles para controlar la esclerosis múltiple.7.
En este número de Naturaleza Nanotecnología, Detappe, Nguyen y sus colegas llevan la nanomedicina multifarmacológica al siguiente nivel8. Usando polimerización por metátesis de apertura de anillo, fabricaron profármacos de polímeros en cepillo de botella (BPD) de los fármacos contra el mieloma múltiple (MM) bortezomib, pomalidomida y dexametasona (Fig. 1a). Desde el punto de vista clínico, esta mezcla tiene una importancia estratégica, ya que la pomalidomida es más potente que la lenalidomida y ayuda a superar las resistencias al tratamiento triple de primera línea con bortezomib, lenalidomida y dexametasona. Desde el punto de vista de la fabricación, los tres BPD se pueden coformular fácilmente en cantidades proporcionales, produciendo mezclas estadísticas de nanopartículas que contienen fármacos simples, dobles y triples que, cuando se aplican juntas, pueden producir una eficacia sinérgica contra el MM tanto in vitro como in vitro. Vivo.
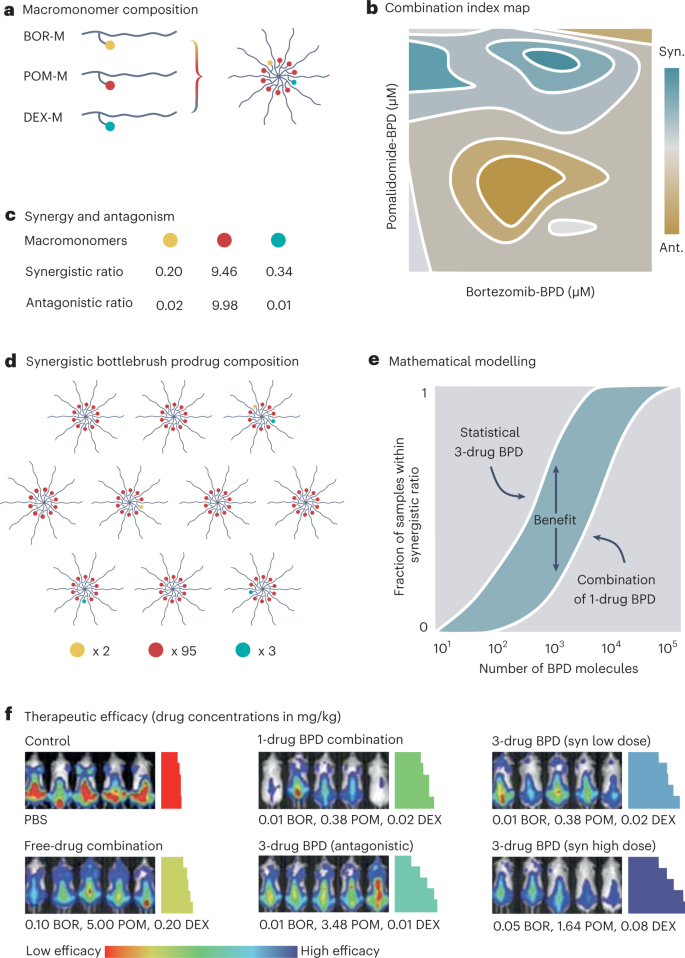
a, Esquema de macromonómeros de un solo fármaco (M), que contienen bortezomib (BOR), pomalidomida (POM) o dexametasona (DEX). Los macromonómeros se pueden copolimerizar en partículas multifármaco de 10 nm de tamaño con una mezcla estadística de los 3 fármacos. b, Evaluación de la sinergia de 3 fármacos a través del análisis del índice de combinación para concentraciones variables de bortezomib-BPD y pomalidomida-BPD a una concentración fija de dexametasona-BPD. c, Identificación de proporciones de fármacos sinérgicos y antagonistas. d, Esquema de la mezcla estadística sinérgica de la coformulación de BPD de 3 fármacos. e, modelo de Monte Carlo que ilustra la superioridad de la coformulación sinérgica de 3 fármacos BPD sobre la combinación de 1 fármaco BPD coadministrado en la misma proporción. f, Representación de la actividad antitumoral mejorada (imágenes de bioluminiscencia) y supervivencia (gráficos de Kaplan-Meier codificados por colores) de coformulaciones sinérgicas de 3 fármacos BPD en comparación con coformulaciones antagónicas de 3 fármacos BPD, coadministración de 1 fármaco BPD, y coadministración gratuita de medicamentos. Paneles b, ey f adaptado de la ref. 8.
La evaluación in vitro de fármacos libres y formulaciones de BPD combinadas ratiométricamente reveló proporciones de profármacos con actividad sinérgica y antagonista (Fig. 1b – c). En el caso del cáncer, a diferencia de las configuraciones de vacunación, la administración conjunta in vivo de fármacos en la misma célula es crucial para producir sinergia. Teniendo en cuenta que un solo BPD de 10 nm de tamaño contiene 10 moléculas de fármaco, y que la proporción sinérgica que induce la muerte celular de MM de manera más eficiente es 0.2, 9.46 y 0.34 para bortezomib, pomalidomida y dexametasona, respectivamente, la proporción de fármaco deseada solo puede ser alcanzado tras la administración de una mezcla estadística de 1, 2 y 3 fármacos BPD. Esto se ilustra en la fig. 1d, para una mezcla de 10 nanoensamblajes de BPD, que juntos administran 100 moléculas de fármaco a una célula o compartimento tumoral y que pueden hacerlo en una proporción que se encuentra dentro de la ventana de sinergia.
Una pregunta clave es cómo se compara la mezcla estadística de BPD de 3 fármacos con el BPD de 1 fármaco fabricado individualmente coadministrado en la relación sinérgica deseada. Los autores abordaron esta cuestión tanto matemática como experimentalmente. Usando simulaciones de Monte Carlo, demostraron que la coformulación de BPD de 3 fármacos supera a las combinaciones de BPD de 1 fármaco en un orden de magnitud en términos de probabilidad de lograr una relación sinérgica (Fig. 1e). Si imaginamos que una cantidad ejemplar de 100 nanoensamblajes de BPD llega a la celda o el compartimento objetivo, las posibilidades de que los 1,000 medicamentos administrados estén dentro de la ventana de sinergia aumentan de ~20 % para la combinación de 1 medicamento BPD a ~80 % para la formulación de BPD de 3 fármacos. Además, el modelo ejemplifica que el valor añadido solo se crea mediante la coformulación de múltiples fármacos si el número total de fármacos por celda o compartimento es inferior a ~10,000 1. Un simple cálculo muestra que este número está en un rango que es relevante para la situación preclínica. Suponiendo que (i) 10×XNUMX12 –1 × 1013 Las nanopartículas generalmente se inyectan a ratones cuando se busca lograr una circulación prolongada y una acumulación tumoral decente.9, que (ii) el 1% de la dosis inyectada llega a un tumor, y que (iii) un 1 cm3 el tumor contiene 109 células con un volumen de 1,000 μm3 cada uno, el número de nanopartículas por célula tumoral está en el rango de 10 a 100, y el número respectivo de moléculas de fármaco es de 100 a 1,000. En pacientes, 1×1015 - 1 × 1016 se administran nanopartículas9, la acumulación de tumor del 1 % es similar y los tumores suelen tener entre 1 y 100 cm3, por lo que contiene 109-1011 células. Esto da como resultado un número de nanopartículas por célula entre 100 y 100,000, correspondientes a 1,000 y 1,000,000 de moléculas de fármaco. Además, teniendo en cuenta que la distribución de fármacos en los tumores dista mucho de ser homogénea, y que una gran parte de las células tumorales verán acumuladas relativamente pocas nanopartículas y moléculas de fármacos, resulta cada vez más claro que puede haber un valor significativo en explotar la capacidad de la nanomedicina para coadministrar múltiples medicamentos para crear sinergia.
La evaluación in vivo se realizó en dos modelos de xenoinjerto de mieloma múltiple, comparando seis grupos de tratamiento diferentes: control, combinación de fármacos libres, combinación de DBP de 1 fármaco, mezcla estadística antagónica de DBP de 3 fármacos, mezcla sinérgica de dosis baja de DBP de 3 fármacos, y mezcla sinérgica de dosis alta de BPD de 3 fármacos. Ambas coformulaciones sinérgicas de BPD superaron a todos los demás grupos de tratamiento, en términos de inhibición del crecimiento tumoral y supervivencia (Fig. 1f). Sorprendentemente, en comparación con los tres fármacos libres combinados, la formulación de BPD de 3 fármacos sinérgicos de dosis baja fue más eficaz a pesar de que las concentraciones de fármaco empleadas fueron un orden de magnitud más bajas. Cabe señalar, sin embargo, que la vía de administración fue diferente para ambos grupos. No obstante, la comparación ejemplifica el potencial del enfoque: usar dosis de fármaco significativamente más pequeñas, combinadas proporcionalmente y coformuladas adecuadamente en una nanopartícula con un tropismo tumoral decente, para mejorar significativamente los resultados terapéuticos.
El trabajo de Detappe, Nguyen y sus colegas es un gran paso adelante para los campos de la nanomedicina del cáncer y NBCD. Muestra que es posible fabricar un nanomedicamento de triple fármaco con una proporción de compuesto activo estadísticamente definida y permite la transferencia de eficacia sinérgica in vitro a eficacia sinérgica in vivo. Se espera con impaciencia la experimentación de seguimiento que confirme el potencial del enfoque y posicione la administración de múltiples fármacos en el panorama preclínico de la nanomedicina contra el cáncer. Entre otras cosas, las investigaciones futuras podrían incluir: (i) la evaluación de rutas alternativas de administración, incluida la inyección subcutánea para la DBP multidrogas; (ii) exploración de tasas alternativas de liberación de fármacos, que pueden ajustarse individualmente para cada agente activo; (iii) incorporación de otros agentes activos y combinaciones de agentes activos, para los cuales son concebibles muchas opciones atractivas; (iv) análisis de otros sistemas de administración que permitan la administración radiométrica de múltiples fármacos; y por último, pero no menos importante, (v) la evaluación de los aspectos regulatorios, el interés de la industria y la aceptación del usuario final, que idealmente debería realizarse en paralelo10. En conjunto, los resultados informados y el progreso conceptual realizado están preparando el escenario para expandir la nanomedicina multifarmacológica del mieloma múltiple a muchas otras enfermedades.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- Platoblockchain. Inteligencia del Metaverso Web3. Conocimiento amplificado. Accede Aquí.
- Fuente: https://www.nature.com/articles/s41565-022-01265-3