(Noticias de Nanowerk) Los investigadores han buscado durante mucho tiempo desarrollar herramientas versátiles que permitan la manipulación e identificación precisas del ADN y otras nanopartículas biológicas. Las pinzas ópticas, que utilizan láseres para atrapar partículas pequeñas, ofrecen control sin contacto, pero carecen de la capacidad de reconocer secuencias de ADN específicas. Al mismo tiempo, la edición de genes CRISPR se ha convertido en un método de detección ultrasensible, pero requiere mejora e integración con nanotecnología. Ahora, investigadores de la Universidad de Shenzhen y la Universidad China de Hong Kong han combinado CRISPR con pinzas optotérmicas en una innovación que supera limitaciones anteriores. En un nuevo estudio publicado en Luz: ciencia y aplicaciones ("Nanopinzas optotérmicas impulsadas por CRISPR: manipulación diversa de bionanopartículas e identificación de un solo nucleótido"), el equipo presenta nanopinzas optotérmicas (CRONT) impulsadas por CRISPR, una plataforma que ofrece captura e identificación simultáneas de ADN con alta precisión. Este avance allana el camino para avances en las pruebas en el lugar de atención, la biodetección y la investigación en biofísica fundamental.
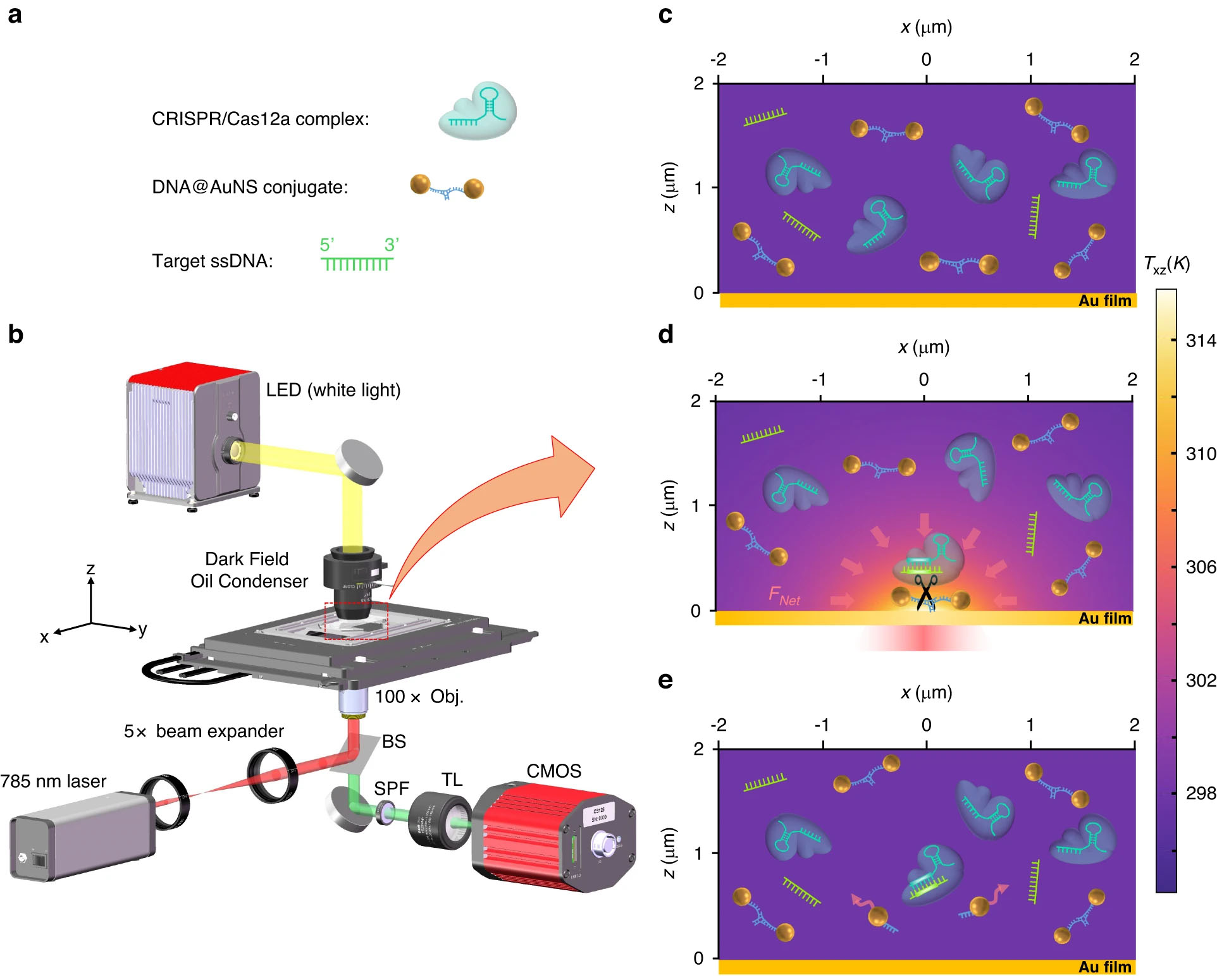 Principio de funcionamiento de las nanopinzas optotérmicas impulsadas por CRISPR. a El esquema esquemático de los tres componentes de la solución: conjugado DNA@AuNS, complejo CRISPR/Cas12a y ssDNA objetivo. b Configuración óptica, BS, SPF y TL son divisor de haz, filtro de paso corto y lente de tubo (f=200 mm), respectivamente. Se proporcionan detalles adicionales de la configuración en la sección Materiales y métodos. c Dispersión de los tres componentes en la solución sin calentamiento óptico. d Fuerza neta optotérmica (FRed) migración inducida y escisión del conjugado DNA@AuNS tras calentamiento óptico, la potencia del láser de calentamiento es de 0.5 mW. e Observación de la escisión después de desconectar el calentamiento óptico. (© Luz: ciencia y aplicaciones)
pinzas opticas se han convertido en una técnica invaluable desde su invención en 1986, proporcionando un control espaciotemporal incomparable sobre partículas microscópicas. Pero dependen de la transferencia de impulso de un láser de alta potencia y muy enfocado, lo que limita los materiales que pueden quedar atrapados e introduce riesgos de fotodaños por el calentamiento local. Las pinzas optotérmicas se introdujeron hace 15 años como una alternativa prometedora con intensidades mucho más bajas. Aprovechan los gradientes de temperatura a microescala y el flujo de fluidos cerca de una superficie iluminada que absorbe la luz para manipular partículas a través de fuerzas de termodifusión y convectiva. Pero hasta ahora, ni las pinzas ópticas tradicionales ni las técnicas optotérmicas podían identificar directamente partículas biológicas mediante señales ópticas. Esa capacidad sólo se ha logrado mediante engorrosos métodos de etiquetado por fluorescencia. Paralelamente, el diagnóstico CRISPR se ha convertido en un enfoque innovador para detectar secuencias de ácido nucleico con extrema especificidad hasta pares de bases individuales. Sin embargo, traducir los ensayos de sobremesa a dispositivos en el lugar de atención sigue siendo un desafío debido a la extensa preparación de muestras y la amplificación del objetivo necesarias. El equipo de Shenzhen-CUHK se dio cuenta del enorme potencial de fusionar la detección CRISPR con la manipulación precisa de pinzas optotérmicas en una sola plataforma. El sistema CRONT utiliza una fina película dorada para generar puntos calentados justo por encima de la temperatura ambiente tras la iluminación con un puntero láser estándar de 785 nm. Esto crea corrientes de convección localizadas y termodifusión que pueden atrapar selectivamente más de 50 secuencias distintas de ADN y nanopartículas funcionalizado con ADN. Una vez atrapadas, las secuencias se identifican in situ mediante la introducción de complejos CRISPR que escinden las hebras de ADN objetivo, lo que se observa en tiempo real a medida que el patrón de difracción de las nanopartículas de oro individuales cambia tras la fragmentación. Esta lectura óptica pasiva evita engorrosos pasos de etiquetado por fluorescencia. Sorprendentemente, al aprovechar estas fuerzas de autoensamblaje e integrar sondas CRISPR dentro de los flujos microscópicos inducidos térmicamente, las pinzas CRONT aumentan la concentración y las tasas de interacción para permitir una detección rápida de un solo ADN. El equipo demostró sensibilidad attomolar para una secuencia del virus de la viruela del simio, sin ninguna amplificación objetivo. Esto representa una mejora de hasta 10 mil millones de veces con respecto a los ensayos CRISPR convencionales y coincide con el rendimiento a nivel de PCR. Esta cuantificación ultrasensible en un sistema de pinzas láser de bajo costo podría permitir realizar pruebas en el lugar de atención. Igual de notable es que las pinzas CRONT facilitan el reconocimiento de polimorfismos de un solo nucleótido (SNP), una capacidad que antes se limitaba a costosas plataformas de secuenciación o PCR. Esto abre posibilidades para perfilar ópticamente la variabilidad genética y las mutaciones in situ para estudiar la biodiversidad o los mecanismos de las enfermedades. Las validaciones experimentales mostraron que CRONT podía distinguir diferencias de base única entre las variantes del SARS-CoV-2. Más allá de los ácidos nucleicos, los investigadores demostraron la manipulación programable de proteínas, lo que plantea perspectivas intrigantes para estudiar las interacciones entre proteínas inducidas por el calor. Y señalan que la plataforma se puede ampliar a diversos materiales mediante la funcionalización con diferentes sondas. Si bien siguen siendo una prueba de concepto, al combinar las ventajas de los ensayos CRISPR y la manipulación optotérmica, las pinzas CRONT superan barreras clave que frenan ambas tecnologías de forma independiente. El equipo cree que esto marca un paso importante hacia los biosensores en el punto de atención, la detección de enfermedades, la manipulación celular remota y la integración. nanofotónica con interacciones biológicas programables. Planean mejorar aún más el rendimiento para acelerar la investigación y la detección en genómica, epigenética y diagnóstico. Si se puede mantener la sensibilidad y la simplicidad a medida que se desarrolla la tecnología, las pinzas optotérmicas impulsadas por CRISPR podrían convertirse en una herramienta omnipresente para análisis clínicos y de laboratorio, llevando la nanotecnología avanzada a la biomedicina del mundo real.
Principio de funcionamiento de las nanopinzas optotérmicas impulsadas por CRISPR. a El esquema esquemático de los tres componentes de la solución: conjugado DNA@AuNS, complejo CRISPR/Cas12a y ssDNA objetivo. b Configuración óptica, BS, SPF y TL son divisor de haz, filtro de paso corto y lente de tubo (f=200 mm), respectivamente. Se proporcionan detalles adicionales de la configuración en la sección Materiales y métodos. c Dispersión de los tres componentes en la solución sin calentamiento óptico. d Fuerza neta optotérmica (FRed) migración inducida y escisión del conjugado DNA@AuNS tras calentamiento óptico, la potencia del láser de calentamiento es de 0.5 mW. e Observación de la escisión después de desconectar el calentamiento óptico. (© Luz: ciencia y aplicaciones)
pinzas opticas se han convertido en una técnica invaluable desde su invención en 1986, proporcionando un control espaciotemporal incomparable sobre partículas microscópicas. Pero dependen de la transferencia de impulso de un láser de alta potencia y muy enfocado, lo que limita los materiales que pueden quedar atrapados e introduce riesgos de fotodaños por el calentamiento local. Las pinzas optotérmicas se introdujeron hace 15 años como una alternativa prometedora con intensidades mucho más bajas. Aprovechan los gradientes de temperatura a microescala y el flujo de fluidos cerca de una superficie iluminada que absorbe la luz para manipular partículas a través de fuerzas de termodifusión y convectiva. Pero hasta ahora, ni las pinzas ópticas tradicionales ni las técnicas optotérmicas podían identificar directamente partículas biológicas mediante señales ópticas. Esa capacidad sólo se ha logrado mediante engorrosos métodos de etiquetado por fluorescencia. Paralelamente, el diagnóstico CRISPR se ha convertido en un enfoque innovador para detectar secuencias de ácido nucleico con extrema especificidad hasta pares de bases individuales. Sin embargo, traducir los ensayos de sobremesa a dispositivos en el lugar de atención sigue siendo un desafío debido a la extensa preparación de muestras y la amplificación del objetivo necesarias. El equipo de Shenzhen-CUHK se dio cuenta del enorme potencial de fusionar la detección CRISPR con la manipulación precisa de pinzas optotérmicas en una sola plataforma. El sistema CRONT utiliza una fina película dorada para generar puntos calentados justo por encima de la temperatura ambiente tras la iluminación con un puntero láser estándar de 785 nm. Esto crea corrientes de convección localizadas y termodifusión que pueden atrapar selectivamente más de 50 secuencias distintas de ADN y nanopartículas funcionalizado con ADN. Una vez atrapadas, las secuencias se identifican in situ mediante la introducción de complejos CRISPR que escinden las hebras de ADN objetivo, lo que se observa en tiempo real a medida que el patrón de difracción de las nanopartículas de oro individuales cambia tras la fragmentación. Esta lectura óptica pasiva evita engorrosos pasos de etiquetado por fluorescencia. Sorprendentemente, al aprovechar estas fuerzas de autoensamblaje e integrar sondas CRISPR dentro de los flujos microscópicos inducidos térmicamente, las pinzas CRONT aumentan la concentración y las tasas de interacción para permitir una detección rápida de un solo ADN. El equipo demostró sensibilidad attomolar para una secuencia del virus de la viruela del simio, sin ninguna amplificación objetivo. Esto representa una mejora de hasta 10 mil millones de veces con respecto a los ensayos CRISPR convencionales y coincide con el rendimiento a nivel de PCR. Esta cuantificación ultrasensible en un sistema de pinzas láser de bajo costo podría permitir realizar pruebas en el lugar de atención. Igual de notable es que las pinzas CRONT facilitan el reconocimiento de polimorfismos de un solo nucleótido (SNP), una capacidad que antes se limitaba a costosas plataformas de secuenciación o PCR. Esto abre posibilidades para perfilar ópticamente la variabilidad genética y las mutaciones in situ para estudiar la biodiversidad o los mecanismos de las enfermedades. Las validaciones experimentales mostraron que CRONT podía distinguir diferencias de base única entre las variantes del SARS-CoV-2. Más allá de los ácidos nucleicos, los investigadores demostraron la manipulación programable de proteínas, lo que plantea perspectivas intrigantes para estudiar las interacciones entre proteínas inducidas por el calor. Y señalan que la plataforma se puede ampliar a diversos materiales mediante la funcionalización con diferentes sondas. Si bien siguen siendo una prueba de concepto, al combinar las ventajas de los ensayos CRISPR y la manipulación optotérmica, las pinzas CRONT superan barreras clave que frenan ambas tecnologías de forma independiente. El equipo cree que esto marca un paso importante hacia los biosensores en el punto de atención, la detección de enfermedades, la manipulación celular remota y la integración. nanofotónica con interacciones biológicas programables. Planean mejorar aún más el rendimiento para acelerar la investigación y la detección en genómica, epigenética y diagnóstico. Si se puede mantener la sensibilidad y la simplicidad a medida que se desarrolla la tecnología, las pinzas optotérmicas impulsadas por CRISPR podrían convertirse en una herramienta omnipresente para análisis clínicos y de laboratorio, llevando la nanotecnología avanzada a la biomedicina del mundo real.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- Fuente: https://www.nanowerk.com/nanotechnology-news2/newsid=64221.php



