El agotamiento agudo de plaquetas recluta rápidamente HSC inactivas para la proliferación
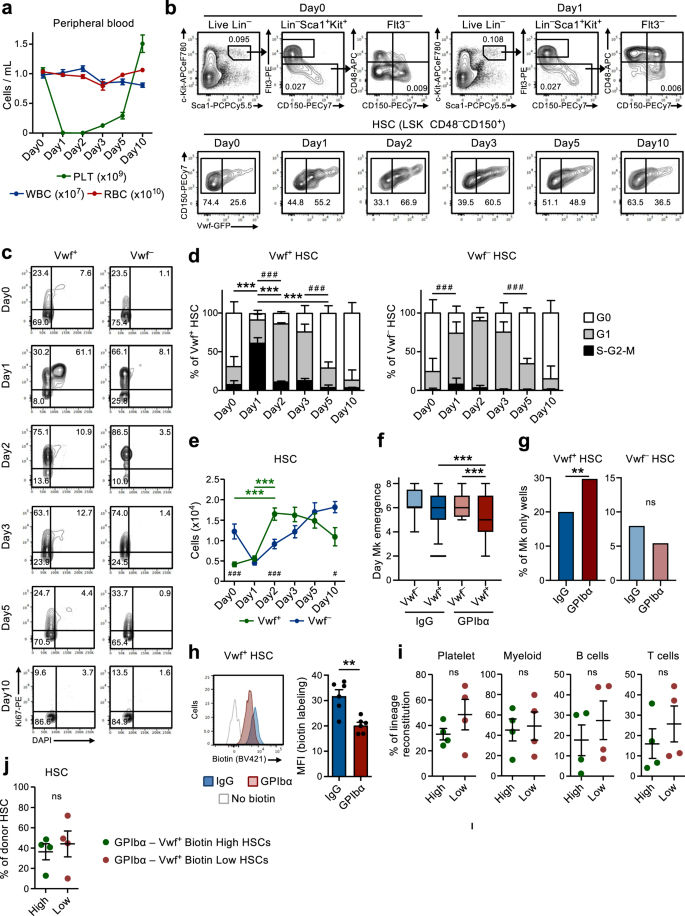
En línea con estudios previos.9, administración de una dosis única de anticuerpo anti-GPIbα para vwf-Los ratones GFP, para imitar la trombocitopenia observada en pacientes con púrpura trombocitopénica inmunitaria (PTI), depletaron plaquetas rápida y eficientemente en el transcurso de 1 día sin afectar significativamente a otros linajes de células sanguíneas (Fig. 1a). Esto fue acompañado por una rápida (en 1 día) activación del ciclo celular de Lin–Sca1+c-Kit+ (LSK) Flt3–CD48–CD150+ HSC. El reclutamiento en el ciclo celular activo se observó preferentemente dentro del vwf-PFG+ (vwf+) Compartimento HSC (Fig. 1b–d), que está enriquecido en HSC con tendencia a plaquetas pero contiene predominantemente HSC reconstituyentes de múltiples linajes9,18. Mientras que más del 60% de los Vwf+ LSKFlt3–CD48–CD150+ Las HSC entraron en la fase S-G2-M del ciclo celular, solo una pequeña fracción de vwf-PFG– (vwf–) Las HSC ingresaron al S-G2-M. Sin embargo, la mayoría de Vwf– Las HSC pasaron de una etapa inactiva (G0) a una etapa G1 más activada (Fig. 1c, d).
(Relacionado con las Figs. 1 y 2). a Análisis cinético de los parámetros de las células de sangre periférica después de la administración del anticuerpo anti-GPIbα. Los ratones del día 0 se trataron con anticuerpo de control de isotipo IgG. Los datos representan la media ± SEM de 10 (Día 0), 13 (Día 1), 10 (Día 2), 9 (Día 3), 8 (Día 5) y 7 (Día 10) ratones de 14 experimentos independientes. Plaquetas PLT, glóbulos blancos WBC, glóbulos rojos RBC. b Perfiles representativos de FACS y estrategia de activación de vwf-PFG+ (vwf+) y vwf-PFG– (vwf–) LSKFlt3–CD150+CD48– HSC en los momentos indicados después del agotamiento de plaquetas. Los números en puertas/cuadrantes indican la frecuencia (promedio de todos los ratones analizados) de la población de células cerradas entre el total de células vivas (paneles superiores) o entre las HSC (paneles inferiores). c, d Análisis del ciclo celular de Vwf.+ y vwf– LSKFlt3–CD150+CD48– HSC en los momentos indicados después del agotamiento de plaquetas. c Perfiles FACS representativos del ciclo celular de Vwf+ (izquierda) y VWF– (derecha) HSC en G0 (DAPI–Ki67–) G1 (DAPI–Ki67+) o S-G2-M (DAPI+Ki67+) fases del ciclo celular. Los números en las puertas representan frecuencias (promedio de todos los ratones analizados) del total de HSC. d Distribución de fases del ciclo celular media ± DE de Vwf+ (izquierda) y VWF– (derecha) HSC. Datos de 5 (Día 0), 5 (Día 1), 3 (Día 2), 5 (Día 3), 5 (Día 5) y 4 (Día 10) de ratones de 6 experimentos independientes. ***p <0.001; **p < 0.01 para la fracción del ciclo celular S-G2-M; # # #p < 0.001 para la fracción del ciclo celular G1 (ambos utilizando ANOVA de 2 vías con comparaciones múltiples de Tukey); e Números absolutos de Vwf+ y vwf– HSC (por 2 patas, ver métodos). Datos medios ± SEM de 8 (Día 0), 8 (Día 1), 7 (Día 2), 5 (Día 3), 6 (Día 5) y 5 (Día 10) ratones de 9 experimentos independientes. ***p < 0.001 para Vwf+ HSC (ANOVA de 2 vías con comparaciones múltiples de Tukey); #p <0.05 y ###p < 0.001 para la comparación de Vwf+ contra vwf– HSC (ANOVA de 2 vías con comparaciones múltiples de Sidak). Hora de aparición del primer Mk (f) y frecuencia de colonias con sólo células Mk (g) en Vwf individual cultivado–o vwf+ HSC aisladas de ratones 16 horas después del tratamiento con IgG o GPIbα. Datos de 138, 364, 147 y 451 colonias derivadas de células individuales analizadas, respectivamente, de 5 réplicas biológicas en 4 experimentos independientes. f La línea media representa la mediana, los límites de la caja representan los percentiles 25 a 75, los bigotes marcan los percentiles 5 a 95. Las celdas fuera de los percentiles 5 a 95 se marcan como valores atípicos. P valores calculados con la prueba de Kruskal-Wallis con comparaciones múltiples de Dunn. g P valor calculado con la prueba exacta de Fisher bilateral. ***p <0.001; **p <0.01; *p < 0.05; ns, no significativo (p > 0.05). h Análisis de proliferación de biotina de vwf-PFG+ HSC 2 días después del tratamiento con IgG o GPIbα. Gráfico representativo (izquierda) y media ± DE MFI (normalizado para MFI de control sin etiquetado con biotina; derecha) de 6 ratones por grupo en 3 experimentos independientes. **p < 0.01; calculado con prueba t bilateral. Reconstitución a largo plazo (16 semanas) de linajes de células plaquetarias, mieloides y linfoides en la sangre (i) y del compartimento BM HSC (j) por biotina alta y biotina baja vwf-PFG+ Fracciones de HSC 2 días después del agotamiento de plaquetas. 50 células trasplantadas por ratón. Los datos representan la media ± SEM de 4 donantes en 2 experimentos independientes. Cada punto representa la media de 2 ratones receptores trasplantados por donante. ns, no significativo (p > 0.05); calculado con pruebas t bilaterales. Véanse también las figuras complementarias. 1 y 2.
A continuación, buscamos explorar más a fondo la base mecanicista de la activación de las HSC observada después del agotamiento de las plaquetas. El anticuerpo anti-GPIbα se une a GPIbα (CD42b), el receptor de trombina y VWF19, lo que lleva a la activación plaquetaria, la desialilación y la posterior eliminación de forma independiente del receptor Fc.20. GPIbα se expresa específicamente en el linaje de plaquetas megacariocíticas (Mk), incluidas las MkP, pero es importante para nuestros estudios y como lo informaron anteriormente otros21, la expresión de GPIbα es prácticamente indetectable en HSC (Fig. 1a). Después del agotamiento inicial de plaquetas, el número de plaquetas se recuperó lentamente, restableciéndose el recuento normal de plaquetas entre los días 5 y 10 después del agotamiento (Fig. 1a). En particular, este agotamiento de plaquetas provocó un aumento de 4 veces en el número de Vwf+ LSKFlt3–CD48–CD150+ HSC en 2 días, mientras que Vwf– Las HSC aumentaron con una cinética más lenta después de una reducción inicial (Fig. 1e). Posteriormente, el VWF+/vwf– La relación HSC y los números absolutos volvieron gradualmente a la normalidad, de manera concomitante con la normalización de los recuentos de plaquetas (Fig. 1a, mi). El aumento del VWF+ Los HSC también estuvieron acompañados de un aumento selectivo en el número de LSK Flt3.–CD48+CD150+ subconjunto de MPP (Fig. 1b y Fig. Suplementaria. 1b) se ha demostrado que tiene polarización Mk22. Además, los MkP23 también aumentaron significativamente unos días después del aumento de Vwf+ HSC, mientras que los progenitores eritroides (Pre-CFU-E) y mieloides (GMP) no se vieron afectados significativamente (Figura complementaria. 1c, d). Es de destacar que, a pesar de su sólida expresión de GPIbα y de acuerdo con el mecanismo independiente de Fc por el cual el anticuerpo conduce al agotamiento de las plaquetas20, las MkP inicialmente se redujeron ligeramente (aunque no significativamente), mientras que las Mk no se agotaron en la MO mediante la administración de anticuerpos (Fig. 1d-g). Después de la rápida activación inicial, las HSC regresaron rápidamente a la inactividad y se observó una distribución de fases del ciclo celular normalizada ya 5 días después del agotamiento de las plaquetas (Fig. 1c, d). Un anticuerpo monoclonal alternativo (NIT E)20 Plaquetas agotadas y Vwf activado.+ y vwf– El ciclo celular de HSC es similar al del anticuerpo anti-GPIbα (Fig. 2a, b). El tratamiento con anticuerpos GPIbα estuvo acompañado de una esplenomegalia leve y transitoria con un mayor número de Vwf+ pero no vwf– HSC en el bazo (Fig. 2c, d).
El reclutamiento de LSKFlt3 inactivo.–CD48–CD150+ Las células de BM en proliferación tras la activación y el agotamiento agudo de las plaquetas implican la existencia de un mecanismo de retroalimentación mediante el cual se reclutan HSC inactivas para restablecer la homeostasis de Mk y plaquetas. Para investigar si las HSC de ratones con depleción de plaquetas son más eficientes para generar Mks, utilizamos un ensayo de diferenciación in vitro de Mk/GM unicelular. Clonogenicidad de un solo Vwf+ o vwf– LSKFlt3–CD48–CD150+ Las HSC aisladas de ratones en homeostasis (IgG) o después del agotamiento de plaquetas (GPIbα) fueron similares (~80%; Fig. 2e). Sin embargo, solo Vwf+ Las HSC aisladas de ratones con depleción de plaquetas se diferenciaron más rápidamente en Mks que en Vwf– HSC de ratones con depleción de plaquetas o Vwf+ HSC aisladas de ratones en homeostasis (Fig. 1f) y también generó un mayor número de colonias compuestas exclusivamente por Mks (Fig. 1g y Fig. Suplementaria. 2f, gramo). Se ha demostrado previamente que los progenitores comprometidos con Mk en forma de tallo que se asemejan fenotípicamente a las HSC proliferan en respuesta a la trombocitopenia inducida por poli (I: C)24. Por lo tanto, para establecer más definitivamente que LSKFlt3–CD48–CD150+ Las células de MO inducidas a proliferar en respuesta al agotamiento de plaquetas inducido por anti-GPIbα incluyen verdaderas HSC repobladoras a largo plazo; utilizamos ratones H2B-mCherry inducibles por doxiciclina (tet-ON)6,25. En este sistema, un pulso de tratamiento con doxiciclina da como resultado la incorporación de histonas marcadas con mCherry en nucleosomas, que se dividen equitativamente entre las células hijas cuando las células proliferan. De acuerdo con el análisis del ciclo celular (Fig. 1c, d), el agotamiento de plaquetas inducido por anti-GPIbα resultó en una mayor proliferación de HSC, como lo demuestra el aumento de la dilución del etiquetado de mCherry después de 3 días (Fig. 2h). Es importante destacar que FACS clasificó mCherrylo (proliferativo) LSKFlt3–CD48–CD150+ Las células clasificadas a partir de ratones con depleción de plaquetas tenían un potencial de reconstitución multilinaje in vivo a largo plazo (LT; 16 semanas) (Fig. 2i), lo que demuestra que el agotamiento de plaquetas inducido por anti-GPIbα recluta potentes LT-HSC para la proliferación. Para comparar más directamente Vwf+ Para las HSC que se activan o que permanecen en un estado de no proliferación después del agotamiento de las plaquetas, utilizamos un método de etiquetado no invasivo basado en la inyección del derivado de biotina N-hidroxilsulfosuccinimida (biotina), que marca de manera eficiente las proteínas de la membrana de todas las células de la médula ósea.26. Cuando las células se dividen, las proteínas de membrana marcadas se distribuyen equitativamente entre las células hijas, lo que permite el análisis del historial de división celular in vivo. De manera similar, en el modelo H2B-mCherry, el agotamiento de las plaquetas resultó en una reducción del etiquetado con biotina de Vwf+ HSC (Fig. 1h) y también de Vwf– HSC (Figura complementaria. 2j). Las diferencias observadas en los análisis del ciclo celular y la proliferación de Vwf.– Los HSC podrían reflejar potencialmente la relación jerárquica descrita anteriormente entre Vwf+ y vwf– HSC9. Así, la proliferación de Vwf+ Los HSC pueden diferenciarse en Vwf– HCS, que transmiten la historia de la dilución de la etiqueta de biotina. Es importante destacar que FACS clasificó Vwf+Biotinalo (proliferativo) LSKFlt3–CD48–CD150+ células clasificadas a partir de ratones con depleción de plaquetas (Fig. 2k, yo) tenía un potencial de reconstitución multilinaje in vivo a largo plazo (LT; 16 semanas) (Fig. 1i), lo que demuestra que el agotamiento de plaquetas inducido por anti-GPIbα recluta potentes LT-HSC para la proliferación. Si bien repone potentemente las plaquetas, no se observó un sesgo plaquetario significativo en el Vwf+ Las HSC proliferan en respuesta al agotamiento de las plaquetas, en comparación con las no proliferativas (biotina).Hi) VW+ HSC (Fig. 1i). Independientemente, ambas fracciones de biotina de Vwf+ Las HSC demostraron una reconstitución similar de LT-HSC (Fig. 1j) y, en general, fueron igualmente eficientes en la generación del Vwf+ y vwf– Compartimentos HSC (Fig. 2m). Esto está en consonancia con el reclutamiento de LT-HSC funcionalmente definidas para la proliferación y con el hecho de que las proporciones relativas de Vwf+ y vwf– Las CMH vuelven en gran medida a la normalidad una vez que se ha restablecido la homeostasis (Fig. 1b, mi).
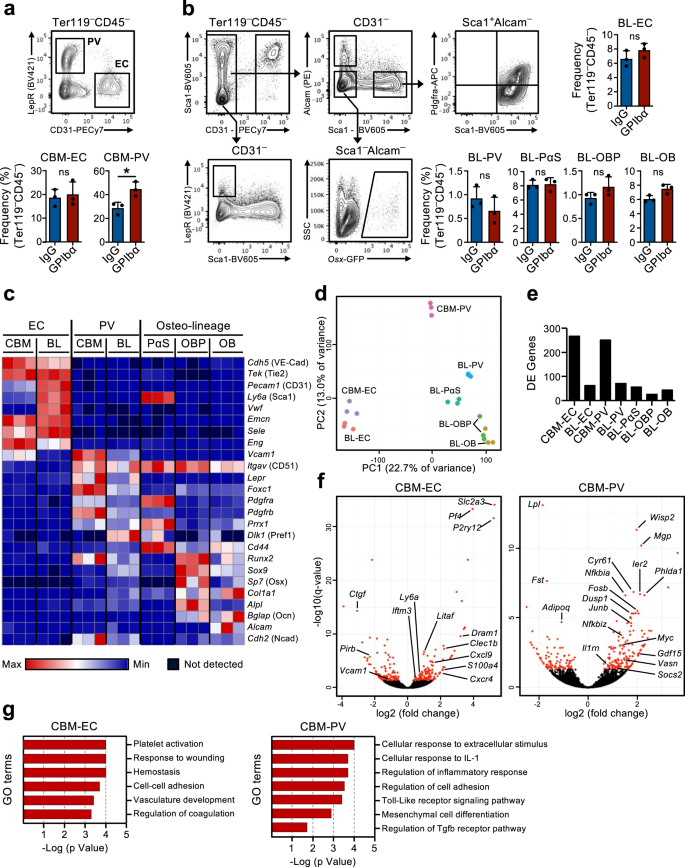
Reprogramación transcripcional del nicho HSC en respuesta al agotamiento agudo de plaquetas
La existencia de un mecanismo de retroalimentación mediante el cual las HSC inactivas son reclutadas para proliferar en respuesta al agotamiento de las plaquetas implica que las HSC en la MO deben poder detectar la demanda de producción de plaquetas. Nuestra hipótesis es que las células del nicho estromal de la médula ósea podrían estar implicadas en este proceso. De hecho, se han sugerido previamente cambios en el nicho de la MO después del agotamiento de las plaquetas.16,17 pero no se ha demostrado directamente la participación de células de nicho específicas en la regulación de la función de las HSC en este contexto. Por lo tanto, utilizamos un análisis de secuenciación global de ARN de poblaciones de células de nicho de MO previamente caracterizadas, así como de HSC, para investigar posibles interacciones moleculares entre estas células, involucradas en la respuesta de las HSC al agotamiento de plaquetas. Para ello, se aislaron células no hematopoyéticas de dos descritos27,28,29 distintas regiones anatómicas en la BM: las células centrales de la BM (CBM) y las células del revestimiento óseo (BL) (Fig. 3a). Dentro del CD45–Ter119– células no hematopoyéticas en fracciones BL y CBM, poblaciones de células de nicho distintas se definen como CD31Hi células endoteliales (CE) y CD31–Leproso+ células perivasculares (PV). En la fracción BL definimos además CD31–alcam–Pdgfrα+Sca1+ (PαS) progenitores mesenquimales, así como CD31–alcam–Sca1–osx-PFG+ progenitores de osteoblastos (OBP) y CD31–alcam+Sca1– osteoblastos (OB) (Fig. 2a, b). El análisis de citometría de flujo de estas células aisladas de ratones en homeostasis y 1 día después del agotamiento de las plaquetas no reveló cambios importantes en la composición celular, además de un pequeño pero significativo aumento en las células CBM-PV (Fig. 2a, b). El análisis de secuenciación de ARN mostró una agrupación distinta de las diferentes poblaciones endoteliales, mesenquimales y de HSC (Figura complementaria. 3b). La expresión de marcadores conocidos que definen las distintas poblaciones de células de nicho (Fig. 2c y datos complementarios 1) y de diferentes reguladores hematopoyéticos agrupados por patrón de expresión génica (Fig. 3c y datos complementarios 1), confirmó aún más sus distintas identidades celulares. Además, el análisis de componentes principales (PCA) de las poblaciones de células de nicho mostró la separación de las células del linaje endotelial y mesenquimal a lo largo del eje del componente principal (PC) 1 y una separación adicional de las poblaciones mesenquimales a lo largo del eje PC2 según el estadio de diferenciación (Fig. 2d). El análisis de expresión genética diferencial, que compara células de nicho aisladas de ratones en homeostasis y 1 día después del agotamiento de plaquetas, mostró una gran cantidad de genes expresados diferencialmente (DE) en células CBM-EC (266 genes) y CBM-PV (249 genes) (Fig. . 2e,f y datos complementarios 2, 3). Por el contrario, se detectó un número mucho menor de genes DE en otras poblaciones de nicho, incluidos los correspondientes BL-EC y BL-PV asociados al hueso) (Fig. 2e,f, Fig. Suplementaria 3d, e y datos complementarios 2–4), lo que sugiere una participación preferencial de nicho de CBM en la respuesta a la trombocitopenia. El análisis de ontología genética (GO) realizado en los genes DE de CBM-EC destacó los procesos biológicos asociados con la activación/coagulación plaquetaria (Pf4, clec1b, P2ry12), respuesta al estrés (Iftm3, Litaf, S100a4) y adhesión celular (Vcam1, Ctgf) (Higo. 2g y datos complementarios 5). El análisis GO en los genes CBM-PV DE reveló procesos biológicos asociados con la inflamación y, en particular, con la respuesta celular a la interleucina-1 (IL-1) proinflamatoria (Fig. 2g y datos complementarios 5). Otros procesos biológicos destacados en las células CBM-PV fueron la señalización del receptor tipo Toll (TLR)-4, cuyas vías de señalización aguas abajo del receptor se comparten parcialmente con la señalización de IL-1, y también la diferenciación mesenquimatosa y la señalización de TGFβ (Vasn, Fst, Wisp2, Cyr61) (Higo. 2f, gramo).
(Relacionado con la figura complementaria. 3). Análisis FACS y estrategias de activación para la clasificación de células endoteliales y estromales en la médula ósea central (CBM; a) y revestimiento óseo (BL; b) compartimentos celulares de ratones 1 día después del agotamiento de plaquetas (tratamiento con anticuerpo GPIbα). Los ratones de control recibieron anticuerpo de control de isotipo (IgG). Los diagramas de barras representan frecuencias medias ± DE (%) de cada población celular entre el CD45 no hematopoyético total–Ter119– células. Los datos son de 3 ratones por grupo en 3 (a) y 2 (b) experimentos independientes. *p < 0.05; ns no significativo (p > 0.05); evaluado mediante prueba t bilateral. c–g Análisis de secuenciación de ARN de los compartimentos de células endoteliales/estromales de ratones 1 día después del agotamiento de plaquetas. c Expresión (FPKM) de genes que caracterizan las diferentes poblaciones de células de nicho. d Análisis de componentes principales de la expresión génica normalizada de las diferentes poblaciones celulares investigadas. e Número de genes expresados diferencialmente (DE) entre ratones tratados con IgG y GPIbα (ajustado p valor (q)<0.05), en cada población de células de nicho investigada. f Parcelas de volcanes y g Análisis de términos de ontología genética (GO) de genes expresados diferencialmente en células endoteliales (EC) de CBM y Lepr.+ células perivasculares (PV). En f, los puntos rojos indican genes significativamente DE (q < 0.05. Para todos los paneles, los datos representan la media ± DE FPKM de 3 réplicas biológicas de 2 experimentos independientes. Osteoblastos OB, progenitores de osteoblastos OBP, PαS Pdfgrα+Sca1+ progenitores mesenquimales. Véase también la figura complementaria. 3.
La señalización de IL-1 en células no hematopoyéticas es fundamental para la respuesta de las HSC al agotamiento de plaquetas
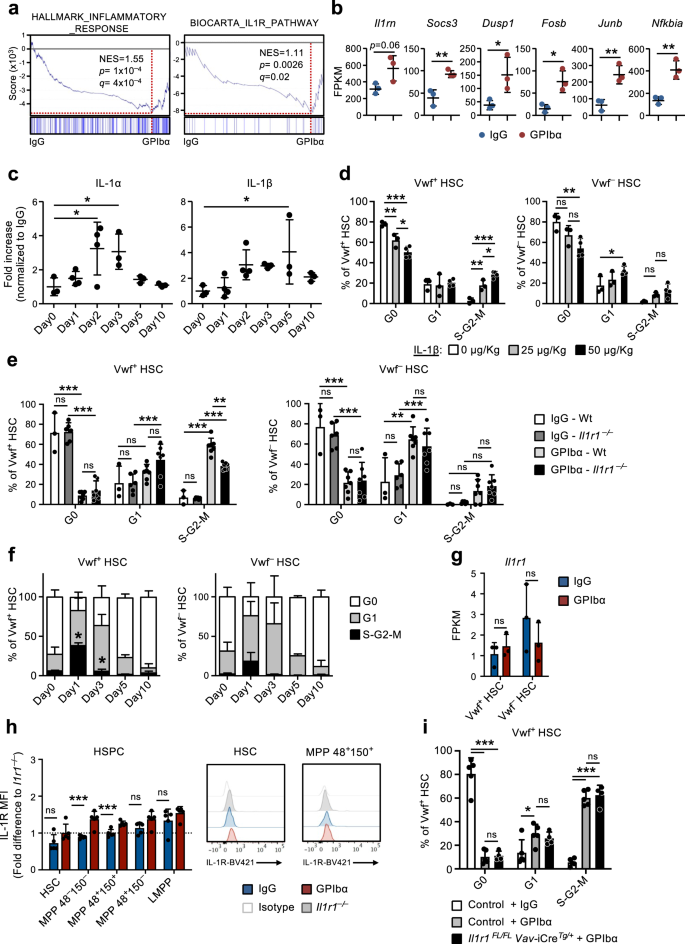
El análisis de enriquecimiento de conjuntos de genes (GSEA) confirmó el enriquecimiento de genes relacionados con la respuesta inflamatoria y la señalización del receptor de IL-1 observado en células CBM-PV aisladas de ratones tratados con GPIbα (Fig. 3a). Estos genes incluyen Il1rn (Gen diana de IL-1 y antagonista de la vía de señalización de IL-1), socs3 y Dusp1 (reguladores de la vía de señalización de IL-1) y Fosb, jub y Nfkbia (componentes de vías activadas aguas abajo de la cascada de señalización de IL-1) (Fig. 3b). Para investigar más a fondo el papel de la inflamación estéril en este proceso, analizamos los niveles de diferentes citocinas proinflamatorias en el líquido extracelular de la MO de ratones tratados con GPIbα. Este análisis reveló niveles significativamente aumentados de IL-1α e IL-1β después del agotamiento de plaquetas (Fig. 3c), con una cinética paralela a la expansión y posterior normalización de Vwf+ HSC (Fig. 1e). También se observó un aumento inicial similar para el TNFα, aunque se mantuvo más allá del momento en que Vwf+ El estado del ciclo celular de HSC se había normalizado (Fig. 4a). Otras citoquinas inflamatorias se mantuvieron prácticamente sin cambios (IL-6 e IL-12) o disminuyeron en etapas posteriores (INFγ) después del agotamiento de las plaquetas (Figura complementaria. 4a). En estado estacionario, se ha demostrado que la IL-1 es producida principalmente por células T circulantes (IL-1α) y granulocitos (IL-1β).30. En nuestros conjuntos de datos que analizan la expresión de IL-1 tanto Il1a y Il1b fueron en su mayoría indetectables en las diferentes poblaciones de células de nicho, así como en las HSC (Fig. 4b), mientras que los Mks primarios (Fig. 4c, d) mostró una alta expresión, en particular de Il1a (Fig. complementaria. 4b).
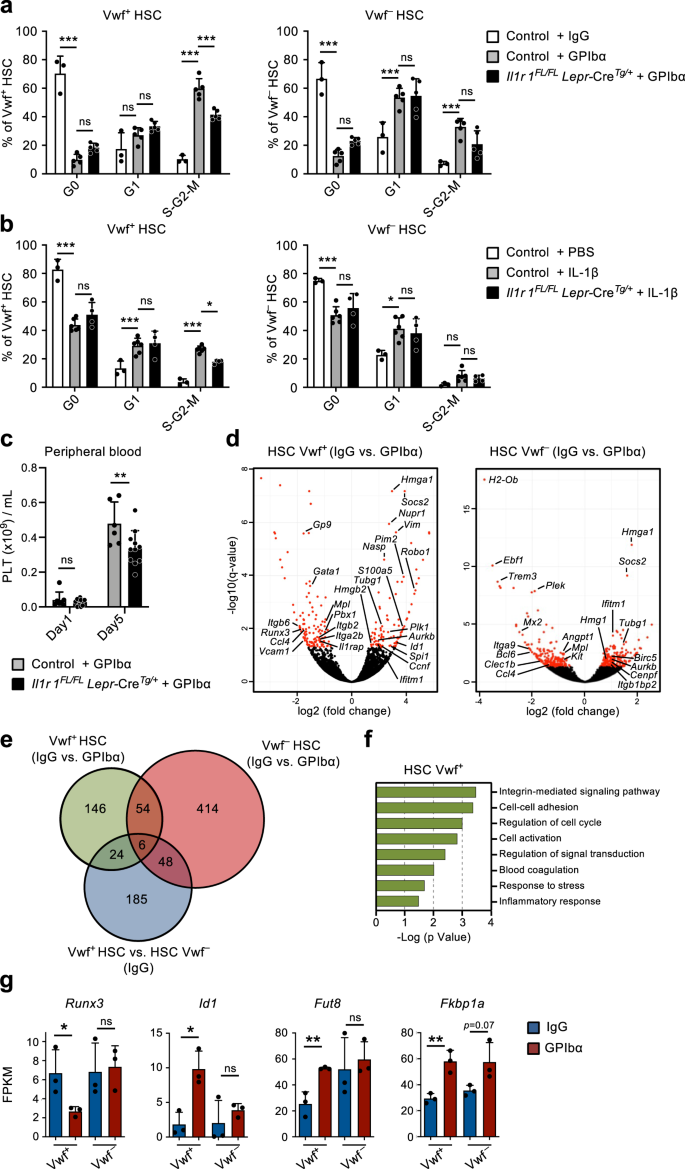
(Relacionado con la figura complementaria. 5). a Análisis de enriquecimiento de conjuntos de genes (GSEA) de datos de expresión genética global de células CBM-PV para los conjuntos de genes indicados. NES, puntuación de enriquecimiento normalizada (o puntuación escalada). b Expresión de genes afiliados a la vía de señalización de IL-1 en células CBM-PV 1 día después del agotamiento de plaquetas. Los datos representan la media ± SD de FPKM de 3 réplicas biológicas de 2 experimentos independientes. **p <0.01; *p < 0.05 (prueba t bilateral). c Niveles medios ± DE de IL-1α e IL-1β en el líquido extracelular de la médula ósea aislado de ratones en los momentos indicados después del agotamiento de las plaquetas (tratamiento con anticuerpos GPIbα). Los ratones de control (día 0) recibieron anticuerpo de control de isotipo (IgG). Los datos provienen de ratones 3 (Día 0), 4 (Día 1), 4 (Día 2), 3 (Día 3), 3 (Día 5) y 3 (Día 10) de 4 experimentos independientes. *p < 0.05 (ANOVA de 1 factor con comparaciones múltiples de Dunnett). d Análisis del ciclo celular de Vwf.+ (izquierda) y VWF– (derecha) HSC de ratones 1 día después de la administración intravenosa de las cantidades indicadas de IL-1β. Los datos son la media ± DE de 3 ratones que recibieron 0 o 25 µg/kg, y 4 ratones que recibieron 50 µg/kg de IL-1β, en 2 experimentos independientes. Análisis del ciclo celular de Vwf.+ (izquierda) y VWF– (derecha) HSC de Wt y Il1r1- / - ratones 1 día (e) o para HSC de Il1r1- / - ratones en los momentos indicados (f) después del agotamiento de plaquetas. e Datos medios ± DE de 3 (IgG-Wt), 6 (IgG-Wt)Il1r1- / -) 7 (GPIbα -Wt) y 7 (GPIbα –Il1r1- / -) ratones de 5 experimentos independientes. f Frecuencias medias ± DE de 6 (Día 0), 7 (Día 1), 3 (Día 3), 3 (Día 5) y 3 (Día 10) ratones en 4 experimentos independientes. *p < 0.05 (en comparación con el mismo análisis de Wt Vwf+ y vwf– HSC en la Fig. 1d). g, h Il1r1/análisis de expresión de IL-1R (h) a nivel de ARN mediante secuenciación de ARN (FPKM) en Vwf+ y vwf– HSC y (i) a nivel de proteína mediante citometría de flujo en subconjuntos de HSPC, aislados de ratones en homeostasis o 1 día después del agotamiento de plaquetas. h Datos medios ± SD de FPKM de 3 réplicas biológicas por condición. i Datos medios ± DE de la intensidad de fluorescencia media (MFI) normalizados al MFI de la población celular equivalente en Il1r1- / - ratones analizados dentro del mismo experimento. Los datos proceden de 5 ratones por condición, en 2 experimentos independientes. i Análisis del ciclo celular de vwf-tdTomate+ HSC de ratones con eliminación condicional de Il1r1 en todas las células hematopoyéticas (Il1r1Florida/Florida vav-CreTg/+) 1 día después del agotamiento de plaquetas. Los controles incluyen vwf-tdTomate+ HSC de Il1r1FL/+ vav-CreTg/+, Il1r1+ / + vav-CreTg/+ y Gobierno-cre+ / + ratones (que representan genotipos sin pérdida de función de IL-1R). Los datos representan frecuencias medias ± DE de 5 (control-IgG), 5 (control-GPIbα) y 4 (Il1r1Florida/Florida vav-CreTg/+-GPIbα) ratones de 3 experimentos independientes. ***p <0.001; **p <0.01; *p < 0.05; ns no significativo (p > 0.05); utilizando la prueba t bilateral (b, g, h) o ANOVA de 2 vías con comparaciones múltiples de Tukey (d–f, i). Véase también la figura complementaria. 4.
La administración de IL-1 recombinante a ratones resultó en la activación del ciclo celular de Vwf+ y vwf– HSC (Fig. 3d), con VWF+ Las HSC se reclutan en mayor medida en la fase S-G2-M del ciclo celular (Figura complementaria). 4e), compatible con IL-1 que media la activación de HSC en respuesta a la trombocitopenia inducida por anti-GPIbα. Para investigar más específicamente esta hipótesis, indujimos el agotamiento de plaquetas en ratones con deficiencia de IL-1R (Il1r1–/–), que tienen un compartimento HSC normal30 y números normales de plaquetas. En tono rimbombante, Il1r1–/– los ratones mostraron una reducción significativa en la frecuencia de ciclo activo (S-G2-M) Vwf+ HSC después del agotamiento de plaquetas (Fig. 3e,f), en comparación con ratones de tipo salvaje (Wt) tratados con GPIbα. El hecho de que Il1r1 La deficiencia no anuló completamente la activación del ciclo celular de las HSC en respuesta al tratamiento con GPIbα, lo que sugiere que están involucrados otros mecanismos (independientes de IL-1). De acuerdo con esto, previamente mostramos niveles elevados de THPO en suero 1 día después del agotamiento de plaquetas.9. Para identificar otras señales potencialmente sinérgicas con IL-1 en la activación de las HSC después del agotamiento de las plaquetas, analizamos la expresión de reguladores de HSC conocidos, incluidos tgfb1 y Pf4, previamente implicado en la inactividad de HSC31,32; y fgf1, previamente asociado con la proliferación de HSC32. El análisis de secuenciación de ARN de distintas poblaciones de células de nicho reveló una regulación positiva > 20 veces mayor de Pf4 en CBM-EC (Fig. 4f), mientras que no hubo cambios en la expresión de tgfb1 y fgf1 fue observado. Investigamos más a fondo los niveles de proteína de estos reguladores en el líquido extracelular de la MO después del agotamiento de las plaquetas. De acuerdo con el análisis de expresión génica, los niveles de TGFβ1 y FGF1 no se alteraron, pero PF4 aumentó significativamente 1 día después del agotamiento de plaquetas mediado por GPIbα (Figura complementaria. 4g). Dado el papel previamente descrito del PF4 en la inducción de la inactividad del HSC31,33, es poco probable que los niveles elevados observados de PF4 en el líquido extracelular de la MO expliquen la activación de la proliferación de HSC después del agotamiento de las plaquetas.
La secuenciación de ARN reveló niveles muy bajos (≈1 FPKM) de Il1r1 transcripciones en HSC (Fig. 3g). El análisis de citometría de flujo mostró niveles indetectables de proteína IL-1R en HSC y niveles bajos en varios subconjuntos de MPP (Fig. 3h y Fig. Suplementaria. 5a). Además de la falta de expresión detectable de IL-1R, se encontró que ninguno de los genes asociados a la señalización de IL-1 regulados positivamente en CBM-PV estaba regulado positivamente en Vwf.+ o vwf– HSC después del tratamiento con GPIbα (Fig. 5b). Si bien no observamos expresión detectable de IL-1R en HSC definidas fenotípicamente, se ha sugerido previamente que IL-1 activa las HSC30. Por lo tanto, para investigar si la IL-1 puede mediar directamente la activación de las HSC después de la trombocitopenia inducida por anti-GPIbα, indujimos el agotamiento de plaquetas en Il1r1Florida/Florida Gobierno-iCreTg/+ ratones cuyo objetivo es la eliminación de Il1r1 a todas las células hematopoyéticas, incluidas las HSC. Análisis de PCR digital de gotas de Vwf+ y vwf– Los HSC confirmaron una eficiencia de eliminación >99 % del Il1r1 alelos floxados por Vav-iCre en ambos Vwf+ y vwf– Subconjuntos de HSC (Fig. 5c). Al contrario de lo que observamos en la línea germinal Il1r1–/– ratones (Fig. 3e,f), Il1r1Florida/Florida Gobierno-iCreTg/+ los ratones mostraron una activación igualmente eficiente del ciclo celular de Vwf inducida por anti-GPIbα+ HSC como en ratones Wt (Fig. 3i). En conjunto, estos resultados demuestran que la señalización directa de IL-1R a través de HSC u otras células hematopoyéticas no está involucrada en la activación distinta del ciclo celular de las HSC en respuesta al agotamiento de plaquetas y más bien implica un papel para la señalización de IL-1 no hematopoyética en este proceso.
El agotamiento de las plaquetas da como resultado la activación de la señalización de IL-1 en las células perivasculares
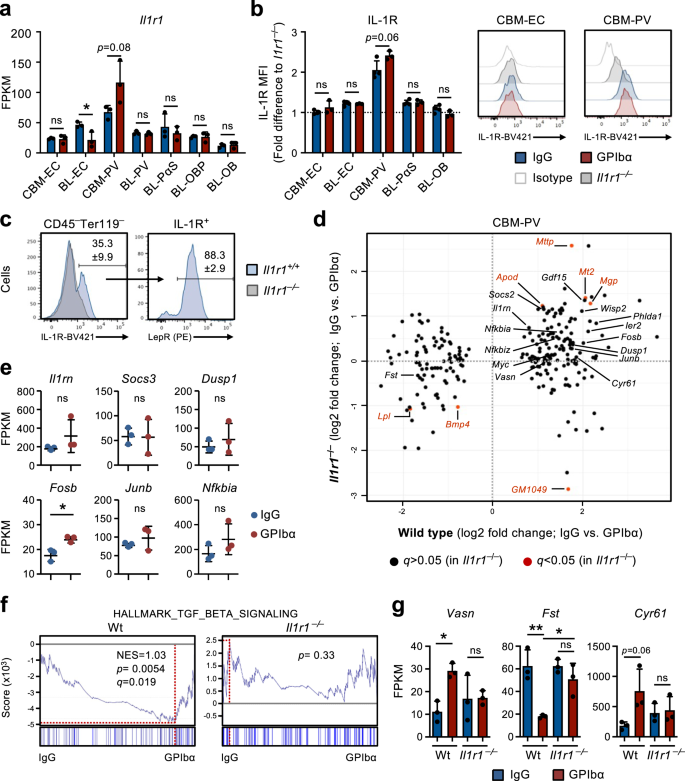
Nuestros estudios en Il1r1Florida/FloridaGobierno-iCreTg/+ratones y el análisis de secuenciación de ARN de células de nicho de MO sugirieron que la señalización de IL-1 en células de nicho, en lugar de HSC u otras células hematopoyéticas, podría desempeñar un papel en la activación por retroalimentación de las HSC después del agotamiento de plaquetas. Entre las células de nicho, las células CBM-PV mostraron los niveles transcripcionales más altos de Il1r1 expresión (fig. 4a) y también mostró una expresión distinta de la proteína IL-1R, mientras que todas las demás poblaciones de células estromales/endoteliales fueron prácticamente negativas para la expresión detectable de la superficie celular de IL-1R (Fig. 4b). De hecho, casi toda la expresión de IL-1R en CBM podría asignarse a Lepr+ Las células fotovoltaicas (Fig. 4c), que expresó niveles más altos de reguladores críticos de HSC, como cxcl12 y Kitl, en comparación con IL-1R endóstico–/Lo Células BL-PV (Fig. 3c). Es importante destacar que la comparación de genes DE en células CBM-PV de Wt y Il1r1–/– ratones en homeostasis y después del tratamiento con GPIbα revelaron que la mayoría de los genes DE identificados en ratones Wt después del agotamiento de plaquetas (Figs. 2f y 3b) no se expresaron diferencialmente en células CBM-PV de células empobrecidas en plaquetas. Il1r1–/– ratones (Fig. 4d), incluidos los genes directamente asociados con la activación de la vía de señalización de IL-1 (Fig. 4e). Además de los genes relacionados con la señalización de IL-1, encontramos evidencia de DE dependiente de IL-1R de vías implicadas en la regulación extrínseca de la proliferación de HSC, incluida la vía de señalización de TGFβ (Figs. 2g y 4d, f, sol)34. Esto incluyó una regulación positiva de Vasn (Vasorin), un inhibidor directo de la señalización de TGFβ35 previamente implicado en la activación de HSC36. Otros genes DE dependientes de IL-1R incluidos primero (Folistatina), un inhibidor directo de la señalización de BMP/Activina37 y previamente se ha demostrado que inhibe la diferenciación de Mk de las células progenitoras hematopoyéticas38y genes asociados con la adhesión celular y la unión/regulación de integrinas (Figs. 2f, gramo y 4d-g).
a Análisis de secuenciación de ARN de Il1r1 expresión génica (FPKM) en diferentes células de nicho aisladas de ratones en homeostasis (tratados con IgG) o 1 día después del agotamiento de plaquetas (tratados con GPIbα). Datos medios ± SD de FPKM de 3 réplicas biológicas de 2 experimentos independientes. b, c Análisis de citometría de flujo de la expresión de IL-1R en diferentes poblaciones de células endoteliales/estromales aisladas de ratones en homeostasis o 1 día después del agotamiento de plaquetas. Datos medios ± DE de la intensidad de fluorescencia media (MFI) normalizados al MFI de la población celular equivalente en Il1r1- / - ratones analizados dentro del mismo experimento (b). c Frecuencia de lepra+ Células fotovoltaicas en total IL-1R+ Células no hematopoyéticas de CBM aisladas de ratones en homeostasis. Datos de 4 ratones (IgG) y 3 (GPIbα) en 2 experimentos independientes. d Análisis de secuenciación de ARN de células CBM-PV aisladas de Il1r1+ / + y Il1r1- / - ratones en homeostasis y después del agotamiento de plaquetas, para la expresión de genes que responden al tratamiento con CBM-PV-GPIbα. Datos de 3 réplicas biológicas por condición. e Expresión de genes afiliados a la vía de señalización de IL-1 en células CBM-PV aisladas de Il1r1- / - ratones 1 día después del agotamiento de plaquetas. Datos medios ± SD de FPKM de 3 réplicas biológicas por condición. GSEA de datos globales de expresión genética para el conjunto de genes indicado (f) y expresión (FPKM; Media ± DE) de los genes indicados (g), en células CBM-PV de tipo salvaje y Il1r1- / - ratones en homeostasis y después del agotamiento de plaquetas. Datos de 3 ratones por condición. NES, puntuación de enriquecimiento normalizada (o puntuación escalada). *p <0.05; **p < 0.01; ns, no significativo (p > 0.05); utilizando la prueba t bilateral (a, b, e) y ANOVA de 2 vías con comparaciones múltiples de Tukey (g).
La señalización de IL-1 en las células perivasculares es fundamental para la activación óptima de Vwf+ HSC
Investigar más directamente el papel de la señalización de IL-1 en células CBM-PV en la activación de Vwf+ HSC en respuesta a la trombocitopenia, indujimos el agotamiento de plaquetas en ratones con eliminación condicional de Il1r1 específicamente en Lepr+ Células fotovoltaicas (Fig. 5d). Il1r1Florida/FloridaLeproso-creTg/+ los ratones mostraron una reducción significativa en el ciclo activo (S-G2-M) Vwf+ HSC, en comparación con los ratones de control tratados con anti-GPIbα (Fig. 5a). La reducción en la activación del ciclo celular fue comparable a la observada en células con eliminación de la línea germinal. Il1r1–/– ratones (Fig. 3e,f), apoyando que Lepr+ Las células CBM-PV son las principales células implicadas en la activación de Vwf dependiente de IL-1R+ HSC en respuesta a la trombocitopenia inducida por anti-GPIbα. Corroborando estos hallazgos, la administración de IL-1 recombinante a Il1r1Florida/FloridaLeproso-creTg/+ los ratones dieron como resultado un reclutamiento reducido de Vwf+ HSC en S-G2-M activo (Fig. 5b). Además, la supresión específica de Il1r1 en lepra+ Las células PV produjeron un retraso pequeño pero significativo en la recuperación de las plaquetas después del agotamiento de las plaquetas (Fig. 5c).
(Relacionado con la figura complementaria. 6). a–c Análisis de ratones con eliminación condicional de Il1r1 en lepra+ células perivasculares (Il1r1Florida/Florida LeprosoCreTg/+) ratones después del agotamiento de plaquetas. Los controles incluyen Il1r1FL/+ LeprosoCreTg/+, Il1r1+ / + LeprosoCreTg/+, Il1r1Florida/Florida LeprosoCreTg/+ (sólo IgG) y Leproso-cre+ / + ratones. a Análisis del ciclo celular de Vwf.+ y FvW– HSC 1 día después del agotamiento de plaquetas. Los datos representan frecuencias medias ± DE de 3 (control-IgG), 5 (control-GPIbα) y 5 (Il1r1Florida/Florida LeprosoCreTg/+-GPIbα) ratones de 3 experimentos independientes. b Análisis del ciclo celular de Vwf.+ y FvW– HSC de ratones 1 día después de la administración intravenosa de 50 ug/kg de IL-1β. Los datos son media ± DE de 3 (control-IgG), 6 (control-GPIbα) y 4 (Il1r1Florida/Florida LeprosoCreTg/+-GPIbα) ratones de 3 experimentos independientes. c Análisis de sangre periférica de la recuperación de plaquetas en los momentos indicados después del agotamiento de las plaquetas. Número medio ± DE de plaquetas de 6 (control) y 11 (Il1r1Florida/Florida LeprosoCreTg/+) ratones en 3 experimentos independientes. d–g Análisis diferencial de expresión génica en Vwf.+ y vwf– HSC aisladas de ratones de tipo salvaje 1 día después del agotamiento de plaquetas (tratamiento con GPIbα). d Gráficos volcánicos de genes expresados diferencialmente en Vwf+ y vwf– HSC. Los puntos rojos indican genes con diferencias de expresión significativas (ajustado p valor (q)<0.05). e Diagrama de Venn que muestra el número de genes expresados diferencialmente en Vwf+ y vwf– Las HSC después del agotamiento de plaquetas y entre estos subconjuntos de HSC en la homeostasis (IgG). f Análisis de términos GO de procesos/vías biológicas reguladas positivamente en Vwf+ HSC después del agotamiento de plaquetas. g Expresión (FPKM) de genes asociados con la señalización de Activina/BMP en Vwf+ y vwf– HSC de ratones Wt en homeostasis y 1 día después del agotamiento de plaquetas. Toda la información (d–g) representan datos medios ± SD FPKM de 3 réplicas biológicas por genotipo y condición. *p <0.05; **p <0.01; ***p < 0.001; ns no significativo (p > 0.05); usando ANOVA de 2 vías con comparaciones múltiples de Tukey (a, b), ANOVA de 2 vías con comparaciones múltiples de Sidak (c) y prueba t bilateral (g). Véase también la figura complementaria. 5.
Para obtener más información sobre cómo Vwf+ Las HSC se reclutan para la proliferación en respuesta al agotamiento de plaquetas inducido por anti-GPIbα. Realizamos la secuenciación de ARN de Vwf.+ y vwf– HSC. Secuenciación de ARN de Vwf+ Las HSC identificaron 230 genes expresados diferencialmente después del agotamiento de las plaquetas, de los cuales 170 se expresaron exclusivamente de manera diferencial en Vwf+ y no vwf– HSC, y 24 de ellos ya distinguidos Vwf+ y vwf– HSC en homeostasis, incluidos genes asociados al linaje plaquetario/Mk (Fig. 5d, e, Fig. Suplementaria 5e,f y datos complementarios 6, 7). Comparación de Vwf+ y vwf– Las HSC de ratones con deficiencia de plaquetas revelaron un enriquecimiento de los genes de activación del ciclo celular en Vwf+ HSC, confirmando a nivel molecular la activación preferencial de Vwf+ HSC en respuesta al agotamiento de plaquetas (Fig. 5g y datos complementarios 8). Genes expresados diferencialmente en Vwf.+ Las HSC después de la activación y el agotamiento de las plaquetas se asocian principalmente con la señalización de integrinas y la adhesión celular, que se sabe que están reguladas por la señalización de TGFβ.39, pero también el ciclo celular, la coagulación sanguínea y la respuesta al estrés/inflamación (Fig. 5d-f). Si bien no podemos excluir la participación de otras vías de señalización en la regulación de estos genes, en línea con la regulación negativa de primero en células CBM-PV (Fig. 4g), los genes diana candidatos de Activina/BMP Runx3 y id140 estaban respectivamente regulados hacia abajo y hacia arriba en Vwf+ pero no vwf– Las HSC después del agotamiento de plaquetas (Fig. 5g). Es de destacar que el gen de la α1,6-fucosiltransferasa (Fut8) que regula diferencialmente la actividad de los receptores TGFβ y Activina41 y también es un regulador de la señalización de integrinas.42 se encontró regulado específicamente en Vwf+ Las HSC después del agotamiento de plaquetas. Además, en respuesta al agotamiento de plaquetas inducido por anti-GPIbα, Vwf+ HSC, pero no Vwf: HSC regulados al alza fkbp1a, un regulador intracelular de la señalización de Smad que modula la intensidad y duración de las señales aguas abajo de los receptores TGFβ, Activina y BMP43,44 (Higo. 5g). Junto con la regulación a la baja de primero en células CBM-PV (Fig. 4g), estos datos sugieren que un cambio de la señalización de TGFβ que refuerza la inactividad a la activación de la señalización de Activina/BMP puede conducir a alteraciones en la actividad de las integrinas, la adhesión celular y el estado del ciclo celular de las HSC en respuesta a la activación y el agotamiento agudo de las plaquetas.
La activación plaquetaria es esencial para la respuesta del HSC al agotamiento de las plaquetas.
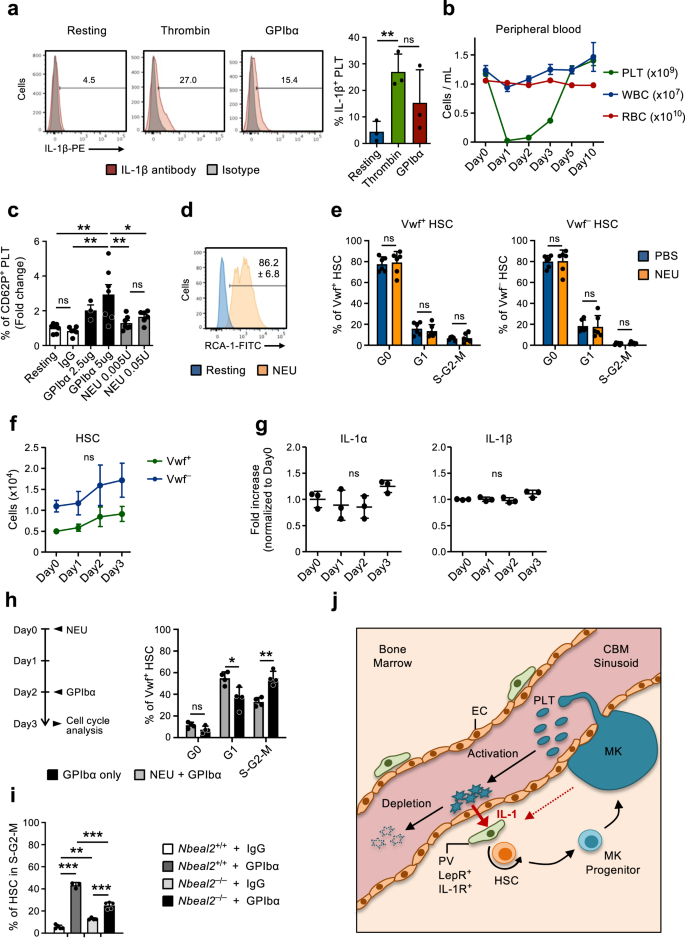
El análisis de la expresión génica de las CBM-EC reveló varios genes regulados positivamente tras el agotamiento de las plaquetas que están asociados con la activación y la coagulación de las plaquetas (Fig. 2f, gramo). Esto está en consonancia con el mecanismo por el cual se consumen frecuentemente las plaquetas.45, aquí imitado por el agotamiento de plaquetas mediado por GPIbα, que funciona induciendo la activación plaquetaria independiente de Fc, lo que lleva a la translocación de la sialidasa neuraminidasa-1 (NEU) de las plaquetas a la membrana, la desialilación y la posterior eliminación en el hígado.20. Además, las plaquetas son reconocidas como importantes mediadores de la inflamación.46,47 y regula rápidamente al alza la expresión de la proteína IL-1 tras la activación (Fig. 6a), como lo han demostrado anteriormente otros48,49,50. Esto respalda el papel de la activación plaquetaria y el consumo posterior en la mediación de la activación de Vwf dependiente de IL-1 observada en este documento.+ HSC en respuesta a la trombocitopenia. Para investigar más a fondo esta posibilidad, tratamos ratones con NEU.51, que de manera similar al tratamiento con GPIbα (Fig. 1a) conduce a un agotamiento eficiente de las plaquetas (Fig. 6b) pero evita la activación plaquetaria20. Mientras que el tratamiento con GPIbα activó eficientemente las plaquetas in vitro, según lo medido por la tinción con selectina P (CD62P) de superficie, el tratamiento con NEU in vitro resultó solo en una activación plaquetaria muy leve, y solo en concentraciones altas (Fig. 6c). Sin embargo, la actividad NEU in vitro fue confirmada por Ricinus communis Marcado de aglutinina I (RCA-1) (Fig. 6d), que se une específicamente a proteínas desialiladas20. A pesar de agotar las plaquetas in vivo con la misma eficiencia, a diferencia del tratamiento anti-GPIbα, el tratamiento con NEU no resultó en la activación del ciclo celular de las HSC (Fig. 6e) ni aumentó significativamente el número de Vwf+ o vwf– HSC (Fig. 6f), LSK Flt3–CD48+CD150+ MPP, pre-MegE y MkP en BM (Fig. 6a, b). Es de destacar que en los ratones tratados con NEU los niveles de IL-1α e IL-1β en la MO permanecieron prácticamente sin cambios (Fig. 6g). Estos resultados sugieren que, en lugar de la mera pérdida de plaquetas, el agotamiento de plaquetas inducido por la activación anti-GPIbα está involucrado en la activación observada de las HSC dependiente de IL-1. Estudios anteriores implicaron un papel de Mks y sus factores secretados en la regulación de la quiescencia/proliferación de HSC31,32,33,52. Dado que Mks también expresa GPIbα, para demostrar más específicamente el papel de las plaquetas en la activación de HSC observada en respuesta al tratamiento con anticuerpos anti-GPIbα, independientemente de Mks, administramos el anticuerpo anti-GPIbα a ratones en los que las plaquetas se habían agotado de manera eficiente con NEU. -tratamiento (Fig. 6b), que no altera el número de Mks33. Este tratamiento secuencial con NEU-GPIbα resultó en una activación reducida del ciclo celular de Vwf+ Las HSC, en comparación con el tratamiento con GPIbα solo (Fig. 6h), confirmando la implicación de las plaquetas en este proceso. Sin embargo, el hecho de que se observara cierta activación de HSC en ratones con plaquetas empobrecidas en NEU, en comparación con ratones de control con números de plaquetas normales (Figs. 1d y 3e), también respalda el papel de Mks en la activación de HSC observada en respuesta al tratamiento con anticuerpos anti-GPIbα.
(Relacionado con la figura complementaria. 4). a Expresión de IL-1β en plaquetas en reposo o después de la activación in vitro (3 horas) con trombina o anticuerpo GPIbα. (Izquierda), perfiles representativos de FACS. Los números en las gráficas son frecuencias promedio de 3 experimentos independientes. (Derecha) Frecuencia de IL-1β+ plaquetas; media ± DE de 3 réplicas biológicas por condición en 3 experimentos independientes. Cada réplica biológica consta de plaquetas reunidas de 2 a 3 ratones. b Análisis cinético de linajes de células de sangre periférica después de la administración in vivo de neuraminidasa (NEU). Los datos representan la media ± SEM de 10 (Día 0), 7 (Día 1), 8 (Día 2), 9 (Día 3), 6 (Día 5) y 3 (Día 10) ratones de 6 experimentos independientes. Plaquetas PLT, glóbulos blancos WBC, glóbulos rojos RBC. c Expresión de selectina P de superficie (CD62P) en plaquetas medida mediante citometría de flujo después de la incubación in vitro con anticuerpo GPIbα o NEU, en las concentraciones indicadas. Los datos representan cambios medios ± SD del % CD62P+ células en cada condición en relación a las plaquetas no tratadas (en reposo), de 7 (en reposo), 6 (IgG), 3 (GPIbα-2,5ug), 7 (GPIbα-5ug), 7 (NEU 0.005U) y 6 (NEU 0.05U) ratones en 3 experimentos independientes. d Actividad de neuraminidasa (NEU) in vitro en plaquetas en reposo o después de 30 minutos de tratamiento con NEU, analizada mediante unión a RCA-1. Perfil representativo de 1 de 3 réplicas biológicas. Los números indican la media ± DE % de plaquetas RCA-1+. e Distribución de fases del ciclo celular media ± DE de Vwf+ (izquierda) y VWF– (derecha) HSC 1 día después del agotamiento de plaquetas con NEU. Datos de 6 ratones por condición, en 3 experimentos independientes. f Evaluación basada en FACS del compartimento HSC en la médula ósea de ratones en los momentos indicados después del agotamiento de plaquetas con NEU. Los datos representan números absolutos de vwf-PFG+ (vwf+) o vwf-PFG– (vwf–) HSC (promedio ± SEM) en los puntos de tiempo indicados después del agotamiento de plaquetas. Los datos proceden de 5 (Día 0), 4 (Día 1), 5 (Día 2) y 6 (Día 3) ratones en 4 experimentos independientes. No se observaron cambios significativos en el número de Vwf+ o vwf– HSC en cualquier momento. g Niveles medios ± DE (aumento de veces en relación con el día 0) de las citoquinas indicadas en el líquido extracelular de la médula ósea aislado de ratones en los puntos de tiempo indicados después del agotamiento de plaquetas con neuraminidasa. Datos de 3 ratones por punto temporal en 2 experimentos independientes. h Los ratones fueron tratados con NEU el día 0, seguido de la administración del anticuerpo GPIbα el día 2 y analizados el día 3 (izquierda) para determinar la distribución de fases del ciclo celular en Vwf.+ HSC (derecha). Los ratones de control se trataron únicamente con anticuerpo GPIbα y se analizaron 1 día después. Los datos representan frecuencias medias ± DE de 4 ratones por grupo en 2 experimentos independientes. i HSC en S-G2-M en Nbeal2- / - ratones 1 día después del agotamiento de plaquetas (GPIbα). Los datos representan frecuencias celulares medias ± SD de 5 (Wt-IgG), 3 (Wt-GPIbα), 4 (Nbeal2- / --IgG) y 5 (Nbeal2- / --GPIbα) ratones por condición de 3 experimentos independientes. j Esquema que representa el mecanismo de retroalimentación propuesto. Mientras se consumen, las plaquetas activadas secretan IL-1, que activa las células PV que expresan IL-1R para inducir la proliferación y diferenciación de HSC hacia el linaje plaquetario. Como se indicó, Mks también puede contribuir al reclutamiento descrito de HSC para la proliferación en respuesta al tratamiento con el anticuerpo anti-GPIbα, lo que resulta en un agotamiento de plaquetas dependiente de la activación. Para todos los datos ***p <0.001; **p <0.01; *p < 0.05 (sólo indicado para diferencias significativas) utilizando ANOVA de 1 factor con comparaciones múltiples de Tukey (a, c, f, i), ANOVA de 2 vías con comparaciones múltiples de Sidak (e, h) o las comparaciones múltiples de Dunnett (g); ns no significativo. Véase también la figura complementaria. 6.
Las plaquetas almacenan múltiples moduladores inflamatorios en gránulos plaquetarios, que se liberan tras la activación plaquetaria.53,54. Para investigar más a fondo si se requiere la liberación del contenido de los gránulos de plaquetas para la activación de HSC mediada por GPIbα, indujimos el agotamiento de plaquetas (tratamiento con GPIbα) en ratones con deficiencia de Nbeal2 (Nbeal2–/–), que carecen de gránulos α de plaquetas55. Nbeal2–/– los ratones tienen una hematopoyesis normal en general a pesar de una pequeña disminución en el número de plaquetas y un ligero aumento en las HSC (Fig. 6c-e). Un día después del tratamiento anti-GPIbα Nbeal2–/– Los ratones tenían una frecuencia significativamente reducida de HSC en ciclo activo en comparación con los ratones Wt, a pesar de una mayor frecuencia de HSC en ciclo antes del tratamiento (Fig. 6i). En conjunto, estos hallazgos sugirieron que la IL-1 y otros reguladores secretados tras la activación plaquetaria pueden desempeñar un papel en la regulación de la activación de las HSC en respuesta a la trombocitopenia.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- Fuente: https://www.nature.com/articles/s41467-023-41691-y