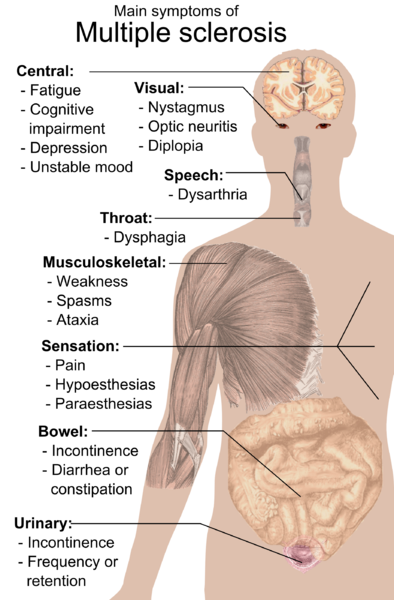
Ha habido un flujo constante de datos alentadores sobre células madre para la EM. Particularmente para ciertos tipos de EM.
Un nuevo estudio se suma a esta dirección optimista.
Buenas noticias sobre las células madre para la EM
Trasplante de células madre hematopoyéticas para el tratamiento de la esclerosis múltiple remitente-recurrente en Suecia: un estudio de cohorte observacional, Revista de Neurología, Neurocirugía y Psiquiatría.
Este artículo es consistente con los resultados de otros grupos que TCMH parece tener un beneficio importante para algunos pacientes con EM. Los autores concluyen que “el tratamiento con aHSCT para la EMRR se asocia con la ausencia de actividad de la enfermedad en la mayoría de los pacientes, con eventos adversos aceptables. Este procedimiento debe considerarse un estándar de atención para pacientes con EMRR muy activa”.
Imagínese si las células madre para la EM se convirtieran en el estándar de atención comprobado para muchos casos. Sería tan asombroso. Sé que algunos médicos, especialmente fuera de los EE. UU., ya lo ven de esa manera.
Kimera Labs IND para COVID
Kimera Labs, que fabrica productos de exosomas, recibió buenas noticias de la FDA en mayo. La firma recibió su primer IND autorizado, en este caso para una investigación terapia de exosomas para COVID.
Me perdí estas noticias del IND, probablemente porque presenté tres subvenciones de los NIH en junio o principios de julio y tuve un caso grave de COVID a partir de mediados de junio. he estado siguiendo Laboratorios Kimera por mucho tiempo. Será interesante seguir este IND y cualquier dato de prueba posterior. Este IND es particularmente notable ya que la FDA envió a Kimera una carta sin título durante lo peor de la pandemia relacionada con el uso de productos para COVID.
La agencia también envió una advertencia al Dr. Douglas Spiel sobre el uso de exosomas en pacientes con COVID. Spiel había sido consultor clínico de Kimera, pero ya hace algunos años que no ocupa ningún puesto en la empresa.
FDA – Apelación de la demanda de Cell Surgical Network
Probablemente tendremos que ser mucho más pacientes en una gran apelación pendiente de demanda sobre células madre.

La FDA perdió el caso en el tribunal de distrito federal, aquí en California, sobre la cuestión de si el producto de células adiposas SVF es un medicamento y otras cuestiones. Había ganado un caso similar en Florida.
Ahora el caso SVF de California, el Demanda de la Red Quirúrgica Celular, está con El Noveno Circuito. Este probablemente se prolongará hasta 2024 antes de que se decida. ¿Por qué? A modo de actualización, la lista de casos ahora analiza la posibilidad de alegatos orales en enero de 2024. A menos que las partes puedan resolver el caso independientemente de eso, lo que parece poco probable, este caso llevará mucho tiempo.
¿Por qué Pasadena? Pensé que sería en San Francisco.
Otras lecturas recomendadas
Una vacuna dirigida a H3K27M en adultos con glioma difuso de línea media, Nat. Medicina. Esto es esperanzador aunque sea muy preliminar. La fuerte respuesta de un paciente me pareció particularmente interesante.
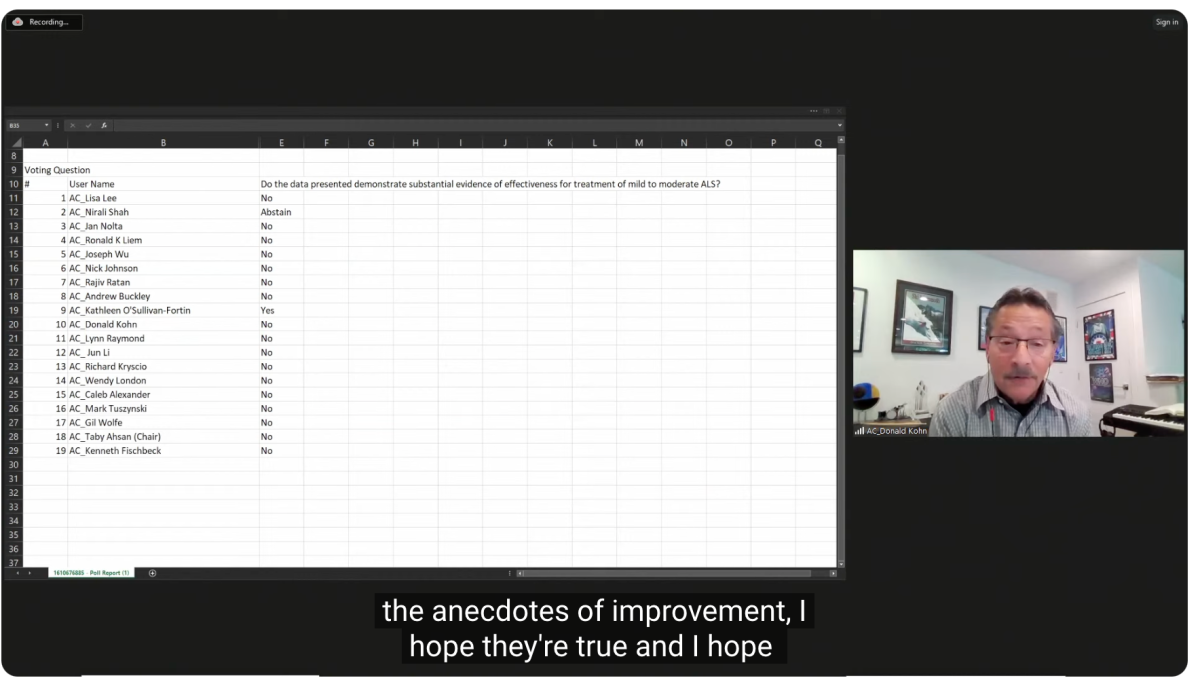
Un comité asesor de la FDA rechazó un esfuerzo de tipo apelación por Terapéutica celular BrainStorm por su producto Nurown para ELA.
Vi un poco de la reunión del panel y fueron bastante negativos. Tenían grandes preocupaciones sobre los datos, así como incógnitas sobre cómo se suponía que funcionaría el producto. También existía la posibilidad, dijeron varios miembros del comité, de que Nurown dañara a algunos pacientes.
Al final sólo una persona votó “sí”, diecisiete dijeron “no” y uno se abstuvo. Publiqué el voto arriba del video. Recientemente escribí sobre cómo vi este esfuerzo de la empresa como una Ave María. La FDA tiene ahora hasta principios de diciembre para tomar una decisión final. Parece muy poco probable que Nurown avance en este momento.
Neuron también ha estado en ensayos clínicos para la EM y representa otro posible enfoque con células madre para la EM, pero los datos hasta ahora no han sido tan alentadores.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- Fuente: https://ipscell.com/2023/10/weekly-reads-stem-cells-for-ms-kimera-labs-ind-fda-lawsuit/



