Estimado editor,
Las glándulas sebáceas (SG) contribuyen al 90% de la producción de lípidos de la superficie de la piel y desempeñan funciones fundamentales en la regulación de las funciones adecuadas de la piel, incluido el mantenimiento de la barrera epidérmica, las respuestas inmunitarias dérmicas y las actividades antimicrobianas corporales globales.1 La reducción de los lípidos sebáceos se ha relacionado con diversas enfermedades de la piel, incluida la alopecia cicatricial, la inflamación, el picor crónico y el envejecimiento prematuro de la piel.2 Especialmente, la reparación de cicatrices después de quemaduras profundas o defectos cutáneos a gran escala a menudo conduce a una pérdida irreversible de apéndices. Debido a la falta de SG, los tejidos regenerados no pueden recapitular completamente la integridad estructural y funcional de la piel normal. Por lo tanto, la generación de células SG expandibles con potencial de desarrollo y producción de lípidos representa un enfoque prometedor para tratar la piel enferma, dañada o envejecida con una mejor calidad de vida. Recientemente, la reprogramación celular directa se ha utilizado ampliamente para obtener células humanas difíciles de mantener mediante factores de transcripción (TF) específicos del tipo celular. También se utilizan moléculas pequeñas para promover la reprogramación celular mediada por TF y acortar el proceso de generación de células personalizadas más seguras para trasplante. Sin embargo, hasta el momento no se ha investigado la conversión de células somáticas humanas en células SG. Aquí, describimos una estrategia de reprogramación paso a paso que permite la generación de células SG humanas expandibles y funcionalmente competentes.
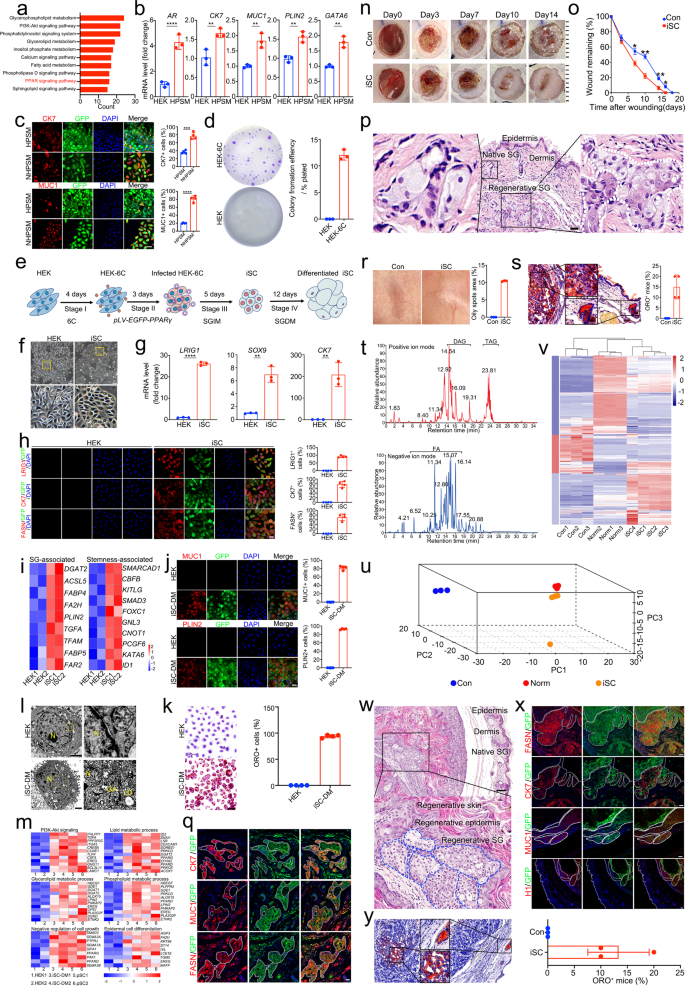
Los queratinocitos epidérmicos humanos (HEK) aislados del prepucio de un adulto no mostraron contaminación de las células SG según lo analizado por qRT-PCR e inmunofluorescencia (Fig. S1a,b). El análisis comparativo del transcriptoma entre HEK y las células SG primarias (pSC) reveló que los genes expresados diferencialmente (DEG) regulados positivamente estaban significativamente involucrados en varios procesos biológicos relevantes para la adipogénesis y el metabolismo de los lípidos (Fig. S2a), en el que la vía de señalización de PPAR se enriqueció mediante análisis KEGG (Fig. 1a). En consecuencia, se seleccionó PPARγ como un posible factor determinante del destino de SG debido a su papel único en la especificación y el patrón de SG.3,4 Para inducir la conversión de SG, se generaron HEK que sobreexpresan establemente PPARγ (HEK-PPARγ) utilizando lentivirales. pLV-CMV-PPARγ-P2A-EGFP vector (Fig. S2b,c). El análisis de KEGG mostró que los DEG regulados positivamente se enriquecieron principalmente en vías relacionadas con lípidos, y la vía de señalización de PPAR se activó después de la sobreexpresión de PPARγ (Figura complementaria. S2d). Luego, cambiamos HEK-PPARγ al medio de inducción SG (SGIM) que contiene moléculas de organogénesis SG EGF, FGF7 y FGF10. A partir de entonces, los HEK-PPARγ cultivados en SGIM se denominaron HPSM. Después de 3 días de exposición, surgió HPSM con morfología similar a células SG (Fig. 2e). qRT-PCR mostró que varios genes SG clave, incluidos AR, GATA6, CK7, así como marcadores de diferenciación SG. MUC1 y PLIN2, estuvieron marcadamente regulados al alza el día 6 (Fig. 1b). Una inmunofluorescencia adicional demostró que el porcentaje de HPSM que expresaba MUC1, CK7 y FASN fue de 29.2 ± 3.2 %, 37.2 ± 2.7 % y 52.9 ± 6.6 %, respectivamente (Fig. S2f, gramo).
Reprogramación de las glándulas sebáceas con un solo gen, PPARGy moléculas pequeñas. a Análisis KEGG de genes relacionados con lípidos regulados positivamente en pSC en comparación con HEK. pSC, células SG primarias. b Análisis qRT-PCR de la expresión transcripcional de AR, CK7, MUC1, PLIN2y GATA6 en HEK y HPSM. Los datos se expresan como media ± DE; n = 3. **p < 0.01; ****p < 0.0001. HPSM, HEK sobreexpresa establemente PPARγ y se cultiva en SGIM. c Inmunofluorescencia representativa de CK7 y MUC1 en HPSM y NHPSM (izquierda) y análisis cuantitativo de CK7+ y MUC1+ células en HPSM y NHPSM (derecha). NHPSM, HEK neonatal que sobreexpresa establemente PPARγ y cultivada en SGIM; Barra de escala = 50 μm. La cuantificación se realizó con cuatro campos de microscopía individuales seleccionados al azar. d Imágenes representativas de ensayos de unidades formadoras de colonias (UFC) en HEK y HEK-6C (izquierda) y cuantificación de su eficiencia de formación de colonias (derecha). n = 3. HEK-6C, HEK tratada con los químicos 616452 (6) y CHIR99021 (C). e Vista esquemática del diagrama de reprogramación de iSC. Las HEK tratadas con 6C (HEK-6C) durante 4 días se transdujeron con PPARγ y se sembraron en medio HEK. Luego, las células HEK-6C infectadas se transfirieron a SGIM y se cultivaron durante los días indicados. iSC, células de glándulas sebáceas inducidas. SGIM, medio de inducción de glándulas sebáceas; SGDM, también llamado DM, medio de diferenciación de glándulas sebáceas. f Imágenes de contraste de fase que muestran los cambios morfológicos obvios de iSC en comparación con HEK. Barra de escala = 100 μm. Inserciones, mayor aumento de las áreas del recuadro. g Análisis qRT-PCR de la expresión transcripcional de CK7, LRIG1y SOX9 en HEK e iSC. Los datos se presentan como media ± DE; n = 3. **p < 0.01; ****p <0.0001. h Inmunofluorescencia representativa de LRIG1, CK7 y FASN en HEK e iSC (izquierda) y análisis cuantitativo de LRIG1+, CK7+y FASN+ células en HEK e iSC (derecha). Barra de escala = 25 μm. La cuantificación se realizó con cuatro campos de microscopía individuales seleccionados al azar. i Mapa de calor de genes asociados a tallo y SG en iSC en comparación con HEK (ajustar P valor < 0.05). j Inmunofluorescencia representativa de MUC1 y PLIN2 en HEK e iSC-DM (izquierda) y análisis cuantitativo de MUC1+ y PLIN2+ células en HEK e iSC-DM (derecha). Barra de escala = 25 μm. La cuantificación se realizó con cuatro campos de microscopía individuales seleccionados al azar. iSC-DM, iSC cultivada en medio de diferenciación de glándulas sebáceas (DM). k Imágenes representativas de la tinción con rojo aceite O (ORO) en HEK e iSC-DM (izquierda), y análisis cuantitativo de células positivas con tinción ORO en HEK e iSC-DM (derecha). Barra de escala = 25 μm. La cuantificación se realizó con cuatro campos de microscopía individuales seleccionados al azar; l Análisis de ultraestructura de HEK e iSC-DM. Barras de escala = 2000 nm. Inserciones, mayor aumento de las áreas del recuadro. N, nucleares; GA, aparato de Golgi; LD, gotita de lípidos. m Mapa de calor que representa la vía KEGG representativa y los términos GO de expresión génica entre iSC-DM, pSC y HEK (ajustar P valor < 0.05). n Imágenes macroscópicas representativas de la cicatrización de heridas en los días indicados en ratones control y tratados con iSC. o. Cuantificación de las áreas de heridas restantes los días 0, 3, 7, 10, 14, 16 y 18 en los ratones control y tratados con iSC en relación con el área original, respectivamente (n = 40, por grupo). *p <0.05; **p <0.01. p Tinción H&E representativa en ratones tratados con iSC el día 71. Barras de escala = 50 μm. Inserciones, mayor aumento de las áreas del recuadro. q Inmunofluorescencia de la expresión del marcador SG en estructuras SG de novo el día 71 después del tratamiento con iSC. GFP+ Se observaron células en las estructuras similares a SG, y la SG regenerada expresó marcadores específicos de SG, incluidos CK7, FASN y MUC1. Barra de escala = 25 μm. r Imágenes macroscópicas representativas de la piel regenerada en el grupo de control y tratado con iSC (izquierda) el día 71. Análisis cuantitativo de la untuosidad de la piel (derecha) de 3 experimentos independientes. s Tinción ORO representativa de la piel regenerada en ratones tratados con iSC (izquierda) el día 71. Barras de escala = 50 μm. Inserciones, mayor aumento de las áreas del recuadro; Evaluación de la tinción ORO (derecha) de SG de novo que muestra, después de 71 días de tratamiento con iSC, 15.00 ± 2.887% de las muestras de piel de los ratones receptores (n = 40) fueron positivas para la tinción ORO. Los datos se representan como media ± DE t Cromatograma del pico base de muestras de piel de ratones tratados con iSC adquiridas en modo de ionización positiva (arriba) y negativa (abajo). DAG, diglicéridos. TAG, triglicérido. FFA, ácidos grasos libres. u Gráfico de cargas de PCA que muestra tres direcciones principales identificadas entre las muestras de piel normal, tratada con iSC y de control que representan el 92.6 % de la variación total. El efecto principal está asociado con las características de SG donde las cargas se agrupan estrechamente entre las muestras de piel normal y tratada con iSC, pero de manera distinta del grupo de control. v Intensidades normalizadas de compuestos lipídicos identificados en las muestras de piel normal, tratada con iSC y de control. Diez columnas están organizadas mediante agrupamiento jerárquico no supervisado, mientras que las filas están organizadas según los resultados de k-significa agrupamiento. w Tinción H&E representativa de la piel regenerada en ratones trasplantados por vía subcutánea con iSC el día 112 después de la operación. En los ratones trasplantados con iSC se observaron estructuras emergentes similares a la piel que contienen epidermis queratinizada, así como estructuras subyacentes similares a SG. La línea de puntos representa el borde exterior de la arquitectura glandular regenerada ectópicamente. Barras de escala = 100 μm. Inserciones, mayor aumento de las áreas del recuadro. x Inmunofluorescencia de la expresión del marcador SG en las estructuras tipo SG regeneradas ectópicamente el día 112 después del trasplante. PPARγ-GFP+ Se observaron células en las estructuras tipo SG regeneradas ectópicamente. La inmunofluorescencia de la proteína histona específica humana (H1) confirmó aún más el origen humano de las estructuras similares a SG regeneradas ectópicamente. El SG regenerado ectópicamente mostró características morfológicas de SG y expresó marcadores específicos de SG, incluidos CK7, FASN y MUC1. La línea de puntos representa el borde exterior de la arquitectura glandular regenerada ectópicamente. Barras de escala = 25 μm. y La tinción ORO representativa de SG se regeneró ectópicamente el día 112 (izquierda). La evaluación de la tinción ORO (derecha) del SG regenerado ectópicamente involucró muestras de piel de control y tratadas con iSC de 3 experimentos independientes. Después de 112 días de tratamiento con iSC, 13.33 ± 3.33% de los ratones receptores (n = 40) exhibieron SG ectópico que contenía lípidos en comparación con el grupo de control (n = 40). Barras de escala = 50 μm. Inserciones, mayor aumento de las áreas del recuadro. Los datos se representan como media ± DE
Para probar la confiabilidad de nuestra estrategia de inducción, también se transdujeron HEK neonatales (NHEK) con PPARγ (NHEK-PPARγ) (Fig. S3a,b). De manera similar, la morfología similar a la de las células SG apareció después de 3 días de inducción de SGIM (Fig. 3c). El aumento de la expresión de CK7 y MUC1 se confirmó mediante qRT-PCR e inmunofluorescencia (Fig. 3d-f). En particular, la eficiencia de conversión de NHEK fue mayor que la de HEK adulta, como lo demuestra la inmunofluorescencia de CK7 (77.0 ± 4.3 % frente a 36.4 ± 2.1 %) y MUC1 (80.9 ± 3.9 % frente a 19.9 ± 0.6 %), lo que sugiere que NHEK fueron más susceptibles a la reprogramación celular que las HEK adultas (Fig. 1c). Además, la qRT-PCR y la inmunofluorescencia revelaron que los genes asociados a la potencia se expresaban altamente en NHEK (Fig. S4a,b). Los resultados del ensayo CFU mostraron que NHEK poseía una fuerte capacidad de crecimiento clonal (Fig. S4c, re). Por lo tanto, planteamos la hipótesis de que factores adicionales que mejoran la potencia pueden aumentar la eficiencia de la reprogramación de SG. Con este fin, se agregaron dos productos químicos reportados, 616452 (6) y CHIR99021 (C), para mejorar la conversión de SG en función de sus funciones conocidas en la mejora de la potencia.5,6 Como era de esperar, la qRT-PCR y la inmunofluorescencia mostraron una expresión regulada positivamente de genes asociados a la potencia en el HEK tratado con 6C (Figura complementaria). S5a,b). Los ensayos de UFC demostraron además que el pretratamiento con 6C desencadenó una mayor capacidad para formar colonias más grandes (Fig. 1d).
Dados estos resultados, diseñamos la estrategia para reprogramar sistémicamente HEK en células SG inducidas (iSC) combinando el pretratamiento con 6C, la sobreexpresión de PPARγ y el cultivo de SGIM (Fig. 1e). Las células inducidas crecieron rápidamente y mostraron agregados apretados típicos con morfología similar a la de células SG en el día 12 (Fig. 1f). Además, los niveles de ARNm de CK7 y marcadores progenitores SG LRIG1 y SOX9 estaban significativamente regulados positivamente en iSC (Fig. 1g). La inmunofluorescencia reveló que iSC expresaba LRIG1, CK7 y FASN, lo que demuestra una ganancia del fenotipo progenitor SG (Fig. 1h). Un mapa de calor del genoma adicional mostró que los iSC se parecían a sus homólogos in vivo en términos de perfiles de expresión, incluidos genes de síntesis de lípidos, genes de proteínas de unión a ácidos grasos y factores de transcripción asociados al metabolismo de los lípidos. Los TF que modulan el mantenimiento de las células madre y los componentes de señalización que regulan la proliferación de progenitores también se enriquecieron en iSC, lo que sugiere que las iSC convertidas exhibieron características moleculares de los progenitores SG (Fig. 1i).
Para caracterizar sus propiedades funcionales in vitro, las iSC se transfirieron a un medio de diferenciación SG. Después de 10 a 14 días de diferenciación, el iSC exhibió una morfología poligonal típica (Figura complementaria). 6a). El análisis de inmunofluorescencia demostró que las iSC cultivadas en medio de diferenciación SG exhibieron un porcentaje dramáticamente mayor de MUC1.+ células (81.9 ± 2.4%) y PLIN2+ células (92.6 ± 0.6%) (Fig. 1j). El análisis de la ultraestructura de las células diferenciadas mostró orgánulos productores de lípidos típicos, incluido el aparato de Golgi y gotitas de lípidos (Fig. 1l). Sorprendentemente, el examen funcional mediante tinción con ORO mostró una acumulación masiva de gotas de lípidos en las iSC diferenciadas, lo que sugiere que las iSC pueden imitar a los progenitores SG nativos con actividad de síntesis de lípidos tras la diferenciación (Fig. 1k). Mediante análisis de cariotipo, tanto los sebocitos diferenciados iSC como los derivados de iSC fueron establemente expandibles in vitro con cariotipos normales (Fig. 6b). Los perfiles de expresión génica adicionales mediante RNA-seq mostraron que las iSC diferenciadas mostraban patrones de expresión como las células SG primarias en un conjunto de genes implicados en el metabolismo de los lípidos, el metabolismo de los glicerolípidos y el metabolismo de los fosfolípidos (Fig. 1m).
Para investigar su potencial de reconstitución tisular in vivo, se inyectó por vía intradérmica la mezcla de iSC y fibroblastos humanos o solo fibroblastos (como control) en una herida escisional piloto de espesor total. En comparación con el grupo de control, se observó una aceleración significativa del cierre de la herida en los ratones trasplantados con iSC (Fig. 1n, oh). Además, se observaron estructuras glandulares de novo bien organizadas con características SG dentro de la dermis de ratones trasplantados con iSC a los 71 días (Fig. 1p). Las secciones de tejido de las heridas obtenidas demostraron que la progenie de iSC marcada con GFP sobrevivió y los grupos de GFP+ Se observaron ampliamente células que expresaban MUC1, FASN y CK7 en el SG recién formado (Fig. 1q). La evaluación posterior de la untuosidad de la piel reepitelizada mostró que las heridas tratadas con iSC presentaban más grasa que las heridas de control (Fig. 1r). La tinción con ORO confirmó que, de manera similar a la SG nativa, la SG regenerada tiene función de síntesis de lípidos, y aproximadamente el 15 ± 2.9% de los ratones tratados con iSC mostraron tinción ORO positiva (Fig. 1s). La caracterización de los perfiles lipídicos mediante cromatografía líquida de alta resolución junto con espectrometría de masas reveló que un espectro específico de lípidos, incluidos triacilgliceroles, diacilgliceroles y ácidos grasos libres, se enriquecieron en la piel regenerada de ratones tratados con iSC (Fig. 1t). Un análisis de componentes principales (PCA) adicional y un análisis de agrupamiento jerárquico mostraron que los perfiles lipidómicos de la piel regenerada de la herida tratada con iSC se agruparon estrechamente con los de la piel normal (Fig. 1u,v), lo que indica que iSC podría facilitar la regeneración funcional de SG.
Para determinar si la capacidad regenerativa de las iSC podría verse afectada por microambientes extraños, a continuación desafiamos la capacidad regenerativa de las iSC trasplantándolas a la capa de músculo subcutáneo. Después de 112 días, se observaron estructuras similares a la piel regeneradas ectópicamente en la subfascia (Fig. 1w), que poseía epidermis multicapa queratinizada y dermis que contenía estructuras tipo SG con dominio glandular visible (Fig. 1w). La inmunofluorescencia confirmó la expresión de FASN, CK7 y MUC1 en el SG regenerado ectópicamente por iSC (Fig. 1x). Además, la proteína histona H1 específica de humanos confirmó aún más el origen humano de GFP+ Estructuras glandulares SG (Fig. 1x). Finalmente, la tinción con ORO mostró que el SG regenerado ectópicamente tenía función de síntesis de lípidos, y aproximadamente (13.33 ± 3.3%) de los ratones fueron positivos para la tinción con ORO (Fig. 1y).
En conclusión, las células SG humanas con capacidad regenerativa pueden generarse mediante reprogramación de linaje dirigida por un solo factor, lo que destaca las posibles implicaciones terapéuticas para la curación personalizada de heridas y el retraso del envejecimiento de la piel.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Automoción / vehículos eléctricos, Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- Desplazamientos de bloque. Modernización de la propiedad de compensaciones ambientales. Accede Aquí.
- Fuente: https://www.nature.com/articles/s41392-023-01531-3