Aprenda a crear un procedimiento de UDI para cumplir con los requisitos reglamentarios de la FDA y la UE para el cumplimiento de UDI.
Tu carrito esta vacío
Se requiere un Identificador único de dispositivo o UDI para todos los dispositivos y diagnósticos in vitro (IVD) en los EE. numero de lote. Para cumplir con estos requisitos UDI, necesitará un procedimiento UDI que cumpla con las reglamentaciones estadounidenses (es decir, 21 CFR 830 y partes de 21 CFR 801). Para cumplir con la normativa europea, necesitará un procedimiento UDI que cumpla con el artículo 24 y el anexo VI del IVDR y el artículo 27 y el anexo VI del MDR. El siguiente video proporciona una descripción general del procedimiento UDI de Medical Device Academy.
[Contenido incrustado]
¿Qué incluye nuestro Trámite UDI?
El procedimiento UDI cumple con ISO 13485:2016 así como la normativa europea y estadounidense. El procedimiento incluye la siguiente lista de documentos:
- SYS-039 A D5 Procedimiento de requisitos UDI
- FRM-016 A D1 FDA UDI Lista de verificación
- FRM-017 A D2 Lista de verificación de UDI de la UE
Incluiremos un seminario web de capacitación que explica el sistema UDI de la FDA y la plataforma de diapositivas de presentación nativa, y proporcionaremos un examen (es decir, un cuestionario de 10 preguntas) para verificar la eficacia de la capacitación. Si nos envía el examen completo por correo electrónico en el formato nativo de MS Word, corregiremos el examen y le enviaremos por correo electrónico un certificado de capacitación con su examen corregido. El sitio web de la FDA también proporciona información sobre el sistema UDI. También proporcionamos notificaciones por correo electrónico de actualizaciones gratuitas del procedimiento y formularios cuando actualizamos el procedimiento para cumplir con las regulaciones nuevas y revisadas.
SYS-039 Procedimiento de requisitos de UDI, paquete de seminario web y examen
SYS-039, Paquete de procedimientos de requisitos UDI; Esta capacitación incluye nuestro procedimiento para los requisitos de UDI y la plantilla de la FDA para los elementos de datos de GUDID. También recibirá un enlace para descargar nuestra plataforma de diapositivas y la grabación del seminario web sobre el etiquetado UDI. También proporcionamos un cuestionario de 10 preguntas sobre los requisitos UDI de la FDA y un certificado de capacitación cuando completa el cuestionario y lo envía a Medical Device Academy para su calificación.
Precio: $299.00
¿Qué es una UDI?
UDI significa 'Identificador único de dispositivo'. Este es un código de identificación de dos partes que se utiliza como parte del Sistema de identificación de dispositivo único de la FDA. La FDA emitió su regla final sobre los sistemas de identificación de dispositivos únicos el 24 de septiembre de 2013, con fecha de entrada en vigencia el 23 de diciembre de 2013. El documento completo de 44 páginas se puede ver en el sitio web del Registro Federal.
La idea o el concepto de tener un identificador único para cada dispositivo médico no es un concepto nuevo llamativo y se ha utilizado en otras industrias durante muchos años. Un UDI podría ser comparable a un VIN y placas de matrícula para vehículos o incluso números de seguro social y números de licencia de conducir en personas. La idea es que haya una información rastreable que identifique los tipos individuales de dispositivos médicos.
Las dos partes de un UDI
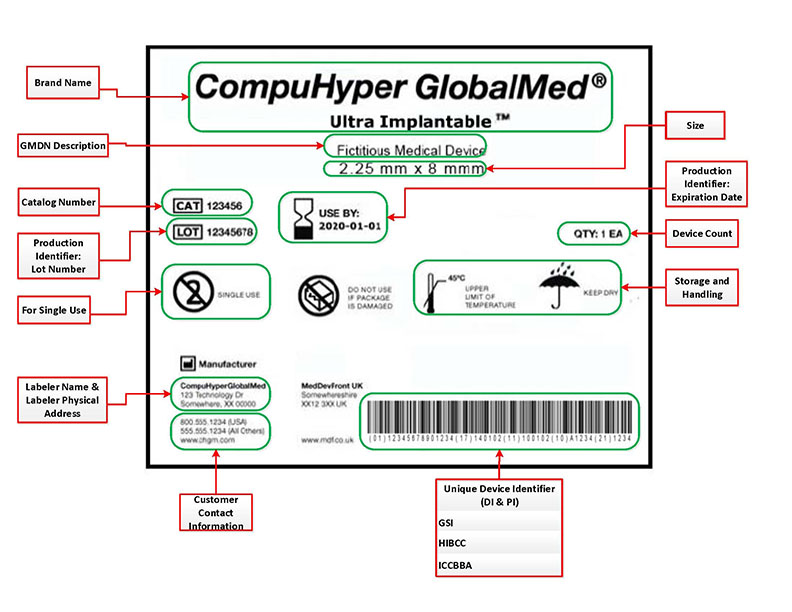
Un UDI incluye dos partes. Uno es el 'Identificador de dispositivo' o DI, y el otro es el 'Identificador de producción' o PI. La porción DI es el 'Identificador de dispositivo'. Esta parte del UDI es obligatoria y sirve para identificar a la etiquetadora y el modelo específico del dispositivo etiquetado. Una vez que se ha asignado el DI, es permanente y no se puede cambiar. Cada variable del dispositivo requerirá su propio DI. Por ejemplo, si se produjeran varias opciones de tamaño para un dispositivo, cada tamaño disponible requeriría una DI. Otras variaciones, como las diferencias de color y diseño estético o ergonómico, también requieren números DI separados.
El 'Identificador de producción' o PI y, a diferencia del identificador de dispositivo, el PI identifica una de varias piezas de información. Siento que la mejor manera de explicar qué información proporciona el PI es citar directamente a la propia FDA.
“un identificador de producción (PI), una parte condicional y variable de un UDI que identifica uno o más de los siguientes cuando se incluye en la etiqueta de un dispositivo:
- el número de lote o lote dentro del cual se fabricó un dispositivo;
- el número de serie de un dispositivo específico;
- la fecha de vencimiento de un dispositivo específico;
- la fecha en que se fabricó un dispositivo específico;
- el código de identificación distintivo requerido por §1271.290(c) para una célula humana, tejido o producto celular y basado en tejido (HCT/P) regulado como un dispositivo”. (FDA, Fundamentos UDI 2015).
Si una empresa tuviera que producir varios lotes o lotes de un dispositivo, el DI seguiría siendo el mismo, pero el PI sería diferente para cada lote producido.
Formatos UDI
Su UDI debe proporcionarse en dos formatos separados. Una es una versión de texto sin formato que es simplemente un código alfanumérico que se correlaciona con la información que está tratando de transmitir. Este es un código DI/PI que debe estar etiquetado en el empaque de su dispositivo médico o, en algunos casos, en el propio dispositivo.
Un segundo formato es un formulario compatible con AIDC. AIDC significa 'Identificación automática y captura de datos'. AIDC recopila su información sin tener que ingresar manualmente todos sus datos. Generalmente, se trata de algún tipo de código de barras o código QR.
Puede ver ejemplos de la tecnología AIDC en nuestra vida diaria. Algunos de los ejemplos más comunes son los códigos de barras, como se mencionó anteriormente, y las bandas magnéticas y chips como vemos en nuestras tarjetas de crédito y débito. RFID, escáneres ópticos y otros datos biométricos también se incluyen como algunos de los métodos AIDC menos comunes.
Para más información sobre la tecnología AIDC en general, puede seguir el 3rd sitio web del partido.
(Imagen referenciada de Sitio web de la FDA)
¿Dónde están ubicados los UDI?
Su UDI debe estar ubicado en la etiqueta de su dispositivo. Esta es una regla general, pero la FDA tiene múltiples exenciones y alternativas basadas en el uso y la clasificación del dispositivo. Los UDI deben marcarse directamente en los dispositivos en caso de que estén destinados a usarse más de una vez y reprocesarse antes de cada uso.
Si está escribiendo un procedimiento UDI para su empresa, vuelva a verificar que su dispositivo no se encuentre dentro de ninguna de las excepciones de la FDA.
Un ejemplo de una de las excepciones que pueden aplicarse a su dispositivo es: “Si su dispositivo es de Clase I, puede usar un Código de producto universal (UPC) para que sirva como UDI en la etiqueta y el paquete del dispositivo. Además, no se requiere que el UDI en sus dispositivos de clase I incluya un PI”. (FDA, Guía de Cumplimiento para Pequeñas Entidades, 2014).
Niveles de empaquetado para UDI
Cada 'nivel de paquete' también requiere un nuevo DI. Por ejemplo, si su dispositivo médico fuera una jeringa de insulina que vendiera en paquetes de 10 y al por mayor en paquetes de 100, cada uno necesitaría un 'Identificador de dispositivo' individual. Esto no significa que cada paquete de 10 o 100 necesite su propio DI. Estos no son un lote o números de lote. Estos números son para información del usuario, por lo que los materiales de envío, como paletas y envolturas retráctiles, no requieren etiquetado DI/PI. Sin embargo, los diferentes modelos o cualquier actualización sustancial del dispositivo médico necesitarán su DI.
Siempre que su jeringa solo se venda como una jeringa individual, el UDI y el etiquetado cumplen. Tan pronto como se introduce un nivel de empaquetado adicional, se requiere un UDI adicional. Usando el mismo ejemplo de jeringas, si las jeringas también se venden en paquetes que contienen cinco de sus dispositivos médicos ya etiquetados, ese paquete necesita su número UDI. Se requeriría otra UDI si las jeringas se vendieran en paquetes de diez, veinticinco o cincuenta. Cada nivel de empaque en el que se vende el dispositivo requiere un UDI.
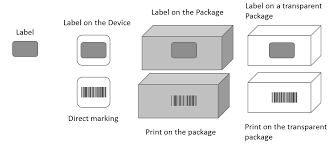
¿Qué no se considera un nivel de embalaje adicional? Las medidas para proteger sus productos durante el envío no se consideran niveles de embalaje adicionales. Esto incluye paletizar y envolver sus productos para protegerlos de daños durante el envío. Las paletas, los contenedores de envío y los remolques no requieren un UDI.
Productos actualizados y UDI's
Los UDI son específicos para modelos individuales de productos y dispositivos. Como cada nivel de empaque o variación de producto, como el tamaño ofrecido, requiere un UDI, también lo requiere cada cambio y actualización de dispositivo. Supongamos que lanzó su dispositivo hace 2 años y, según los comentarios de los consumidores, decidió realizar algunos cambios en su dispositivo. La nueva versión de su dispositivo ahora ya no es la misma que tenía el UDI anterior emitido.
Ahora necesitaría un UDI para el 'producto nuevo' esencialmente. También deberá abordar los mismos requisitos de cumplimiento para los niveles de empaque y las variaciones que hizo con el producto original. A medida que actualice su producto, tenga en cuenta que es posible que también deba actualizar su UDI.
Requisitos de formato de fecha UDI
El formato de fecha en las etiquetas de los dispositivos debe estar en el 'Estándar internacional', que consiste en Año-Mes-Día a diferencia de lo que normalmente se vería en los Estados Unidos, que es Mes-Día-Año. Por ejemplo, la fecha del 18 de abril de 2018 debería escribirse 2018-04-18.
Este formato debería usarse en su etiquetado para cosas como la fecha de fabricación y vencimiento de su producto o dispositivo.
Para las etiquetas UDI, la fecha de cumplimiento para implementar el Estándar Internacional de Fecha será la misma que las fechas de cumplimiento para UDI/AIDC.
Fechas de Cumplimiento para Dispositivos Clase I y No Clasificados.
A continuación se muestra la tabla de fechas de cumplimiento de UDI de la FDA.
Para ampliar las fechas de cumplimiento de los dispositivos médicos de menor riesgo, la FDA planea emitir un documento de orientación para proporcionar una política discrecional de aplicación para el etiquetado, el envío de datos GUDID, el formato de fecha estándar y los requisitos de marcado directo para dispositivos de clase I y no clasificados, como se indica. en la Figura 1 a continuación. Esta política de discrecionalidad de ejecución no se aplicaría a la clase I o dispositivos implantables, de soporte vital o de soporte vital no clasificados1 porque los etiquetadores de estos dispositivos ya deben cumplir con los requisitos de UDI.
| Tipo de dispositivo | Requisitos de etiqueta (21 CFR 801.20), envío de GUDID (21 CFR parte 830, subparte E) y formato de fecha estándar (21 CFR 801.18) | Requisitos de marca directa (21 CFR 801.45) |
| Dispositivos de clase 12 | 24 de septiembre de 2020 | 24 de septiembre de 2022 |
| Dispositivos sin clasificar | 24 de septiembre de 2020 | 24 de septiembre de 2022 |
Figura 1 y XNUMX
1 Para dispositivos implantables, de soporte vital o de soporte vital de todas las clases, la fecha de cumplimiento de todos los requisitos de UDI y el requisito de formato de fecha estándar (21 CFR 801.18) fue el 24 de septiembre de 2015.
2 Los dispositivos exentos de CGMP Clase I están exentos de los requisitos de UDI. 21 CFR 801.30(a)(2)
Para más información, ver "Carta a los etiquetadores de dispositivos sobre las fechas de cumplimiento de UDI para dispositivos de clase I y no clasificados: 2 de junio de 2017.
Fechas de cumplimiento establecidas por la FDA en conjunto con la regla final de UDI
| Fecha de cumplimiento | Requisito |
| 1 año después de la publicación de la regla final (24 de septiembre de 2014) | Las etiquetas y paquetes de dispositivos médicos de clase III y dispositivos con licencia bajo la Ley de Servicios de Salud Pública (Ley PHS) deben llevar un UDI. § 801.20. Las fechas en las etiquetas de estos dispositivos deben tener el formato requerido por § 801.18. Los datos de estos dispositivos deben enviarse a la base de datos GUDID. § 830.300. Se puede solicitar una extensión de 1 año de esta fecha de cumplimiento según § 801.55; dicha solicitud debe presentarse a más tardar el 23 de junio de 2014. El software autónomo de Clase III debe proporcionar su UDI según lo exige § 801.50(b). |
| 2 años después de la publicación de la regla final (24 de septiembre de 2015) | Las etiquetas y paquetes de dispositivos implantables, de soporte vital y de mantenimiento de la vida debe llevar una UDI. § 801.20. Las fechas en las etiquetas de estos dispositivos deben tener el formato requerido por § 801.18. |
| Un dispositivo que es un dispositivo de soporte vital o de mantenimiento de la vida que debe etiquetarse con un UDI debe llevar un UDI como una marca permanente en el dispositivo mismo si el dispositivo está destinado a usarse más de una vez y debe reprocesarse. antes de cada uso. § 801.45. El software independiente que es un dispositivo de soporte vital o de soporte vital debe proporcionar su UDI según lo exige § 801.50(b). |
|
| Los datos de dispositivos implantables, de soporte vital y de soporte vital que deben etiquetarse con un UDI deben enviarse a la base de datos GUDID. § 830.300. | |
| 3 años después de la publicación de la regla final (24 de septiembre de 2016) | Los dispositivos de Clase III que deben etiquetarse con un UDI deben llevar un UDI como una marca permanente en el propio dispositivo si el dispositivo está destinado a usarse más de una vez y debe reprocesarse antes de cada uso. § 801.45. |
| Las etiquetas y envases de los dispositivos médicos de clase II deben llevar una UDI. § 801.20. Las fechas en las etiquetas de estos dispositivos deben tener el formato requerido por § 801.18. El software autónomo de Clase II debe proporcionar su UDI según lo exige § 801.50(b). |
|
| Los datos de los dispositivos de clase II que deben etiquetarse con un UDI deben enviarse a la base de datos GUDID. § 830.300. | |
| 5 años después de la publicación de la regla final (24 de septiembre de 2018) | Un dispositivo de clase II que debe etiquetarse con un UDI debe llevar un UDI como una marca permanente en el propio dispositivo si el dispositivo está destinado a usarse más de una vez y debe reprocesarse antes de cada uso. § 801.45. |
| Las etiquetas y envases de los dispositivos médicos de clase I y los dispositivos que no hayan sido clasificados en clase I, clase II o clase III deben llevar una UDI. § 801.20. Fechas en las etiquetas de todos los dispositivos, incluidos los dispositivos que han sido exceptuados de los requisitos de etiquetado UDI, deben tener el formato requerido por § 801.18. |
|
| Los datos de los dispositivos de clase I y los dispositivos que no han sido clasificados en clase I, clase II o clase III que deben etiquetarse con un UDI deben enviarse a la base de datos GUDID. § 830.300. El software autónomo de Clase I debe proporcionar su UDI según lo exige § 801.50(b). |
|
| 7 años después de la publicación de la regla final (24 de septiembre de 2020) | Los dispositivos de Clase I y los dispositivos que no han sido clasificados en Clase I, Clase II o Clase III que deben estar etiquetados con un UDI, deben llevar un UDI como una marca permanente en el propio dispositivo si el dispositivo es un dispositivo destinado para ser utilizado más de una vez y destinado a ser reprocesado antes de cada uso. § 801.45. |
| Fechas de cumplimiento para todas las demás disposiciones de la regla final. Con excepción de las disposiciones enumeradas anteriormente, la FDA exige el pleno cumplimiento de la regla final a partir de la fecha de vigencia que se aplica a la disposición. | |
Requisitos del Sistema de Calidad UDI
Para cumplir con la Parte 803.22 Informes de Dispositivos Médicos y la Regulación del Sistema de Calidad 820.198, la documentación de los números UDI incluidos en la etiqueta del dispositivo se requiere específicamente o es aplicable para cumplir con los requisitos específicos de documentación e informes.
CFR 21 Capítulo I Subcapítulo H Dispositivos médicos Parte 803.33 Informe de dispositivos médicos
“(a) Debe enviarnos un informe anual en el formulario FDA 3419. Debe enviar un informe anual antes del 1 de enero de cada año. Puede obtener este formulario de las siguientes fuentes:
(iv) Número de modelo, catálogo, serie y lote del producto e identificador único de dispositivo (UDI) que aparece en la etiqueta del dispositivo o en el paquete del dispositivo”.
(Para ver en su totalidad visite el sitio web de regulación)
Para manejar las quejas como parte de su sistema de calidad, la inclusión del UDI en su registro de investigación es una parte específicamente listada de identificaciones de dispositivos y números de control necesarios para informar y mantener registros.
Regulación del Sistema de Calidad Sub Parte M Registros 820.198
“(e) Cuando se realiza una investigación en virtud de esta sección, la unidad formalmente designada identificada en el párrafo (a) de esta sección deberá mantener un registro de la investigación. El registro de la investigación deberá incluir:
(1) El nombre del dispositivo;
(2) La fecha en que se recibió la queja;
(3) Cualquier identificador de dispositivo único (UDI) o código de producto universal (UPC), y cualquier otra identificación de dispositivo y número de control utilizado;”
(Para ver en vista completa el sitio web de regulación)
Agencias Emisoras de UDI
Se requiere que todos los UDI se emitan bajo un sistema operado por una "Agencia Emisora" acreditada por la FDA. Al momento de escribir esto, la FDA actualmente solo tiene tres IA acreditados por la FDA. Están GS1, HIBCC, y la ICCBBA. La regla UDI proporciona un proceso a través del cual una agencia buscaría la acreditación de la FDA. especifica la información que el solicitante debe proporcionar a la FDA y los criterios que la FDA aplicará al evaluar las solicitudes.
Para solicitar la acreditación de la FDA como agencia emisora de UDI, su procedimiento de UDI debe definir el proceso descrito en 21 CFR 830 Subparte C. Esto especifica la información que debe proporcionarse a la FDA, así como los criterios de evaluación de la FDA. La FDA también solicita que las agencias que buscan una acreditación inicial se comuniquen directamente con la FDA al gudidsupport@fda.hhs.gov.
Procedimiento UDI para Etiquetadoras
Los etiquetadores son, en última instancia, los responsables de cumplir con los requisitos de etiquetado UDI de la FDA. ¿Eres etiquetador? En la mayoría de los casos, pero no siempre, el propietario de la marca suele ser el etiquetador.
La FDA define a un etiquetador como “(1) Cualquier persona que hace que se aplique una etiqueta a un dispositivo con la intención de que el dispositivo se distribuya comercialmente sin ningún reemplazo o modificación posterior de la etiqueta; y
(2) Cualquier persona que haga que se reemplace o modifique la etiqueta de un dispositivo con la intención de que el dispositivo se distribuya comercialmente sin ningún reemplazo o modificación posterior de la etiqueta, excepto que la adición del nombre y la información de contacto de , una persona que distribuye el dispositivo, sin realizar ningún otro cambio en la etiqueta, no es una modificación a los efectos de determinar si una persona es un etiquetador” (FDA, Webinar UDI 101)
Los distribuidores solo agregan información de contacto
Un distribuidor puede agregar su información de contacto a una etiqueta. Siempre y cuando no alteren la etiqueta de ninguna otra manera. Las alteraciones hechas a la etiqueta más allá de esto pueden constituir un cambio en quién es exactamente el etiquetador del producto.
¿Se aplican los requisitos de UDI a los fabricantes de dispositivos extranjeros?
Las reglas de etiquetado UDI se aplican a todos los dispositivos médicos vendidos dentro de los Estados Unidos y Europa. Por lo tanto, incluso si su empresa está ubicada fuera de los EE. UU. o Europa, necesitará un procedimiento UDI y deberá cumplir con las regulaciones UDI para distribuir productos en estos dos mercados.
Requisitos GUDID para tu Trámite UDI
GUDID significa Base de datos de identificación única global de dispositivos. Esta base de datos es un catálogo de referencia abierto al público para cada dispositivo médico con un 'identificador'. Se puede acceder a esta base de datos a través de AccesoGUDID. A diferencia del envío, que requiere una cuenta, cualquiera puede acceder a AccessGUDID.
Según la regla UDI, la FDA requiere que los etiquetadores que tienen dispositivos médicos etiquetados con un UDI envíen su dispositivo a la GUDID. Si se pregunta si su dispositivo tiene un etiquetador de este tipo, mencionamos anteriormente que la FDA consideraba que el etiquetador era "la persona que hace que se aplique una etiqueta a un dispositivo, o que hace que se modifique la etiqueta, con la intención de que el dispositivo se introducirá en el comercio interestatal sin ningún reemplazo o modificación posterior de la etiqueta; en la mayoría de los casos, el etiquetador sería el fabricante del dispositivo, pero el etiquetador puede ser un desarrollador de especificaciones, un reprocesador de dispositivos de un solo uso, un ensamblador de kits de conveniencia, un reempacador o un reetiquetador”.
El GUDID se crea con datos sobre dispositivos de acuerdo con la tabla de línea de tiempo de cumplimiento compartida anteriormente y se publica junto con la regla UDI. El GUDID solo contiene el identificador del dispositivo, que es la clave principal para obtener información del dispositivo en la base de datos GUDID. Los identificadores de producción no se envían ni almacenan en el GUDID.
Referencias para su Trámite UDI
- FDA, (2015/05/06) Conceptos básicos de UDI, consultado el 10/26/2017
- FDA, (2014/08/13) Sistema único de identificación de dispositivos: guía de cumplimiento para pequeñas entidades Orientación para el personal de la industria y la Administración de Alimentos y Medicamentos, consultado el 10/27/2017
- FDA, (2017/03/30) GUDID, consultado el 11/01/2017
Recursos adicionales
- Sitio web del Registro Federal
- Información AIDC de Tech Target
- Sistema de identificación única de dispositivos: Preguntas frecuentes, vol. 1
- Guía UDI Identificación de dispositivo único (UDI) de dispositivos médicos
- Base de datos de identificación única global de dispositivos (GUDID) Guía para la industria y el personal de la Administración de Alimentos y Medicamentos
- Sistema único de identificación de dispositivos: Guía de cumplimiento para pequeñas entidades
- Formatos UDI por agencia emisora acreditada por la FDA Versión 1.3: 27 de enero de 2017
- Título 21- Alimentos y Drogas. Capítulo 1- Departamento de Salud y Servicios Humanos de la Administración de Alimentos y Medicamentos. Subcapítulo H- Dispositivos Médicos. Parte 830 Identificación única del dispositivo. Subpartes AE.
- Identificación única de dispositivos: marcado directo de dispositivos (publicado el 17 de noviembre de 2017)
- Coinsmart. El mejor intercambio de Bitcoin y criptografía de Europa.Haga clic aquí
- Platoblockchain. Inteligencia del Metaverso Web3. Conocimiento amplificado. Accede Aquí.
- Fuente: https://medicaldeviceacademy.com/udi-procedure/





