La FDA publicó un nuevo borrador de guía de selección de predicados 510k el 7 de septiembre, pero el borrador propone adiciones controvertidas.

El 7 de septiembre de 2023, un borrador de guía para la selección de predicados El documento fue publicado por la FDA. Normalmente se anticipa la publicación de un nuevo borrador de documentos de orientación de la FDA y existe una necesidad obvia del borrador. Sin embargo, este nuevo borrador parece incluir algunas adiciones controvertidas que creo que deberían eliminarse de la guía. Esta guía específica fue desarrollada para ayudar a los remitentes a utilizar las mejores prácticas al seleccionar un predicado. Hay algunos consejos útiles sobre la necesidad de revisar la base de datos de la FDA en busca de evidencia de problemas de seguridad relacionados con el uso y el diseño asociados con un posible predicado que se está considerando. Desafortunadamente, la última sección de la guía sugiere algunas recomendaciones controvertidas con las que no estoy de acuerdo.
Sección 1 – Introducción a la guía
La FDA indica que este nuevo borrador del documento de guía de selección de predicados se creó para brindar recomendaciones para implementar cuatro (4) mejores prácticas al seleccionar un dispositivo predicado para respaldar una presentación 510k. Este primer objetivo es algo que nuestra consultora recomendó en un seminario web de formación. La guía indica que la guía también fue creada por la FDA en un intento de mejorar la previsibilidad, coherencia y transparencia del proceso de revisión previa a la comercialización de 510k. Este segundo objetivo no se logra en el borrador de la guía y debe modificarse antes de que se publique como guía final.
Sección 2 – Antecedentes
Esta sección de la guía se divide en dos partes: A) El Proceso 510k y B) Modernización 510k.
A. El proceso 510k
La FDA publicó un Documento guía de equivalencia sustancial que explica cómo demostrar la equivalencia sustancial. El documento de orientación incluye un nuevo árbol de decisiones que resume cada una de las seis preguntas que los revisores de 510k deben responder en el proceso de evaluación de su presentación de 510k para determinar la equivalencia sustancial. La evidencia de equivalencia sustancial debe resumirse en la sección Predicados y equivalencia sustancial de la plantilla eSTAR de la FDA en su presentación 510k, y el documento de orientación revisa el contenido que debe proporcionarse.
La equivalencia sustancial se evalúa frente a un dispositivo de predicado o múltiples predicados. Para ser considerado sustancialmente equivalente, el dispositivo en cuestión de su envío 510k debe tener el mismo uso previsto. Y las mismas características tecnológicas que el dispositivo predicado. Por lo tanto, no se pueden utilizar dos predicados diferentes si un predicado tiene el mismo uso previsto (pero características tecnológicas diferentes) y el segundo predicado tiene las mismas características tecnológicas (pero un uso previsto diferente). Esto se llama “predicado dividido” y ese término se define en la guía. Esto no le prohíbe utilizar un predicado secundario, pero debe cumplir con los requisitos de este documento de guía para recibir la autorización 510k. El documento de orientación revisa cinco ejemplos de predicados múltiples que se utilizan correctamente para demostrar una equivalencia sustancial.
B. Modernización 510k
La segunda parte de esta sección se refiere a la FDA Plan de acción de seguridad emitido en abril de 2018. El anuncio del Plan de acción de seguridad también está relacionado con el anuncio de acciones de la FDA para modernizar el proceso 510k. Los objetivos del Plan de acción de seguridad de la FDA consisten en:
- Establecer una sólida red de seguridad para el paciente en materia de dispositivos médicos en los Estados Unidos
- Explorar opciones regulatorias para agilizar y modernizar la implementación oportuna de las mitigaciones posteriores a la comercialización.
- Estimular la innovación hacia dispositivos médicos más seguros
- Ciberseguridad avanzada de dispositivos médicos
- Integrar las oficinas y actividades previas y posteriores a la comercialización del Centro de Dispositivos y Salud Radiológica (CDRH) para avanzar en el uso de un enfoque TPLC para la seguridad de los dispositivos.
Ejemplos de esfuerzos de modernización incluyen los siguientes:
- En su lugar, la conversión de los dispositivos restantes de Clase 3 que fueron designados para la vía de autorización 510k al proceso de aprobación de PMA
- Uso de estándares de desempeño objetivos al introducir nueva tecnología en el mercado.
- Uso de dispositivos predicados más modernos (es decir, < 10 años)
En este borrador de guía de selección de predicados, la FDA afirma que los comentarios enviados al expediente en 2019 han persuadido a la FDA a reconocer que centrarse solo en dispositivos predicados modernos puede no resultar en una seguridad y eficacia óptimas. Por lo tanto, la FDA propone ahora el enfoque de fomentar las mejores prácticas en la selección de predicados. Además, el borrador de la guía propone una mayor transparencia al identificar las características tecnológicas utilizadas para respaldar una presentación 510k.
Sección 3 – Alcance de la guía de selección de predicados
El borrador de la guía de selección de predicados indica que el alcance de la guía debe usarse junto con la guía del programa 510k de la FDA. El alcance tampoco pretende cambiar según las normas legales o reglamentarias aplicables.
Sección 4: Cómo utilizar la guía de selección de predicados de la FDA
El uso previsto por la FDA de la guía de selección de predicados es proporcionar a los remitentes una herramienta que les ayude durante el proceso de selección de predicados. Esta guía sugiere un proceso específico para la selección de predicados. En primer lugar, el remitente debe identificar todos los posibles dispositivos comercializados legalmente que también tengan indicaciones de uso similares. En segundo lugar, el remitente debe excluir cualquier dispositivo con características tecnológicas diferentes si las diferencias plantean problemas de riesgo nuevos o diferentes. El subgrupo restante se denomina en la guía “dispositivo(s) de predicado válido(s)”. El tercer y último paso del proceso de selección es utilizar las cuatro (4) mejores prácticas para la selección de predicados propuestas en la guía. El siguiente diagrama proporciona una descripción visual de la terminología introducida en esta guía.

Sección 5 – Mejores prácticas (para la selección de predicados)
La guía de selección de predicados de la FDA tiene cuatro (4) mejores prácticas recomendadas para que las utilicen los remitentes al reducir su lista de dispositivos de predicados válidos a un predicado potencial final. Antes de utilizar estas mejores prácticas, debe crear una lista de dispositivos comercializados legalmente que podrían ser predicados potenciales. Las siguientes bases de datos de la FDA son las fuentes más comunes para generar una lista de dispositivos comercializados legalmente:
- Base de datos de registro y listado
- Nombres comerciales de dispositivos similares (es decir, nombre de propiedad)
- Fabricante(s) de dispositivos similares (es decir, nombre del operador propietario)
- Base de datos de 510k
- 510 dispositivos similares
- Nombre del solicitante (es decir, nombre del operador propietario) de dispositivos similares
- Nombre del dispositivo (es decir, nombre comercial) de un dispositivo similar
- Base de datos de clasificación de dispositivos
- Nombre de clasificación de dispositivos de dispositivos similares
- Código de producto de dispositivos similares
- Reglamento Número de dispositivos similares
Nuestro equipo suele utilizar la base de datos regulatoria de Basil Systems para realizar nuestras búsquedas. Basil Systems utiliza datos descargados directamente de la FDA, pero el software nos brinda cuatro ventajas sobre las bases de datos públicas de la FDA:
- El motor de búsqueda utiliza un algoritmo de lenguaje natural en lugar de una búsqueda booleana.
- La base de datos es mucho más rápida que la Bases de datos de la FDA.
- Los resultados incluyen análisis sobre los cronogramas de revisión y un "árbol de predicados".
- Basil Systems también tiene una base de datos de vigilancia posterior a la comercialización que incluye todos los eventos adversos de la FDA y datos de retiro del mercado, pero también incluye acceso a datos de Health Canada y la TGA australiana.
A. Dispositivos predicados autorizados mediante métodos bien establecidos
Algunas presentaciones de 510k utilizan los mismos métodos utilizados por un dispositivo predicado que se utilizó para su comparación de equivalencia sustancial, mientras que otros dispositivos utilizan métodos bien establecidos. La razón de esto puede haber sido que la presentación 510k precedió a la publicación de un documento de orientación de controles especiales específico para un producto de la FDA. En otros casos, es posible que la FDA no haya reconocido un estándar internacional para la clasificación del dispositivo. Puede buscar estándares internacionales reconocidos asociados con una clasificación de dispositivo específica utilizando la página de la FDA. base de datos de estándares de consenso reconocidos. A continuación se proporciona un ejemplo.
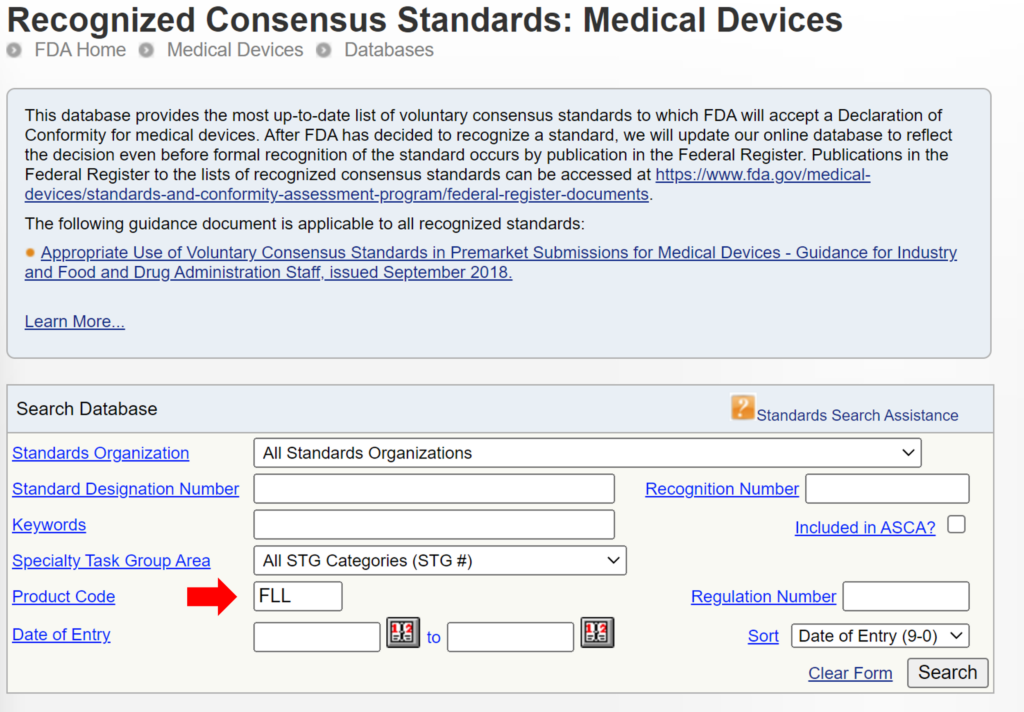
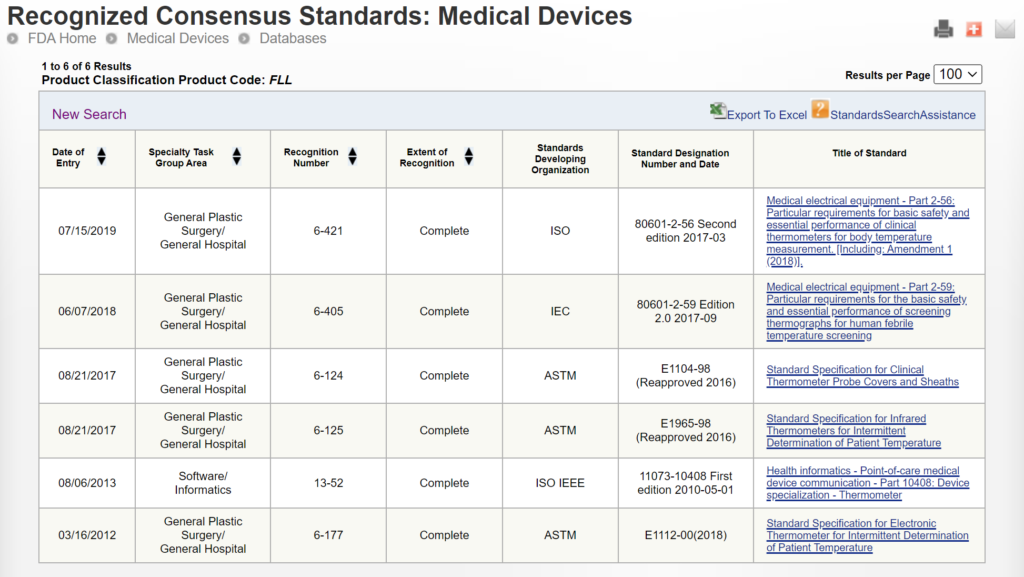
Las nuevas presentaciones de 510k siempre deben utilizar los métodos identificados en los documentos de orientación de la FDA y hacer referencia a estándares internacionales reconocidos en lugar de copiar los métodos utilizados para respaldar presentaciones de 510k más antiguas que son anteriores a la guía actual de la FDA o a los estándares reconocidos. El problema con el enfoque propuesto por la FDA es que la FDA está dando a entender que un dispositivo que no fue probado según las pautas actuales de la FDA o los estándares reconocidos no es inherentemente tan seguro o efectivo como otro dispositivo que fue probado según las pautas actuales de la FDA o los estándares reconocidos. Esta inferencia puede no ser cierta. Por lo tanto, aunque esto pueda ser una consideración, no es apropiado exigir a los fabricantes que lo incluyan como criterio de selección predicado. La FDA ya está teniendo esto en cuenta al exigir a las empresas que cumplan con la guía actual de la FDA y los estándares reconocidos para la descripción de dispositivos, el etiquetado, las pruebas de rendimiento no clínicas y otras pruebas de rendimiento. A continuación se proporciona un ejemplo de cómo FDA PreSTAR le notifica automáticamente sobre la guía de controles especiales de la FDA adecuada para una clasificación de producto.

B. Los dispositivos predicados cumplen o superan la seguridad y el rendimiento esperados.
Esta mejor práctica identificada en la guía de selección de predicados de la FDA recomienda buscar en tres bases de datos diferentes de la FDA para identificar cualquier lesión, muerte o mal funcionamiento reportado del dispositivo predicado. Esas tres bases de datos son:
Todas estas bases de datos son útiles, pero también existen problemas asociados con cada base de datos. En general, los eventos adversos no se notifican y se necesita una revisión más exhaustiva de la vigilancia posterior a la comercialización para evaluar con precisión la seguridad y el rendimiento de cualquier dispositivo. Los datos de MAUDE representan informes de eventos adversos relacionados con dispositivos médicos y se actualizan semanalmente. Los datos consisten en todos los informes voluntarios desde junio de 1993, informes de instalaciones de usuarios desde 1991, informes de distribuidores desde 1993 e informes de fabricantes desde agosto de 1996. Los datos MDR ya no se actualizan, pero la base de datos MDR le permite buscar información en la base de datos CDRH en dispositivos médicos que pueden haber funcionado mal o haber causado muerte o lesiones graves durante los años 1992 a 1996. Medical Product Safety Network (MedSun) es un programa de notificación de eventos adversos lanzado en 2002 por CDRH. El objetivo principal de MedSun es trabajar en colaboración con la comunidad clínica para identificar, comprender y resolver problemas con el uso de dispositivos médicos. Sin embargo, la guía de selección de predicados de la FDA no menciona la Base de datos del ciclo de vida total del producto (TPLC) que es una forma más eficiente de buscar en todas las bases de datos de la FDA, incluidas la base de datos de retiradas y la base de datos 510k.
El mayor problema con esta mejor práctica como base para seleccionar un predicado es que la cantidad de eventos adversos depende de la cantidad de dispositivos utilizados cada año. Para un fabricante pequeño, el número de eventos adversos será muy pequeño porque hay muy pocos dispositivos en uso. Para un fabricante más grande, el número de eventos adversos será mayor, aunque pueda representar menos del 0.1% de las ventas. Por último, no todas las empresas informan sobre los eventos adversos cuando se les exige, mientras que algunas empresas pueden informar en exceso sobre los eventos adversos. Ninguna de estas posibilidades se tiene en cuenta en el borrador de la guía de selección de predicados de la FDA.
C. Dispositivos predicados sin problemas de seguridad no mitigados relacionados con el uso o el diseño
Para la tercera mejor práctica, la guía de selección de predicados de la FDA recomienda que los remitentes busquen Base de datos sobre seguridad de dispositivos médicos y Base de datos CBER sobre seguridad y disponibilidad (productos biológicos) para identificar cualquier “señal emergente” que pueda indicar una nueva asociación causal entre un dispositivo y un evento adverso. Como ocurre con todas las búsquedas en la base de datos de la FDA, esta información es útil como aportación al proceso de diseño, porque ayuda a identificar peligros conocidos asociados con dispositivos similares. Sin embargo, se necesita una revisión más exhaustiva de la vigilancia posterior a la comercialización para evaluar con precisión la seguridad y el rendimiento de cualquier dispositivo, incluida la búsqueda en bases de datos de otros países donde se comercializan dispositivos similares.
D. Dispositivos predicados sin un retiro asociado relacionado con el diseño
Para la cuarta mejor práctica, la guía de selección de predicados de la FDA recomienda que los remitentes busquen La FDA retira la base de datos. Como se indicó anteriormente, la base de datos de TPLC incluye esta información para cada clasificación de producto. De las cuatro mejores prácticas recomendadas por la FDA, es poco probable que la FDA acepte como dispositivo predicado adecuado cualquier dispositivo determinante que haya sido objeto de un retiro del mercado relacionado con el diseño. Por lo tanto, esta búsqueda debe realizarse durante la fase de planificación del diseño o mientras se identifican los insumos del diseño. Si no puede identificar otro dispositivo determinante que no haya sido objeto de un retiro del mercado relacionado con el diseño, entonces debe solicitar una reunión previa a la presentación con la FDA y proporcionar una justificación para el uso del dispositivo determinante que fue retirado del mercado. Su justificación deberá incluir una explicación de los controles de riesgo que se implementaron para evitar un mal funcionamiento similar o un error de uso con su dispositivo. A menudo, los retiros del mercado son el resultado de problemas de calidad asociados con un proveedor que no fabricó un producto según las especificaciones o alguna otra no conformidad asociada con el ensamblaje, prueba, empaque o etiquetado de un dispositivo. Ninguno de estos problemas debería excluir automáticamente el uso de un predicado porque no son específicos del diseño.
Sección 6 – Mejora de la transparencia
Esta sección de la guía de selección de predicados de la FDA contiene las recomendaciones más controvertidas. La FDA propone que el resumen de 510k en las presentaciones de 510k incluya una narrativa que explique su selección de los dispositivos utilizados para respaldar la autorización de 510k. Este sería un nuevo requisito para completar un resumen 510k porque esa información actualmente no está incluida en los resúmenes 510k. El nuevo eSTAR de la FDA tiene la capacidad de generar automáticamente un resumen de 510k como parte de la presentación (consulte el ejemplo a continuación), pero el resumen de 510k generado por el eSTAR no incluye una sección para incluir una narrativa que explique los motivos de la selección de predicados.

La FDA agregó esta sección al borrador de la guía con el objetivo de mejorar la previsibilidad, consistencia y transparencia del proceso de revisión previa a la comercialización de 510k. Sin embargo, la adición propuesta de una narrativa que explique las razones de la selección de predicados no es la mejor manera de lograr esos objetivos. La mejor manera de lograr la transparencia es eliminando la opción de una declaración 510k (es decir, 21 CFR 807.93). Actualmente, el proceso 510k permite a los remitentes proporcionar una declaración 510k o un resumen 510k. La declaración 510k impide que el público obtenga acceso a la información que se proporcionaría en un resumen 510k. Por lo tanto, si la narrativa que explica los motivos de la selección de predicados va a ser requerida en una presentación 510k, ese nuevo requisito debe agregarse a la sección de equivalencia sustancial del eSTAR en lugar de incluirlo únicamente en el resumen 510k. Si se elimina la declaración 510k como opción para los remitentes, entonces todos los remitentes deberán proporcionar un resumen 510k y la explicación de la selección del predicado se podrá copiar de un cuadro de texto en la sección de equivalencia sustancial.
El FDA eSTAR garantiza la coherencia del contenido y el formato de la presentación de 510k, y el seguimiento del desempeño de la FDA ha mejorado la coherencia del proceso de revisión de 510k de la FDA. Agregar una explicación para la selección de predicados no afectará ninguno de estos objetivos para mejorar el proceso 510k. Además, las empresas no seleccionan predicados únicamente por los motivos indicados en esta guía de selección de predicados de la FDA. Una de las razones más comunes para seleccionar un predicado es el costo de comprar muestras de dispositivos predicados para realizar pruebas de rendimiento en paralelo. Esto sólo se relaciona con el costo, no con la seguridad o el rendimiento, y obligar a las empresas a comprar dispositivos más caros para realizar pruebas no se alinearía con el enfoque menos gravoso. Otro defecto en esta propuesta de información adicional que se incluirá en el resumen 510k es que existe una enorme variación en la cantidad de predicados que se pueden seleccionar para diferentes clasificaciones de productos. Por ejemplo, en los últimos 319 años se aprobaron 10 dispositivos para la clasificación de productos FLL (es decir, termómetro electrónico clínico), mientras que en los últimos 35 años se aprobaron 10 dispositivos para la clasificación de productos LCX (es decir, prueba de embarazo). Por lo tanto, el enfoque para seleccionar un predicado para estas dos clasificaciones de productos sería significativamente diferente debido al número de predicados válidos para elegir. Esto hace que sea muy difícil crear un proceso predecible o consistente para la selección de predicados en todas las clasificaciones de productos. También puede haber razones estratégicas y confidenciales para la selección de predicados que no serían apropiadas para un resumen 510k.
Sección 7 – Ejemplos
La guía de selección de predicados de la FDA proporciona tres ejemplos. En cada ejemplo, la FDA sugiere que el remitente proporcione una tabla que enumere los dispositivos predicados válidos y compare esos dispositivos en una tabla utilizando las cuatro mejores prácticas como criterio para la selección final. La FDA está posicionando esto como una mayor transparencia para el público, pero esta información presentada en la forma en que la FDA la presenta no sería útil para el público. Esto está creando más documentación para que las empresas la presenten a la FDA sin hacer que los dispositivos sean más seguros ni mejorar la eficacia. Este enfoque supondría un cambio en el contenido requerido de un resumen de 510k e introduciría datos posteriores a la comercialización como criterio para la autorización de 510k. Esta es una desviación significativa de la política actual de la FDA.
Ejemplo 1 de la guía de selección de predicados
En este ejemplo, el remitente incluyó una tabla en su envío 510k, junto con su justificación para seleccionar uno de los cuatro predicados potenciales como el dispositivo de predicado utilizado para respaldar su envío 510k. Este ejemplo es el más preocupante porque el resumen no tiene ningún detalle sobre el volumen de ventas de los posibles predicados que se están evaluando. El número de eventos adversos y retiradas del mercado suele estar correlacionado con el volumen de ventas. La tabla propuesta no tiene en cuenta esta información.
ejemplo 2 de la guía de selección de predicados
En este ejemplo, el remitente solo pudo identificar un dispositivo predicado potencial y válido. El remitente proporcionó una tabla que muestra que el predicado no presentaba preocupaciones para tres de las cuatro mejores prácticas, pero el predicado era objeto de un retiro relacionado con el diseño. El remitente también explicó las medidas tomadas para reducir el riesgo de esos problemas de seguridad en el dispositivo en cuestión. Como se indicó anteriormente, utilizar la ocurrencia de un retiro como base para excluir un predicado no es necesariamente apropiado. La mayoría de los retiros del mercado se inician por razones distintas al diseño. Por lo tanto, debe asegurarse de que el motivo del retiro esté relacionado con el diseño y no con un problema de cumplimiento del sistema de calidad o un problema de calidad del proveedor.
ejemplo 3 de la guía de selección de predicados
En este ejemplo, el remitente identificó dos dispositivos predicados válidos y potenciales. No se identificaron problemas de seguridad al utilizar ninguna de las cuatro mejores prácticas, pero los dos dispositivos potenciales tienen historias de mercado diferentes. Un dispositivo tiene 15 años de historia y el segundo dispositivo tiene tres años de historia. El remitente eligió el dispositivo con 15 años de historia porque el dispositivo en cuestión tenía un historial regulatorio más largo. El problema con este enfoque es que los años transcurridos desde la autorización no son una indicación del historial regulatorio. Un dispositivo puede recibir autorización en 2008, pero es posible que no se lance comercialmente hasta varios años después. Además, la cantidad de dispositivos utilizados puede ser bastante pequeña para una empresa pequeña. Por el contrario, si el producto con tres años desde la autorización 510k lo distribuye una importante empresa de dispositivos médicos, es posible que haya miles de dispositivos en uso cada año.
Recomendaciones de Medical Device Academy para la selección de predicados
La siguiente información consta de recomendaciones que nuestra firma de consultoría brinda a los clientes con respecto a la selección de predicados.
Intente utilizar sólo un predicado (es decir, un predicado primario)
Una vez que haya reducido una lista de predicados, generalmente recomendamos usar solo una de las opciones como predicado principal y evitar el uso de un segundo predicado a menos que sea absolutamente necesario. Si no está seguro de si se necesita un segundo dispositivo predicado o de referencia, esta es una excelente pregunta para hacerle a la FDA durante una teleconferencia previa a la presentación bajo el tema de "estrategia regulatoria" (ver imagen a continuación). En tus PreSTAR puede hacer la siguiente pregunta: “[El nombre de su empresa] propone utilizar [predicado principal] como predicado principal. A) ¿Tiene la FDA alguna inquietud con respecto a la selección de predicados? B) ¿Considera la FDA que se necesita un predicado secundario o un dispositivo de referencia?
Cuándo y cómo utilizar múltiples predicados
Recientemente, un cliente me preguntó sobre el uso de un predicado secundario en un envío 510k que estaba preparando. Tenían la impresión de que sólo se permitía un predicado para una presentación 510k porque la FDA considera que los dos dispositivos predicados son un "predicado dividido". El video proporcionado anteriormente explica la definición de "predicado dividido" y la definición se refiere a más que el uso de dos predicados. Para muchas de las presentaciones de 510k, preparamos y obtuvimos autorización para predicados secundarios usados. Una estrategia aún más común es utilizar un segundo dispositivo como dispositivo de referencia. Es posible que el segundo dispositivo solo tenga características tecnológicas en común con el dispositivo en cuestión, pero los métodos de prueba de seguridad y rendimiento utilizados pueden adoptarse como estándares de rendimiento objetivos para su presentación 510k.
Cuando intenta utilizar múltiples dispositivos predicados para demostrar una equivalencia sustancial con su dispositivo en cuestión en una presentación 510k, tiene tres opciones para el uso correcto de múltiples dispositivos predicados:
- Dos predicados con diferentes características tecnológicas, pero el mismo uso previsto.
- Un dispositivo con más de un uso previsto.
- Un dispositivo con más de una indicación bajo el mismo uso previsto.
Si utiliza la “opción 1”, entonces el dispositivo en cuestión debe tener las características tecnológicas de ambos dispositivos predicados. Por ejemplo, su dispositivo tiene capacidad Bluetooth y usa tecnología infrarroja para medir la temperatura, mientras que uno de los dos predicados tiene Bluetooth pero usa un termistor y el otro predicado usa medición infrarroja pero no tiene Bluetooth.
Si utiliza la "opción 2", está combinando las funciones de dos dispositivos diferentes en uno solo. Por ejemplo, un dispositivo predicado se usa para medir la temperatura y el otro dispositivo predicado se usa para medir la presión arterial. Sin embargo, su dispositivo puede realizar ambas funciones. Es posible que haya elegido otro monitor multiparamétrico del mercado como base; sin embargo, es posible que no pueda hacerlo si ninguno de los monitores multiparamétricos tiene la misma combinación de usos previstos y características tecnológicas. Este escenario es bastante común cuando se introduce una nueva tecnología para el monitoreo y ninguno de los monitores multiparamétricos está utilizando la nueva tecnología todavía.
Si utiliza la “opción 3”, debe tener cuidado de que la capacidad del dispositivo en cuestión para usarse para una segunda indicación no comprometa el rendimiento del dispositivo para la primera indicación. Por ejemplo, las placas de fijación ósea están diseñadas para la fijación de fracturas óseas. Si la primera indicación es para huesos largos y la segunda indicación es para huesos pequeños de la muñeca, es posible que el tamaño y la resistencia de la placa de fijación ósea no sean adecuados para huesos largos o que el dispositivo sea demasiado grande para la muñeca.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Automoción / vehículos eléctricos, Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- ChartPrime. Eleve su juego comercial con ChartPrime. Accede Aquí.
- Desplazamientos de bloque. Modernización de la propiedad de compensaciones ambientales. Accede Aquí.
- Fuente: https://medicaldeviceacademy.com/predicate-selection-guidance/



