¿Qué es un CAPA? ¿Cómo evalúa la necesidad de abrir un nuevo CAPA y quién debe ser asignado para trabajar en él cuando lo haga?
[Contenido incrustado]
¿Qué es un CAPA?
“CAPA” es el acrónimo de acción correctiva y acción preventiva. Es un proceso sistemático para identificar la causa raíz de los problemas de calidad e identificar acciones para la contención, corrección y acción correctiva. En el caso especial de las acciones preventivas, las acciones tomadas evitan que los problemas de calidad vuelvan a ocurrir, mientras que las acciones correctivas evitan que los problemas de calidad vuelvan a ocurrir. La FDA de EE. UU. requiere un procedimiento CAPA, y un proceso CAPA inadecuado es la razón más común de las observaciones de inspección y las cartas de advertencia de la FDA 483. Cuando doy cursos sobre el proceso CAPA, el 100% de las personas me pueden decir qué significa el acrónimo CAPA. Si todo el mundo entiende lo que es un CAPA, ¿por qué el proceso CAPA es la fuente más común de observaciones de inspección FDA 483 y no conformidades del auditor?
La mayoría de las 483 observaciones de inspección identifican uno de los siguientes siete problemas:
- el procedimiento es inadecuado
- los registros están incompletos
- acciones planificadas no incluyeron correcciones
- acciones planificadas no incluyeron acciones correctivas
- las acciones planeadas no se tomaron o se retrasaron
- el entrenamiento es inadecuado
- las acciones tomadas no fueron efectivas
Recursos de CAPA: procedimientos, formularios y capacitación
Las empresas de dispositivos médicos están obligadas a tener un procedimiento CAPA. Medical Device Academy ofrece a la venta un procedimiento CAPA como procedimiento individual o como parte de nuestro sistemas de calidad llave en mano. La compra del procedimiento incluye un formulario para sus registros CAPA y un registro CAPA para monitorear y medir la efectividad del proceso CAPA. También puedes adquirir nuestro Seminario web de CAPA basado en riesgo, que incluye el sistema de calidad llave en mano.
¿Qué tiene de especial la acción preventiva?
Completé cientos de auditorías de procesos CAPA a lo largo de los años.. Sorprendentemente, este parece ser un proceso con más variaciones de una compañía a otra que casi cualquier otro proceso que reviso. Esto también parece ser una fuente importante de no conformidades. En el ISO 13485 Estándar, las cláusulas 8.5.2 (Acción correctiva) y 8.5.3 (Acción preventiva) tienen requisitos casi idénticos. Sin embargo, los auditores externos enfatizan que se trata de dos cláusulas separadas. Me gusta referirme a los auditores de los organismos de certificación como puristas. Aunque los auditores de los organismos de certificación reconocen que las empresas pueden implementar acciones preventivas como una extensión de la acción correctiva, también esperan ver ejemplos de acciones estrictamente preventivas.
Puede confundirse entre acciones correctivas y acciones preventivas, pero hay una manera fácil de evitar la confusión. Hágase una pregunta: “¿Por qué inició CAPA?” Si el motivo fue: 1) una queja, 2) una no conformidad de auditoría o 3) componentes rechazados, entonces sus acciones son correctivas. Siempre puede extender sus acciones para incluir otros productos, equipos o proveedores que no estuvieron involucrados si activaron el CAPA. Sin embargo, para que un CAPA sea de naturaleza puramente preventiva, debe iniciar el CAPA antes de que ocurran quejas, no conformidades y rechazos.
¿Cómo evalúa la necesidad de abrir un CAPA?
Si el riesgo estimado es bajo y se conoce la probabilidad de ocurrencia, entonces se pueden derivar estadísticamente los límites de alerta y los límites de acción. Estos problemas de calidad son candidatos para un análisis continuo de tendencias, aunque los límites de alerta o acción pueden modificarse en respuesta a una investigación. Si el análisis de tendencias da como resultado la identificación de eventos que requieren acción, entonces ese es el momento en que se debe abrir un CAPA formal. No se necesita CAPA formal si la tendencia permanece por debajo de su límite de alerta.
Si el riesgo estimado es moderado o se desconoce la probabilidad de ocurrencia, entonces se debe considerar un CAPA formal. Idealmente, puede establecer una línea de base para la ocurrencia y demostrar que la frecuencia disminuye al implementar acciones correctivas. Si puede demostrar una caída significativa en la frecuencia, esto verifica la efectividad de las acciones tomadas. Si necesita estadísticas para mostrar una diferencia, entonces sus acciones no son efectivas.
Un plan de mejora de la calidad puede ser más apropiado si el riesgo estimado es alto o múltiples causas requieren múltiples acciones correctivas. Se aplican dos cláusulas de la Norma. La cláusula 5.4.2 aborda la planificación de cambios en el Sistema de Gestión de la Calidad. Por ejemplo, si corrige problemas con su proceso de inspección entrante: esto aborda 5.4.2. La cláusula 7.1 aborda la planificación de la realización del producto. Por ejemplo, si corrige problemas con la especificación de un componente donde el proceso de inspección entrante no es efectivo, esto aborda 7.1. El plan podría ser más largo o más corto dependiendo del número de causas contribuyentes y la complejidad de implementar soluciones. Si la implementación de la acción correctiva lleva más de 90 días, puede considerar el siguiente enfoque.
Paso 1: abra un CAPA
Paso 2: identifique el inicio de un plan de calidad como una de sus acciones correctivas
Paso 3: cierre CAPA cuando se inicie su plan de calidad (es decir, documentado y aprobado)
Paso 4: verifique la eficacia revisando el progreso del plan de calidad en las revisiones de gestión y otros foros de reuniones... puede hacer una referencia cruzada del CAPA con las minutas de la reunión de revisión de gestión correspondientes en su sección de eficacia
Si la acción correctiva requerida es instalar y validar nuevos equipos, el CAPA puede cerrarse tan pronto como se cree un plan de validación. La efectividad del CAPA se verifica cuando se implementa con éxito el protocolo de validación y se llega a una conclusión positiva. El mismo enfoque también funciona para implementar soluciones de software para administrar mejor los procesos. La estrategia básica es iniciar proyectos de mejora a largo plazo con el sistema CAPA pero monitorear el estado de estos proyectos fuera del sistema CAPA.
Las mejores prácticas serían implementar proyectos de seis sigma con estatutos formales para cada proyecto de mejora a largo plazo.
NOTA: Recomiendo cerrar los CAPA cuando se implementen acciones y realizar un seguimiento de las comprobaciones de eficacia de los CAPA como una métrica del sistema de calidad independiente. Si el cierre toma más de 90 días, el CAPA probablemente debería convertirse en un Plan de Calidad. Esto NO pretende ser una "solución alternativa" para brindar a las empresas una forma de extender los CAPA que no están progresando a tiempo.
¿Quién debe ser asignado para trabajar en un CAPA?
El personal de aseguramiento de la calidad generalmente se asigna a los CAPA, mientras que los gerentes de otros departamentos se asignan con menos frecuencia a los CAPA. Esto es un error. Cada proceso debe tener un propietario del proceso, que debe ser asignado a la investigación de la causa raíz, desarrollar un plan CAPA y administrar las acciones planificadas. Si el gerente no está adecuadamente capacitado, alguien del departamento de control de calidad debe aprovechar esta oportunidad para realizar una capacitación en el trabajo para ayudarlo con CAPA, no para hacer el trabajo por él. Esto incrementará el número de personas en la empresa con competencia CAPA. Esto también garantizará que el propietario del proceso asuma un papel de liderazgo en la revisión y actualización de los procedimientos y la capacitación sobre los procesos que necesitan mejoras. Finalmente, el proceso le enseñará al dueño del proceso la importancia de monitorear y medir el proceso para identificar cuándo está fuera de control o necesita mejoras.
¿Qué es una investigación de causa raíz?
Si estas invirtiendocerrando el raíz de una queja, las personas tomarán muestras de registros adicionales para estimar la frecuencia del problema de calidad. Describo esto como investigar el profundidad de un problema La FDA enfatiza la necesidad de revisar otras líneas de productos o procesos para determinar si existe un problema similar. Describo esto como investigar el amplitud de un problema La mayoría de las empresas describen las acciones realizadas en otras líneas de productos y/o procesos como “acciones preventivas”. Esto no siempre es exacto. Si se encuentra un problema en otro lugar, las acciones tomadas son correctivas. Si posible los problemas se encuentran en otros lugaresre, las acciones tomadas son preventivas. Podría tener ambos tipos de acciones, pero la mayoría de las personas identifican incorrectamente las acciones correctivas como acciones preventivas.
Otro error común es caracterizar las correcciones como acciones correctivas.
La diferencia más llamativa entre empresas parece ser el número de CAPA que inician. Hay muchas razones, pero la razón principal es la falta de uso de un enfoque basado en el riesgo para CAPA. No todos los problemas de calidad deben resultar en el inicio de un CAPA formal. El primer paso es investigar la causa raíz de un problema de calidad. La FDA exige que se documente la investigación de la causa principal, pero si ya tiene un CAPA abierto para la misma causa principal...NO ABRAS UNA NUEVA CAPA!!!
¿Qué debe hacer si no tiene un CAPA abierto para la causa raíz que identifica?
La imagen de abajo te da mi filosofía básica.
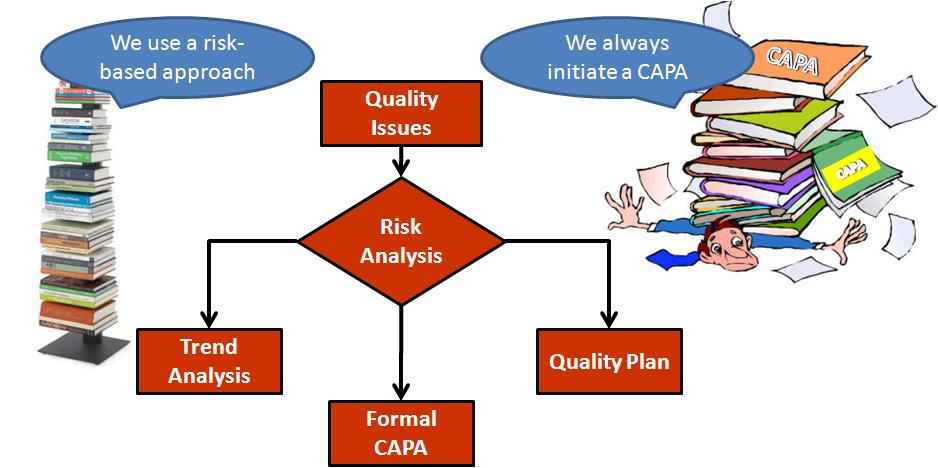 La mayoría de las investigaciones de CAPA documentan la probabilidad estimada de ocurrencia de un problema de calidad. Esto es solo la mitad del análisis de riesgo necesario que describo a continuación. Otro aspecto de una investigación es documentar la gravedad del daño potencial resultante del problema de calidad. Si un problema de calidad afecta la satisfacción del cliente, la seguridad o la eficacia, la gravedad es significativa. El riesgo es el producto de la severidad y la probabilidad de ocurrencia.
La mayoría de las investigaciones de CAPA documentan la probabilidad estimada de ocurrencia de un problema de calidad. Esto es solo la mitad del análisis de riesgo necesario que describo a continuación. Otro aspecto de una investigación es documentar la gravedad del daño potencial resultante del problema de calidad. Si un problema de calidad afecta la satisfacción del cliente, la seguridad o la eficacia, la gravedad es significativa. El riesgo es el producto de la severidad y la probabilidad de ocurrencia.
¿Cuánto detalle se necesita en sus CAPA?
Una de las razones más comunes para una observación de inspección FDA 483 relacionada con CAPA es la falta de detalles. Puede estar haciendo todas las tareas planificadas, pero debe documentar su actividad. Las investigaciones a menudo incluirán una gran cantidad de detalles que identifican cómo se identificó la causa raíz, pero se necesita el mismo nivel de detalle para la contención planificada, las correcciones, las acciones correctivas y los controles de eficacia. ¿Quién es responsable, cuándo se completará, cómo se hará, cuáles serán los registros y cómo monitoreará el progreso? Asegúrese de incluir también copias de los registros en el archivo CAPA porque esto elimina la necesidad de que los inspectores y auditores soliciten registros adicionales relacionados con CAPA. Idealmente, la persona que revisa el archivo CAPA no necesitará solicitar ningún registro adicional. Por ejemplo, una copia del procedimiento del proceso revisado, una copia de los registros de capacitación y una copia de las métricas graficadas para el proceso con frecuencia faltan en un archivo CAPA, pero los auditores solicitarán esta información para verificar que se completaron todas las acciones y que el CAPA es efectiva.
¿Cuál es la diferencia entre correcciones y acciones correctivas?
Cada no conformidad identificada en el hallazgo original requiere corrección. Al revisar los registros, los inspectores y auditores de la FDA verificarán que se haya completado cada corrección. Además, se pueden identificar varias no conformidades nuevas durante la investigación de la causa raíz. Las correcciones también deben documentarse para las no conformidades recién encontradas. Las acciones correctivas son acciones que toma para evitar que ocurran nuevas no conformidades. Los ejemplos de las acciones correctivas más comunes incluyen: revisar procedimientos, revisar formularios, volver a capacitar al personal y crear nuevas métricas de proceso para monitorear y medir la efectividad de un proceso. Despedir a alguien que no siguió un procedimiento no es una acción correctiva. Una mejor contratación, incorporación y supervisión de la gestión de los empleados debería evitar que los empleados cometan errores graves. El objetivo es tener un proceso casi perfecto que identifique el error humano en lugar de un empleado casi perfecto que tenga que compensar los procesos débiles.
Implementar acciones correctivas oportunas
Cada corrección y acción correctiva en su plan CAPA debe incluir una fecha de finalización objetivo, y se debe asignar una persona específica para cada tarea. Una vez que se aprueba su plan, necesita un mecanismo para monitorear la finalización a tiempo de cada tarea. Debe haber una alta dirección o una junta de CAPA que sea responsable de revisar y acelerar los CAPA. Si los CAPA se completan a tiempo, las reuniones periódicas son breves. Si los CAPA están atrasados, la gerencia o la junta de CAPA necesitan autoridad y responsabilidad para acelerar las acciones y poner a disposición recursos adicionales cuando sea necesario. La identificación de métricas de adelanto y retraso es esencial para administrar el proceso CAPA con éxito, y todos los demás procesos del sistema de calidad.
¿Qué es un control de eficacia?
Con frecuencia se confunde la implementación de acciones y la efectividad de las acciones. Se implementó una acción cuando se completó la acción que planeó. Por lo general, esto se documenta con la aprobación de documentos revisados y registros de capacitación. La eficacia de las acciones es más difícil de demostrar y, por lo tanto, es fundamental identificar métricas de adelanto y retraso para cada proceso. Las métricas de adelanto son métricas que miden las actividades de rutina que son necesarias para un proceso, mientras que las métricas de retraso miden los resultados de las actividades. Por ejemplo, monitorear la frecuencia de limpieza en un ambiente controlado es una métrica de avance, mientras que monitorear la carga biológica y las partículas es una métrica de retraso. Por lo tanto, los controles de eficacia deben ser cuantitativos cuando sea posible. Su efectividad es débil si necesita usar estadísticas para mostrar una diferencia estadística antes y después de implementar su plan CAPA. Si un gráfico de las métricas del proceso mejora notablemente después de implementar su plan CAPA, entonces la efectividad es sólida.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Automoción / vehículos eléctricos, Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- Desplazamientos de bloque. Modernización de la propiedad de compensaciones ambientales. Accede Aquí.
- Fuente: https://medicaldeviceacademy.com/capa/



