El uso de la nueva plantilla eSTAR de la FDA también requiere un nuevo proceso para la gestión de proyectos eSTAR para preparar sus presentaciones 510k y De Novo.
Resumen de diez (10) cambios importantes resultantes de la nueva plantilla eSTAR de la FDA
Al 1 de octubre de 2023, todos 510k y Presentaciones de Novo a la FDA ahora requieren el uso de la nueva plantilla eSTAR de la FDA y la plantilla debe cargarse en el Portal de colaboración con el cliente (CCP) de la FDA. Ayer, la FDA publicó una guía actualizada que explica los requisitos de presentación electrónica 510k, pero hay diez (10) cambios importantes en el proceso de presentación de Medical Device Academy como resultado de las nuevas plantillas eSTAR:
- Ya no necesitamos una tabla de contenidos.
- Ya no utilizamos la estructura de volumen y documento.
- Ya no estamos obligados a ajustarnos a la sección o paginación de todo el envío.
- Ya no nos preocupamos por la evaluación o la lista de verificación de la RTA (no existe).
- Ya no nos molestamos en crear un resumen ejecutivo (es opcional).
- Ya no tenemos una sección para dispositivos Clase 3 porque ya no hay dispositivos Clase 3 510(k).
- Ya no utilizamos el formulario 3514 de la FDA porque ese contenido ahora está incorporado al eSTAR.
- Ya no creamos una Declaración de Conformidad, porque el eSTAR crea una automáticamente.
- Ya no recomendamos crear un resumen 510(k), porque eSTAR crea uno automáticamente
- Ya no utilizamos FedEx porque, en su lugar, podemos cargar archivos al FDA CCP electrónicamente.
¿Qué es diferente en los requisitos de 510k?
A pesar de todos los cambios percibidos en el proceso de notificación previa a la comercialización de la FDA (es decir, el proceso 510k), los requisitos de formato y contenido no han cambiado mucho. El cambio reciente más significativo en el proceso 510k fue el requisito de incluir pruebas de ciberseguridad.
Esquema de la gestión de proyectos eSTAR
Hubo 20 secciones en una presentación de 510k. El equipo de consultoría de Medical Device Academy creó una plantilla para los documentos que se incluirán en cada sección. La gestión de proyectos eSTAR es diferente porque no hay números de sección a los que hacer referencia. Para mantener las cosas claras, recomendamos usar una o dos palabras al principio de cada nombre de archivo para definir la sección a la que pertenece. Las palabras deben coincidir con los marcadores utilizados por la FDA. Sin embargo, debe tener cuidado de no hacer que los nombres de los archivos sean demasiado largos. A continuación se muestra una lista de todas las secciones:
- Información administrativa;
- Descripción del aparato;
- Predicados y Equivalencia Sustancial;
- Beneficios, Riesgos y Medidas de Mitigación;
- Etiquetado;
- reprocesamiento, esterilidad y vida útil;
- Biocompatibilidad;
- Software/Firmware y Ciberseguridad/Interoperabilidad
- Software;
- EMC, seguridad inalámbrica, eléctrica, mecánica y térmica;
- Pruebas de rendimiento;
- Gestión de la calidad; y
- Documentación Administrativa.
La Sección de Beneficios, Riesgos y Medidas de Mitigación solo se aplica a las Solicitudes de Clasificación De Novo. La Sección de Gestión de Calidad incluye subsecciones de Información del Sistema de Gestión de Calidad, Información de Instalaciones, Estudios Post-Mercado y Referencias. Sin embargo, solo la subsección Referencias será visible en la mayoría de los envíos porque las otras tres subsecciones son parte del programa piloto eSTAR de Health Canada. Otras secciones y subsecciones se abreviarán u ocultarán según las selecciones del menú desplegable que seleccione en eSTAR. Por ejemplo, la sección de ciberseguridad permanecerá oculta si su dispositivo no tiene funcionalidad inalámbrica o una unidad de almacenamiento extraíble.
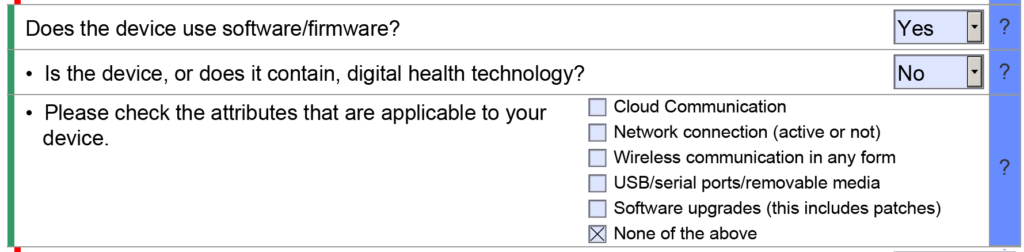
Ya no se requiere una tabla de contenido para envíos de 510k
510 envíos que utilizaron el formato FDA eCopy requirieron un índice, y Medical Device Academy utilizó el índice como herramienta de gestión de proyectos. A veces, todavía usamos nuestra plantilla de tabla de contenido para comunicar asignaciones y administrar el proyecto 510k. Las secciones del índice también estarían codificadas por colores. green, azul, amarilloy rojo para comunicar el estado de cada sección. La gestión de proyectos FDA eSTAR utiliza un proceso de codificación de colores similar con barras de colores en el costado de la plantilla para indicar si la sección está incompleta, completa u opcional.

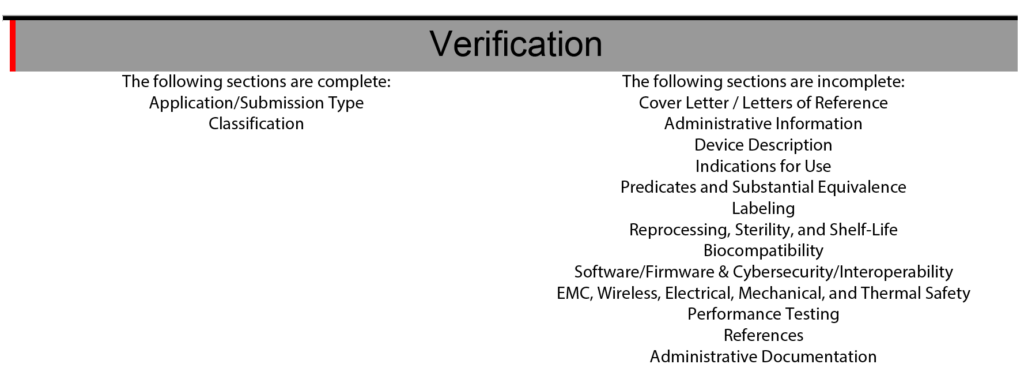
El eSTAR también tiene una sección de verificación al final de la plantilla para ayudar con la gestión del proyecto eSTAR. La sección de verificación enumera cada una de las 13 secciones principales de un eSTAR de la FDA. Cuando se completan las secciones, el nombre de la sección se mueve automáticamente del lado derecho de la sección de verificación al lado izquierdo. Durante los últimos dos años (2021 – 2023) de implementación de la plantilla eSTAR, poco a poco he aprendido a confiar únicamente en el eSTAR para comunicar el estado de cada sección. Para asignar responsabilidades para cada sección del envío 510k, todavía utilizamos las listas simples del índice y herramientas de gestión de proyectos como Asana. El uso de la sección de verificación de eSTAR para verificar el estado de cada sección de 510k también aumenta la competencia de nuestro equipo con el eSTAR cada vez que lo usamos.
Uso de Dropbox para la gestión de proyectos eSTAR
Las plantillas PreSTAR para una reunión Q-Sub tienen aproximadamente la mitad de longitud (es decir, 15 páginas en lugar de más de 30 páginas) de una plantilla eSTAR, y el envío de 510k requiere muchos más archivos adjuntos que un Q-Sub. Por lo tanto, generalmente podemos enviar por correo electrónico un borrador revisado del PreSTAR a un miembro del equipo para su revisión, pero no podemos usar el correo electrónico para compartir un eSTAR casi completo con un miembro del equipo. Por lo tanto, Medical Device Academy utiliza Dropbox compartir revisiones del eSTAR entre los miembros del equipo. Algunos de nuestros clientes utilizan One Drive o Google Drive para compartir revisiones. También creamos subcarpetas para cada tipo de prueba. Esto mantiene todos los documentos e informes de pruebas de una sección del eSTAR en un solo lugar. Por ejemplo, la documentación de validación del software se organizará en una subcarpeta de la carpeta de Dropbox para un proyecto de 510k.
Cuando utilizamos copias electrónicas de la FDA en lugar de la plantilla eSTAR de la FDA, utilizamos veinte subcarpetas etiquetadas y organizadas por números de volumen del 1 al 20. Algunas de esas 20 secciones ahora están obsoletas (por ejemplo, Resumen de Clase III) y otras (por ejemplo, Indicaciones de uso) están integradas directamente en la plantilla eSTAR. Por lo tanto, es posible que un equipo solo necesite entre 8 y 10 subcarpetas para organizar los documentos y los informes de prueba de un proyecto de 510k.. Por lo general, no adjuntamos estos documentos e informes de prueba hasta el final de la preparación de la presentación porque si la FDA publica una nueva versión de eSTAR, los archivos adjuntos no se exportarán de una versión anterior de eSTAR a la nueva versión.
La coordinación de la colaboración en equipo es fundamental para la gestión exitosa del proyecto eSTAR
En el pasado, Medical Device Academy siempre utilizaba una estructura de volumen y documentos para organizar una copia electrónica de la FDA porque esto facilitaba que varios miembros del equipo trabajaran simultáneamente en el mismo envío de 510k, incluso de diferentes países. Muchos clientes utilizarán SharePoint o Google Docs para facilitar la colaboración simultánea de varios usuarios. Desafortunadamente, dos usuarios no pueden editar el eSTAR simultáneamente porque es una plantilla segura que solo se puede editar en Adobe Acrobat Pro. Por lo tanto, el equipo debe comunicar cuándo se actualiza la plantilla eSTAR y realizar un seguimiento de las revisiones. Para la comunicación, utilizamos una combinación de aplicaciones de mensajería instantánea (p. ej., Slack o Whatsapp) y correo electrónico, mientras que las revisiones se rastrean agregando las iniciales y la fecha del editor al nombre del archivo (p. ej., nIVD 4.3 rvp 12-5-2023. pdf).
Importancia de las revisiones por pares
Cada sección del FDA eSTAR debe completarse antes de que el envío pueda cargarse en el Portal de colaboración del cliente (CCP). Si el FDA eSTAR está incompleto, el CCP identificará el archivo como incompleto. No podrás cargar el archivo. Si las preguntas del eSTAR se responden incorrectamente, es posible que las secciones que deben completarse no se activen debido a cómo se respondieron las preguntas. A continuación se muestran dos ejemplos de cómo se pueden responder incorrectamente las preguntas de eSTAR.
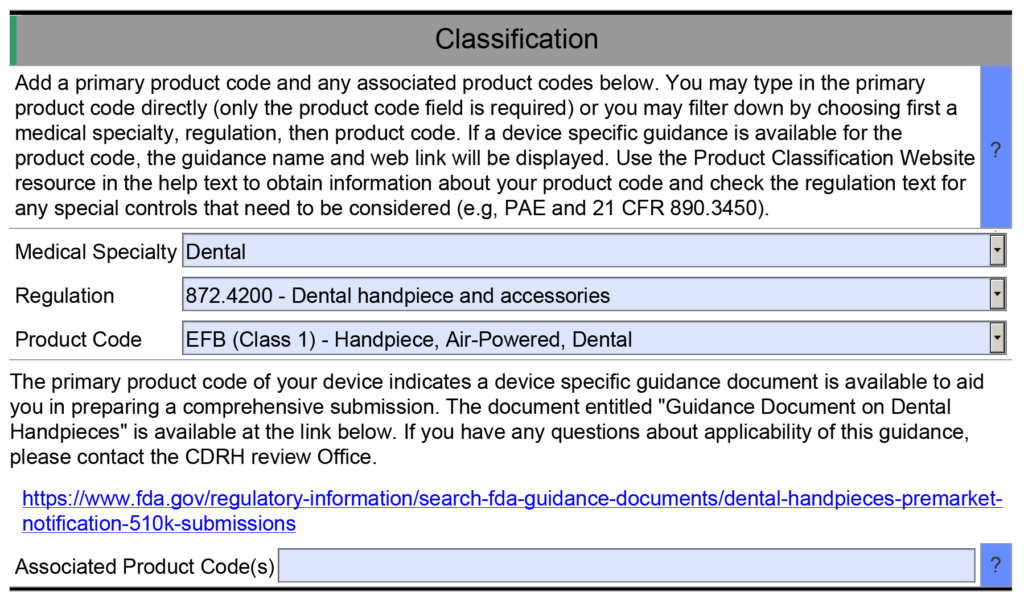
- Ejemplo 1: una de las características útiles del recurso FDA eSTAR es que muchos campos contienen un menú desplegable de respuestas. Un ejemplo se encuentra en la sección Clasificación del eSTAR. Esta sección requiere que el remitente identifique la clasificación del dispositivo respondiendo tres preguntas: 1) panel de revisión, 2) regulación de clasificación y 3) el código de producto de tres letras. Cada uno de estos campos utiliza un menú desplegable para completar el campo, y las opciones desplegables para las preguntas dos y tres dependen de las respuestas a la pregunta anterior. Sin embargo, si escribe manualmente el código del producto en el campo de la tercera pregunta, eSTAR no identificará ningún documento de guía de controles especiales aplicable para su dispositivo. A menos que ya conozca un documento de orientación sobre controles especiales aplicable, responderá preguntas en el eSTAR sobre controles especiales con "N/A". El eSTAR solo identificará un documento de guía de controles especiales para su dispositivo si selecciona un código de producto en el menú desplegable, pero el revisor de la FDA sabe qué documentos de guía de controles especiales son aplicables. Es por eso que la FDA realiza una evaluación técnica del eSTAR antes de que comience la revisión sustancial.
- Ejemplo 2 - Si indica la duración acumulada del contacto para un dispositivo de comunicación externa <24 horas, la plantilla eSTAR esperará que evalúe los siguientes criterios de valoración de biocompatibilidad: citotoxicidad, sensibilización, irritación, toxicidad sistémica y pirogenicidad.
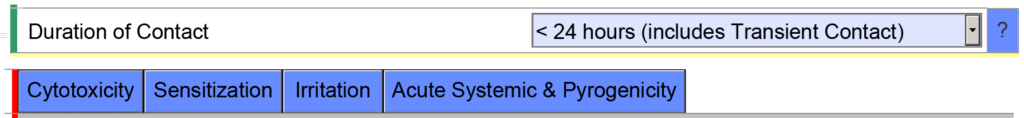
Sin embargo, si indica que la duración acumulada del contacto es < 30 días, la plantilla eSTAR se completará con criterios de valoración de biocompatibilidad adicionales. El eSTAR no sabe cuál es la duración acumulada de uso, pero el revisor de la FDA sí lo sabrá. Es por eso que la FDA realiza una evaluación técnica del eSTAR antes de que comience la revisión sustancial.

Para asegurarse de que todas las secciones de su envío estén completas, es útil que una segunda persona revise todas las respuestas para asegurarse de que todo se haya completado correctamente. Incluso los consultores experimentados que preparan 510 envíos cada semana pueden cometer un error y responder incorrectamente una pregunta en uno de los campos de eSTAR. Por lo tanto, no debe omitir esta revisión de control de calidad crítica.
Entrenamiento adicional de 510k
El libro de 510k, “Cómo preparar su 510k en 100 días”, se completó en 2017, pero el libro solo está disponible como parte de nuestra curso de 510k Serie que consta de más de 58 seminarios web. Por favor visite el página del seminario web para comprar seminarios web individuales.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- Fuente: https://medicaldeviceacademy.com/estar-project-management/



