NMPA emitió el "Proyecto de directriz sobre el registro de modificación del reactivo de diagnóstico in vitro" el 31 de mayo de 2023, para recibir comentarios. Los comentarios deben enviarse antes del 30 de junio de 2023.
Diagrama de flujo de toma de decisiones
Los cambios en los reactivos IVD deben controlarse a través del sistema de gestión de calidad, y si los cambios ocurren en el certificado de registro del dispositivo médico y sus anexos, se requiere la presentación de modificaciones o el registro de modificaciones.
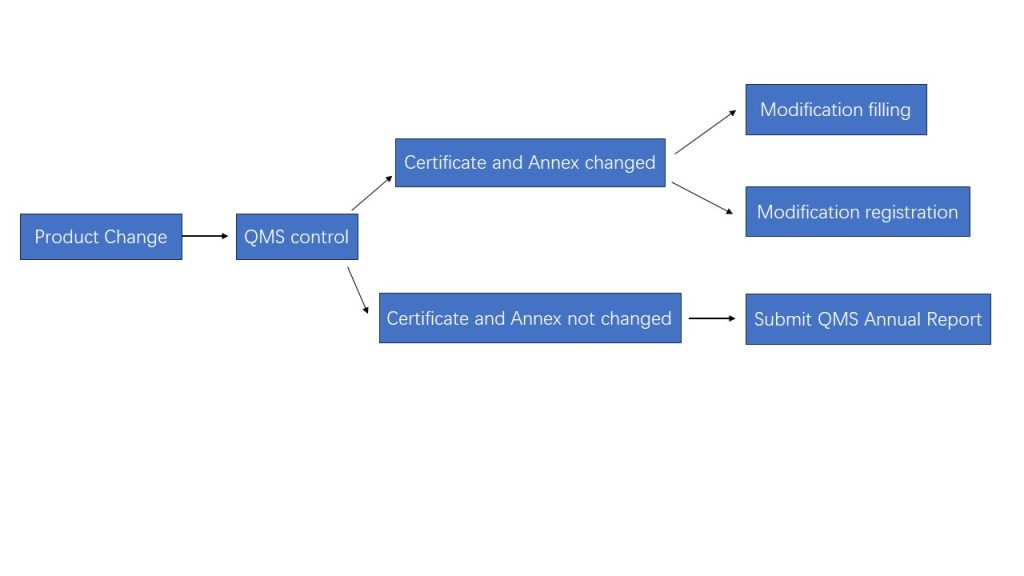
Los cambios en el nombre y dirección se pueden aplicar a través de la presentación de la modificación, y otros cambios de contenido se aplicarán a través del registro de la modificación.
Consideración a ser dada
Las siguientes situaciones deben ser consideradas en el proceso de control de riesgos y evaluación técnica. Para más detalles, envíe un correo electrónico info@ChinaMedDevice.com.
Circunstancias que no aumentan los riesgos:
- Cambios textuales en los nombres de los productos.
- Cambios en las especificaciones del empaque que no afectan el desempeño o la estabilidad: el empaque mínimo de la composición del producto permanece sin cambios, solo cambia el número de empaques.
- Agregue información de advertencia al manual.
- Elimine el modelo aplicable.
- El cambio de texto de la dirección de producción de reactivos IVD importados.
- Otros cambios que no afecten el rendimiento del producto.
Circunstancias en las que existe un riesgo potencial:
- Cambios en las especificaciones de empaque
- Cambios en las condiciones de almacenamiento del producto y fecha de caducidad
- Cambios de instrumentos aplicables
- Valor de juicio positivo o cambio del intervalo de referencia
- Cambios en materias primas de reactivos Clase III IVD
- Cambios en el proceso de producción de reactivos Clase III IVD
- Cambios en el sistema de reacción.
- Cambio de dirección de producción de reactivos IVD importados
- Cambio de tipo de muestra aplicable
- Cambios en la población aplicable y las indicaciones clínicas
- Cambios en los requisitos técnicos e instrucciones del producto
Circunstancias que se requieren para presentar una nueva solicitud.
Ejemplos de modificación
El borrador de la directriz toma los siguientes ejemplos para demostrar la aplicación de la modificación, desde la perspectiva de la descripción de la modificación, el ensayo clínico y no clínico:
- Cambios en los instrumentos aplicables
- Cambios en las materias primas para el reactivo Clase III IVD
- Cambios en las materias primas para el reactivo Clase III IVD
- Cambios en el sistema de reacción.
- Cambios de indicaciones clínicas
- Cambios en otros productos utilizados junto con el reactivo
- Cambios de intervalo de referencia
- Cambios en los tipos de muestra e indicaciones clínicas
- Agregar calibradores
Para obtener la versión en inglés del borrador de la directriz, envíenos un correo electrónico a info@ChinaMedDevice.com. Cobramos tarifas nominales por la traducción.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoAiStream. Inteligencia de datos Web3. Conocimiento amplificado. Accede Aquí.
- Acuñando el futuro con Adryenn Ashley. Accede Aquí.
- Compra y Vende Acciones en Empresas PRE-IPO con PREIPO®. Accede Aquí.
- Fuente: https://chinameddevice.com/modification-registration-ivd/



