Este artículo proporciona una descripción general del nuevo documento de guía de envío electrónico 510k que la FDA publicó en septiembre de 2022.
[Contenido incrustado]
¿Qué se incluye en la guía de envío electrónico 510k?
Al igual que con cualquier guía de la FDA, hay una introducción y antecedentes sobre el motivo de la nueva Guía de envío electrónico 510k documento (es decir, guía eSTAR). En la sección de alcance, la FDA especifica que este documento es específico para las presentaciones 510k utilizando la plantilla eSTAR. La FDA tiene planes de publicar una guía de presentación De Novo similar para usar la plantilla eSTAR. En la sección "Terminología significativa" de la guía, la FDA proporciona definiciones para cada uno de los diferentes tipos de envíos: eCopy, eSubmitter, etc. Luego, en la penúltima sección de la guía de envío electrónico, la FDA proporciona una tabla que describe todos los las secciones de la nueva plantilla eSTAR. La tabla se reproduce más adelante en este artículo. Si está interesado en un tutorial sobre cómo completar cada sección descrita en la tabla, le recomendamos que compre el producto de Medical Device Academy. Curso 510(k). La última sección de la guía eSTAR indica el momento para el cumplimiento de la nueva guía.
¿Cuál es el plazo para el cumplimiento de la guía?
En este nuevo documento de orientación para la presentación electrónica de 510k, la FDA indica que el uso de la plantilla eSTAR y el cumplimiento de la guía eSTAR son voluntarios hasta el 1 de octubre de 2023. Por lo tanto, después del año fiscal 2023, todas las presentaciones 510k deben enviarse como una presentación eSTAR en lugar de usar el antiguo formato tradicional de envío de 510k. La FDA también proporciona una hipervínculo para solicitar una cuenta del Portal de colaboración del cliente (CCP).
¿Qué falta en esta guía de presentación de 510k?
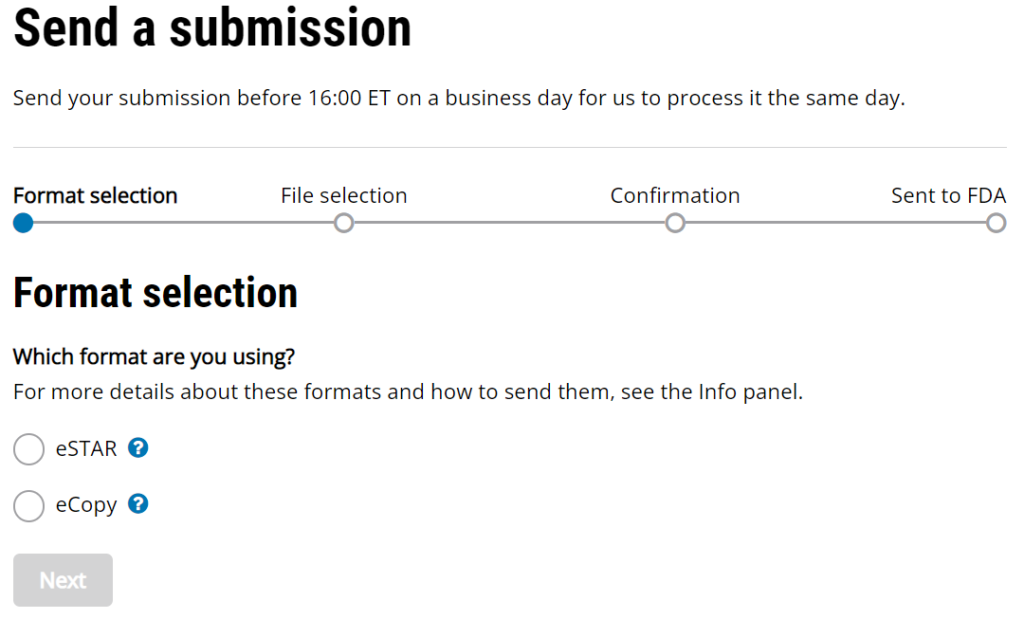
La nueva guía de presentación electrónica 510k no proporciona información sobre la fecha de recepción de las presentaciones electrónicas realizadas a través del nuevo portal de colaboración del cliente (CCP) creado por CDRH. La imagen a continuación es una captura de pantalla de la página web actual de carga de CCP. Incluye la siguiente declaración: "Envíe su envío antes de las 16:00 ET de un día hábil para que lo procesemos el mismo día". Esta declaración se agregó en algún momento de agosto o septiembre, pero la FDA no ha publicado una explicación detallada. Esta declaración deja en claro que la FDA no promete procesar un envío el "mismo día" si el envío se recibe después de las 4:00 p. m., hora del este. Sin embargo, "procesado" no tiene el mismo significado que "fecha de recepción".
Otro elemento que falta en esta nueva guía es una referencia a la documentación de factores humanos. Para cualquier dispositivo que tenga una interfaz de usuario diferente del dispositivo predicado y para dispositivos de software, la FDA requiere documentación de su proceso de factores humanos para asegurarse de que las diferencias en la interfaz de usuario no generen riesgos nuevos o diferentes en comparación con el dispositivo predicado. La guía de la FDA de 2016 para factores humanos no se ha actualizado, pero los revisores de la FDA continúan emitiendo deficiencias relacionadas con la evidencia objetiva proporcionada en un 510k para la validación de factores humanos.
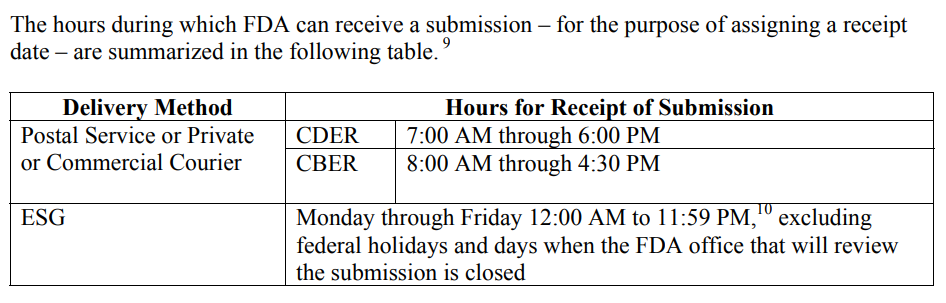
La FDA debe ser consistente en la redacción de "Horario de recepción de envíos" porque esto afecta los envíos al final del año fiscal, pero también afecta los envíos con una fecha límite para responder a una retención de RTA, respuesta de AI y envíos de IDE. . Las divisiones CDER y CBER de la FDA abordan la necesidad de definir la fecha de recepción en un documento de orientación específico para este tema, “Suministro de presentaciones reglamentarias en formato electrónico: fecha de recepción.” A continuación se muestra una captura de pantalla copiada de la página 4 de la guía.
Otro elemento que falta en esta nueva guía es una referencia a la documentación de factores humanos. Para cualquier dispositivo que tenga una interfaz de usuario diferente del dispositivo predicado y para dispositivos de software, la FDA requiere documentación de su proceso de factores humanos para asegurarse de que las diferencias en la interfaz de usuario no generen riesgos nuevos o diferentes en comparación con el dispositivo predicado. La guía de la FDA de 2016 para factores humanos no se ha actualizado, pero los revisores de la FDA continúan emitiendo deficiencias relacionadas con la evidencia objetiva proporcionada en un 510k para la validación de factores humanos.
¿Cuáles son las nuevas secciones para una presentación de 510k?
En 2019, la FDA publicó un documento de orientación sobre el “Formato de 510(k)s Tradicional y Abreviado.Esa guía describe las 20 secciones de una presentación tradicional de 510k que se han utilizado durante décadas. Sin embargo, la nueva guía de envío electrónico 510k no tiene numeración para las secciones de la plantilla eSTAR, y hay 22 secciones en lugar de 20 secciones. Varias de las nuevas secciones son elementos de la hoja de presentación actual de la FDA (es decir, el Formulario 3514 de la FDA), y algunas secciones existen en la guía de 2019 que se eliminaron, como: "Resumen y certificación de Clase III". Por lo tanto, Medical Device Academy está recreando el 100 % de nuestros seminarios web de capacitación 510k para explicar cómo se utilizan nuestras plantillas 510k con la plantilla eSTAR 510k y cómo completar el formulario PDF. Para evitar confusiones entre los dos formatos, usamos letras para cada sección en la plantilla eSTAR en lugar de números (es decir, AV en lugar de 1-20). La Tabla 1 de la nueva guía eSTAR se reproduce a continuación para su información.
| Información requerida | Descripción | |
| A | Tipo de sumisión | Identificación de información clave que puede ser útil para la FDA en el procesamiento inicial y la revisión de la presentación 510(k), incluido el contenido del Formulario FDA 3514 actual, Sección A. |
| B | Carta de presentación / Cartas de referencia | Adjunte una carta de presentación y cualquier documento que haga referencia a otras presentaciones. |
| C | Información del remitente | Información sobre el remitente y el corresponsal, si corresponde, consistente con el contenido del Formulario FDA 3514 actual, Secciones B y C. |
| D | Correspondencia previa al envío e interacción previa con el regulador | Información sobre envíos anteriores para el mismo dispositivo incluido en el envío actual, como los números de envío para una determinación previa de no equivalente sustancial (NSE), una solicitud 510(k) eliminada o retirada anterior, presentación Q, solicitud de exención de dispositivo en investigación (IDE), solicitud de aprobación previa a la comercialización (PMA), solicitud de exención de dispositivo humanitario (HDE) o solicitud de clasificación De Novo. |
| E | Estándares de consenso | Identificación de los estándares de consenso voluntario utilizados, si corresponde. Esto incluye estándares de consenso reconocidos y no reconocidos por la FDA. |
| F | Descripción del aparato | Identificación del número de listado si está registrado en la FDA.
Información descriptiva del dispositivo, incluida una descripción de las características tecnológicas del dispositivo, incluidos los materiales, el diseño, la fuente de energía y otras características del dispositivo, tal como se define en la sección 513(i)(1)(B) de la Ley FD&C y 21 CFR 807.100(b)(2)(ii)(A). La información descriptiva también incluye una descripción del principio de funcionamiento para lograr el efecto deseado y las condiciones de uso propuestas, como la técnica quirúrgica para implantes; ubicación anatómica de uso; interfaz de usuario; cómo interactúa el dispositivo con otros dispositivos; y/o cómo el dispositivo interactúa con el paciente. Información sobre si el dispositivo está destinado a ser comercializado con accesorios. Identificación de cualquier documento de orientación específico del dispositivo aplicable o controles especiales para el tipo de dispositivo según lo dispuesto en un documento de controles especiales (o medidas alternativas identificadas que brindan al menos una garantía equivalente de seguridad y eficacia) o en una clasificación específica del dispositivo regulación y/o estándares de desempeño. Ver "El programa 510(k): Evaluación de la equivalencia sustancial en las notificaciones previas a la comercialización [510(k)]." |
| G | Indicaciones de uso propuestas (formulario FDA 3881) | Identificación de las indicaciones propuestas para el uso del dispositivo. El término indicaciones de uso, tal como se define en 21 CFR 814.20(b)(3)(i), describe la enfermedad o condición que el dispositivo diagnosticará, tratará, evitará, curará o mitigará, incluida una descripción de la población de pacientes para la cual el dispositivo está destinado. |
| H | Clasificación | Identificación del número de reglamento de clasificación que parezca más apropiado para el dispositivo en cuestión, según corresponda. |
| I | Predicados y equivalencia sustancial | Identificación de un dispositivo predicado (p. ej., número 510(k), número De Novo, número PMA reclasificado, referencia de regulación de clasificación, si se exceden las limitaciones y exenciones a la exención, o declaración de que el predicado es un dispositivo previo a las enmiendas).
La presentación debe incluir una comparación del predicado y el dispositivo del sujeto y una discusión sobre por qué las diferencias entre el sujeto y el predicado no afectan la seguridad y la eficacia [consulte la sección 513(i)(1)(A) de la Ley FD&C y 21 CFR 807.87 (F)]. También se debe incluir un dispositivo de referencia en la discusión, si corresponde. Ver "El programa 510(k): Evaluación de la equivalencia sustancial en las notificaciones previas a la comercialización [510(k)]." |
| J | Diseño/Controles Especiales, Riesgos a la Salud y Medidas de Mitigación | Aplicable únicamente a envíos especiales 510(k).
Identificación de los cambios en el dispositivo y los métodos de análisis de riesgos utilizados para evaluar el impacto de los cambios en el dispositivo y los resultados del análisis. Medidas de control de riesgos para mitigar los riesgos identificados (p. ej., etiquetado, verificación). Ver "El Programa Especial 510(k)." |
| K | El etiquetado | Presentación del etiquetado propuesto con suficiente detalle para satisfacer los requisitos de 21 CFR 807.87(e). Generalmente, si el dispositivo es un dispositivo de diagnóstico in vitro, la etiqueta también debe cumplir con los requisitos de 21 CFR 809.10. Además, el término "etiquetado" generalmente incluye la etiqueta del dispositivo, las instrucciones de uso y cualquier etiquetado del paciente. Ver "Orientación sobre el etiquetado del paciente de dispositivos médicos." |
| L | Reprocesamiento | Información para evaluar el reprocesamiento, validación y etiquetado, en su caso. Ver "Reprocesamiento de dispositivos médicos en entornos de atención médica: métodos de validación y etiquetado." |
| M | Esterilidad | Información sobre esterilidad y métodos de validación, en su caso. Ver "Envío y revisión de la información de esterilidad en la notificación previa a la comercialización (510(k)) Envíos para dispositivos etiquetados como estériles." |
| N | Vida útil | Resumen de los métodos utilizados para establecer que el rendimiento del dispositivo se mantiene durante todo el vida útil propuesta (p. ej., propiedades mecánicas, integridad del recubrimiento, pH, osmolalidad), si procede. |
| O | Biocompatibilidad | Información sobre la evaluación de biocompatibilidad de los materiales de contacto con el paciente, si corresponde. Ver "Uso de la Norma Internacional ISO 10993-1, 'Evaluación biológica de dispositivos médicos - Parte 1: Evaluación y prueba dentro de un proceso de gestión de riesgos.'' |
| P | Software / firmware | Presentación de la documentación de software aplicable, si corresponde. Ver "Orientación para el contenido de presentaciones previas a la comercialización de software contenido en dispositivos médicos." |
| Q | Ciberseguridad/Interoperabilidad | Presentación de información aplicable en relación con la evaluación de la ciberseguridad, en su caso. Ver "Contenido para envíos previos a la comercialización para la gestión de la ciberseguridad en dispositivos médicos y Consideraciones de diseño y recomendaciones de presentación previas a la comercialización para dispositivos médicos interoperables." |
| R | Compatibilidad Electromagnética (EMC), Seguridad Eléctrica, Mecánica, Inalámbrica y Térmica | Envíe las pruebas de EMC, seguridad eléctrica, mecánica, inalámbrica y térmica para su dispositivo o resuma por qué no se necesitan pruebas. Ver "Compatibilidad electromagnética (EMC) de dispositivos médicos y Tecnología inalámbrica de radiofrecuencia en dispositivos médicos." |
| S | Test de rendimiento | Para dispositivos de diagnóstico no in vitro: Proporcione información sobre los informes de pruebas clínicas y no clínicas presentados, a los que se hace referencia o en los que se confía en el 510(k) para una determinación de equivalencia sustancial. Ver "Contenido y formato recomendados de la información de pruebas de rendimiento de banco no clínico en presentaciones previas a la comercialización."
Para dispositivos de diagnóstico in vitro: Proporcione rendimiento analítico, estudios de comparación, rango de referencia/valores esperados e información de estudios clínicos. |
| T | Referencias | Inclusión de referencias bibliográficas, si corresponde. |
| U | Documentación Administrativa | Inclusión de formularios administrativos adicionales aplicables a la presentación, incluidos, entre otros, un resumen general de la presentación/resumen ejecutivo (recomendado), una Declaración de veracidad y precisión y un Resumen o declaración 510(k). |
| V | Respuesta de enmienda/información adicional (AI) | Inclusión de respuestas a solicitudes de Información Adicional. |
Información importante en la guía eSTAR
En la Tabla 1 anterior, hay 14 hipervínculos a varios documentos de orientación de la FDA. Estos enlaces son extremadamente útiles cuando tiene preguntas sobre una pregunta específica. Desafortunadamente, el documento de guía de envío electrónico 510k quedará obsoleto rápidamente a medida que los documentos de guía se actualicen y se vuelvan obsoletos. En particular, uno de los documentos de orientación finales de la lista A planificados para el año fiscal 2023 es el Guía de ciberseguridad de la FDA. Esperamos que esa guía se actualice y se publique en cualquier momento.
- Coinsmart. El mejor intercambio de Bitcoin y criptografía de Europa.Haga clic aquí
- Platoblockchain. Inteligencia del Metaverso Web3. Conocimiento amplificado. Accede Aquí.
- Fuente: https://medicaldeviceacademy.com/510k-electronic-submission-guidance/



