Este blog proporciona una inmersión profunda en la versión más reciente de FDA eSTAR, versión 5.0, lanzada el 6 de diciembre de 2023.
¿Por qué la FDA lanzó la nueva versión de eSTAR como v5.0 en lugar de v4.4?
Una actualización de versión importante consta de cambios de política, cambios regulatorios o cambios importantes en la plantilla y se indicará mediante un incremento en el número de versión principal (por ejemplo, de 4.3 a 5.0). Una actualización de versión menor consistirá en otros cambios y se indicará mediante un incremento en el número de versión menor (por ejemplo, de 4.3 a 4.4). Si hay cambios normativos o de política, se crea una nueva versión principal de eSTAR antes de la fecha de implementación y se elimina la versión anterior de eSTAR. En este caso, habilitando el contenido de PMA, las actualizaciones del piloto internacional del eSTAR con Health Canaday la implementación de requisitos de documentación de ciberseguridad se consideran cambios importantes que desencadenan la necesidad de una actualización de versión importante (es decir, 5.0) en lugar de una actualización de versión menor (es decir, 4.4). Estos cambios se aplican a la DIV eSTAR y del eSTAR sin IVD. Si en general no está familiarizado con FDA eSTAR, visite nuestro página del curso 510k.
¿Cuál es la fecha límite para usar la versión 5.0?
La versión 4.3 de FDA eSTAR, tanto la versión nIVD como la IVD, se eliminarán del sitio web de la FDA el Febrero 4, 2024. Cualquier envío que se envíe con una versión caducada del eSTAR será rechazado. Si ya cargó información en una versión anterior de la plantilla, deberá desplazarse hasta la parte inferior de eSTAR y exportar los datos a un archivo HTML. Luego importa el archivo HTML a la versión más reciente de eSTAR. Cualquier archivo adjunto que haya creado en la versión anterior de la plantilla no se exportará y deberá adjuntar todos los archivos adjuntos a la nueva plantilla.
El contenido de PMA está habilitado en el nuevo FDA eSTAR
Las versiones anteriores de FDA eSTAR incluían la funcionalidad para Envíos de aprobación previa a la comercialización (PMA), pero en la versión 5.0 la FDA finalmente habilitó esta funcionalidad. Las presentaciones de 510k tienen tres tipos: 1) Tradicional, 2) Abreviada y 3) Especial. Las presentaciones de PMA también tienen diferentes tipos. Hay dos tipos de presentaciones de PMA para un nuevo dispositivo: tradicional y modular. Lamentablemente, el FDA eSTAR no está destinado a las PMA que utilizan el enfoque modular. Para los dispositivos de Clase 3, la FDA tiene controles más estrictos sobre los cambios que los dispositivos de Clase 1 y 2. Por lo tanto, un Suplemento AMP Se requiere para los siguientes tipos de cambios en dispositivos aprobados por PMA:
- nuevas indicaciones de uso;
- cambios de etiquetado;
- cambios de instalaciones para fabricación o embalaje;
- cambios en los métodos de fabricación;
- cambios en los procedimientos de control de calidad;
- cambios en los procedimientos de esterilización;
- cambios en el embalaje;
- cambios en las especificaciones de desempeño o diseño, y
- prórroga de la fecha de vencimiento.
Hay varios tipos de suplementos de PMA, pero solo tres tipos de suplementos pueden utilizar FDA eSTAR: 1) Panel-Track, 2) 180 días y 3) Tiempo real. Para determinar qué tipo de suplemento de PMA debe utilizar, la FDA publicó una guía para modificaciones a dispositivos sujetos al proceso de aprobación previa a la comercialización.
Contenido de la AMP
Las siguientes secciones del FDA eSTAR son específicas de los requisitos de contenido de presentación de la PMA:
- Información del sistema de gestión de calidad
- Información de la instalación
- Planes de estudio posmercado (PMS)
- Adjuntar declaración de exclusión, o Informe de Evaluación Ambiental de acuerdo con 21 CFR 814.20 (b) (11)
Health Canada está realizando una prueba piloto con el eSTAR de la FDA
El programa piloto eSTAR de la FDA de Health Canada ya está completo con un total de 10 participantes (originalmente solo estaban previstos 9). El piloto probará el uso de eSTAR para las solicitudes enviadas a Health Canada. Los resultados del piloto deberían estar completos pronto y luego esperamos una extensión del piloto a un número más amplio de solicitantes. Escuchamos rumores de que el HC eSTAR era demasiado complicado. Con suerte, la versión 5.0 está simplificada.
¿Hubo algún cambio en la sección de pruebas de EMC?
Las preguntas sobre etiquetado de EMC se consolidaron en una sola pregunta en lugar de cuatro porque generalmente solo se proporciona una cita en esta sección. A continuación se proporciona una copia de la versión anterior.
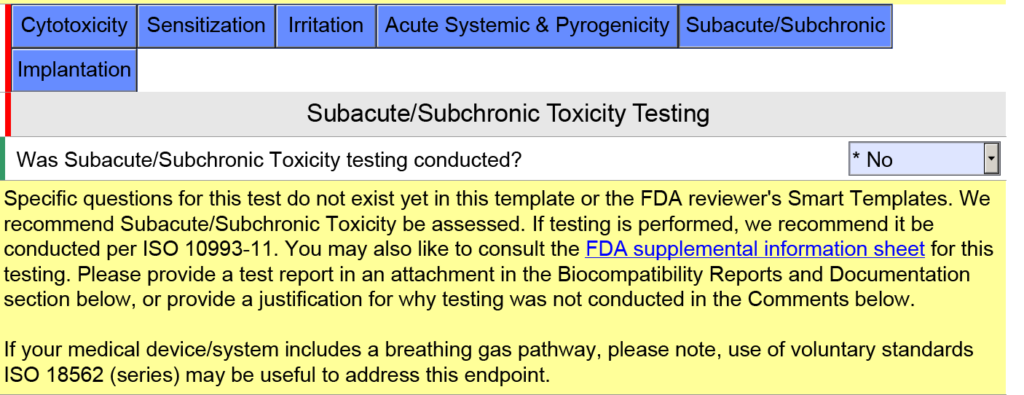
La versión actualizada 5.0 se muestra a continuación y solo tiene una pregunta, pero se cambió el texto de ayuda.

¿El FDA eSTAR requiere ahora más documentación de ciberseguridad?
Bhoomika Joyappa actualizó nuestra instrucción laboral de ciberseguridad (WI-007) para abordar la guía actualizada de la FDA para la documentación de ciberseguridad. Las revisiones se completaron a principios de este mes y puede comprar las plantillas actualizadas en nuestro sitio web. También les hemos dicho a nuestros suscriptores que anticipen una revisión significativa del eSTAR de la FDA.  plantilla cuando esto suceda. El lanzamiento de la versión actualizada de eSTAR tardó poco más de dos meses y el cambio dio lugar a una sección de tres páginas dedicada a la documentación de ciberseguridad. Las versiones anteriores de la plantilla incluían un requisito de documentación de la gestión de riesgos de ciberseguridad y un plan/plan de gestión de ciberseguridad para el apoyo continuo. Los siguientes documentos deben adjuntarse en esta sección si la ciberseguridad se aplica a su dispositivo:
plantilla cuando esto suceda. El lanzamiento de la versión actualizada de eSTAR tardó poco más de dos meses y el cambio dio lugar a una sección de tres páginas dedicada a la documentación de ciberseguridad. Las versiones anteriores de la plantilla incluían un requisito de documentación de la gestión de riesgos de ciberseguridad y un plan/plan de gestión de ciberseguridad para el apoyo continuo. Los siguientes documentos deben adjuntarse en esta sección si la ciberseguridad se aplica a su dispositivo:
- gestión de riesgos – informe (adjuntar)
- gestión de riesgos – modelo de amenazas (adjuntar)
- lista de metodología de amenazas (cuadro de texto)
- verificación de que la documentación del modelo de amenaza incluye (menú desplegable sí/no):
- vista global del sistema
- Vista de daños para múltiples pacientes
- Vista de actualizabilidad/parcheabilidad
- Vistas de casos de uso de seguridad
- evaluación de riesgos de ciberseguridad (adjuntar)
- números de página donde se documentan la metodología y los criterios de aceptación (cuadro de texto)
- verificación de que la evaluación de riesgos evita el uso de la probabilidad para la evaluación de probabilidad y utiliza la explotabilidad en su lugar (menú desplegable sí/no)
- lista de materiales del software o SBOM (adjuntar)
- nivel de soporte del software y fecha de finalización del soporte para cada componente de software (adjuntar)
- sistema operativo y versión utilizada (cuadro de texto)
- Evaluación de seguridad y protección de vulnerabilidades (adjuntar)
- evaluación de posibles anomalías no resueltas (adjuntar)
- datos de monitoreo de métricas de ciberseguridad (adjuntar)
- información sobre controles de seguridad (adjuntar)
- Números de página donde se aborda cada control de seguridad (cuadro de texto):
- Controles de autenticación
- Controles de autorización
- Controles de criptografía
- Controles de integridad de código, datos y ejecución
- Controles de confidencialidad
- Controles de registro y detección de eventos
- Controles de resiliencia y recuperación
- Controles de actualización de firmware y software
- vistas de arquitectura (adjuntar)
- pruebas de ciberseguridad (adjuntar)
- números de página donde se proporciona el etiquetado de ciberseguridad (cuadro de texto)
Los cambios en la sección de esterilidad incluyen una pregunta actualizada sobre los residuos de EO
En la sección de esterilidad del eSTAR de la FDA hubo una pregunta sobre los residuos de esterilizantes. Específicamente, la pregunta fue "¿Cuáles son los niveles máximos de residuos de esterilizante que quedan en el dispositivo?" El espacio previsto para introducir la información también era pequeño.
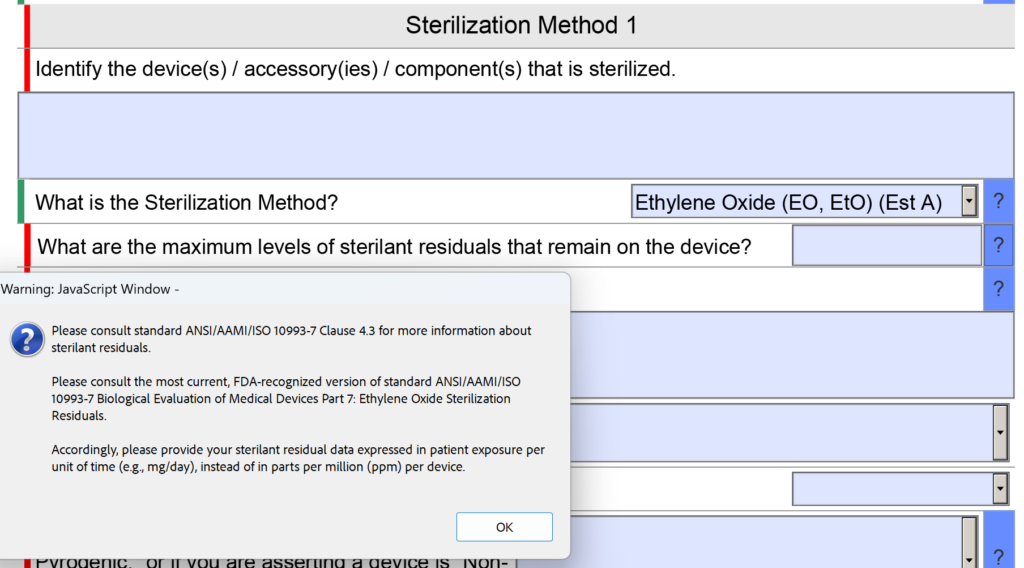
Ahora la pregunta se reformuló de la siguiente manera: "¿Cuáles son los niveles máximos de residuos esterilizantes que permanecen en el dispositivo y cuál es su explicación de por qué esos niveles son aceptables para el tipo de dispositivo y la duración esperada del contacto con el paciente?" No se realizó ningún cambio en el texto de ayuda para esta pregunta.
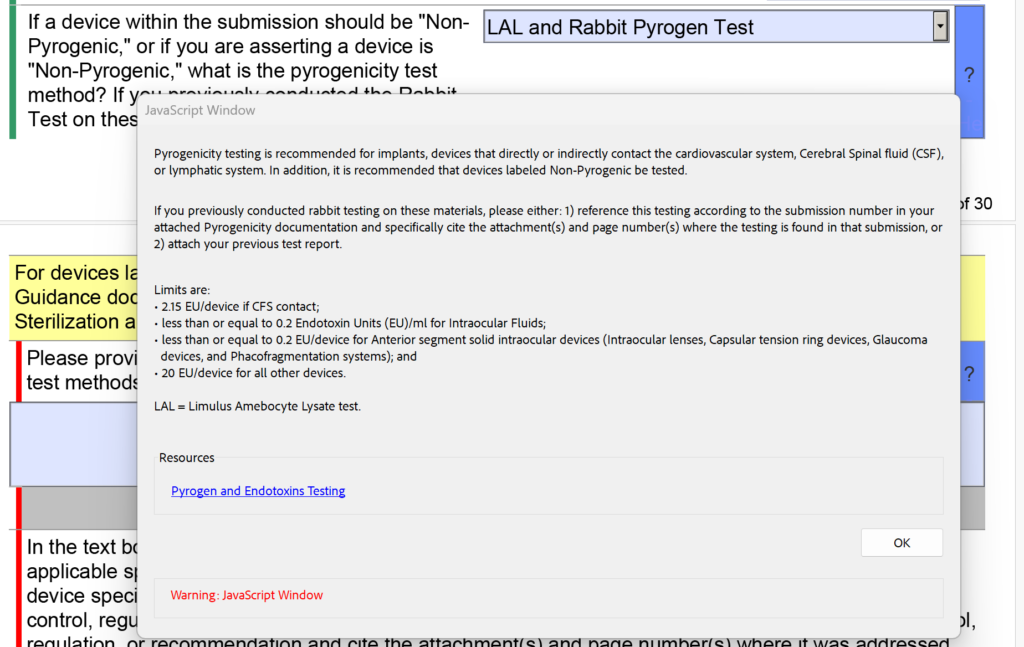
Además de los cambios en la sección de esterilidad con respecto a los residuos de EO, la FDA también modificó el menú desplegable y el texto de ayuda para las pruebas de pirogenicidad. Había opciones para “LAL” y “Prueba de conejo” por separado, pero ahora se combinan en “LAL y Prueba de pirógenos de conejo”. Además, se agregó el siguiente texto de ayuda: “Si anteriormente realizó pruebas en conejos con estos materiales, haga lo siguiente: 1) haga referencia a esta prueba de acuerdo con el número de envío en la documentación de pirogenicidad adjunta y cite específicamente los archivos adjuntos y el número de página (s) dónde se encuentran las pruebas en esa presentación, o 2) adjunte su informe de prueba anterior”.
¿Cuál es la fecha límite para usar la versión 5.0?
Muchos clientes dicen que reciben un mensaje de error cuando intentan abrir la plantilla eSTAR de la FDA. Esto se debe a que abren eSTAR desde un visor de PDF en lugar de Adobe Acrobat Pro.

Algunas personas quieren ahorrar dinero utilizando el software gratuito Adobe Acrobat Reader, pero esto no les permitirá completar el eSTAR correctamente. Por lo tanto, la FDA agregó un mensaje emergente si se utiliza Adobe Acrobat Reader.
¿Cómo se evalúa la biocompatibilidad de los dispositivos con una vía de gas respirable?
En la captura de pantalla a continuación, seleccioné intencionalmente "Dispositivo de superficie: membrana mucosa" como el tipo de contacto con el tejido para un dispositivo de vía de gas respirable porque el dispositivo tendrá una boquilla colocada en la boca (es decir, una membrana mucosa). Este es un error común. En la versión 5.0 de FDA eSTAR, la FDA aclara que estos dispositivos deben evaluarse como “comunicantes externamente” y el contacto con el tejido es “tejido/hueso/dentina”. En concreto, el tejido de contacto son los pulmones. Por este motivo, la FDA agregó el texto de ayuda que se muestra a continuación en la ventana de JavaScript con respecto a la aplicabilidad de ISO 18562-1, -2, -3 y -4.
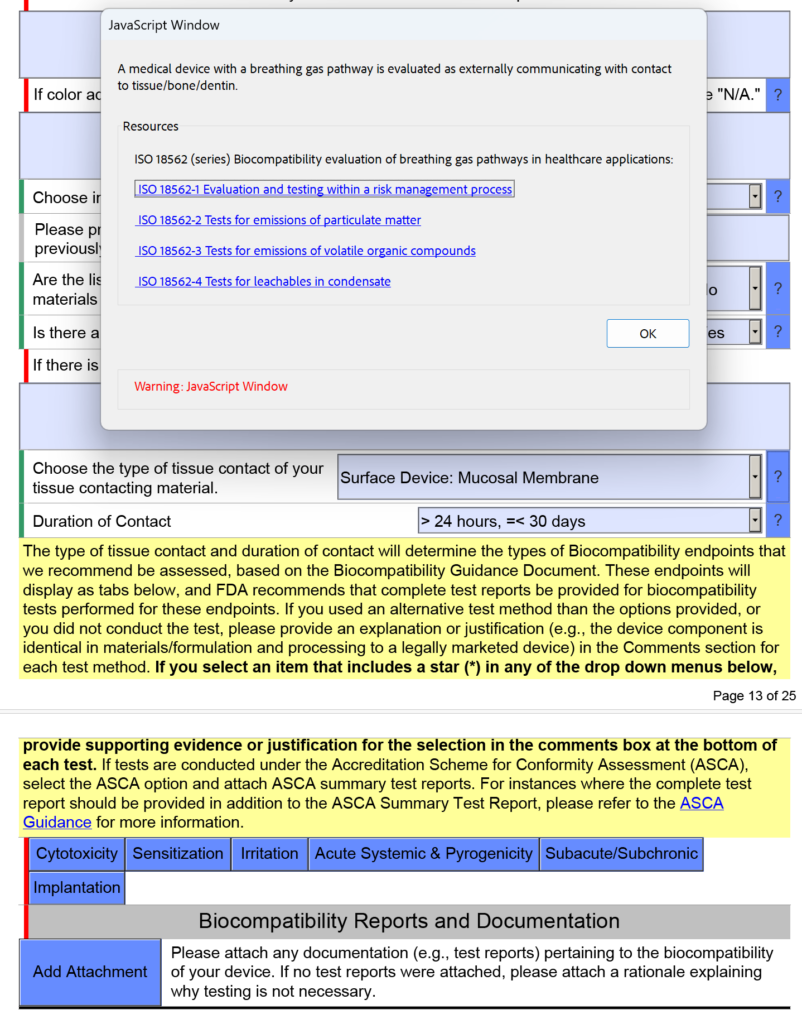
Aparecerán preguntas y orientación adicionales cuando haga clic en los cuadros azules individuales que se muestran arriba. Para el cuadro azul denominado "Subagudo/Subcrónico", encontrará texto de ayuda adicional sobre los estándares ISO 18562. Se encuentra un texto de ayuda similar al hacer clic en el cuadro azul denominado "Sistémico agudo y pirogenicidad".

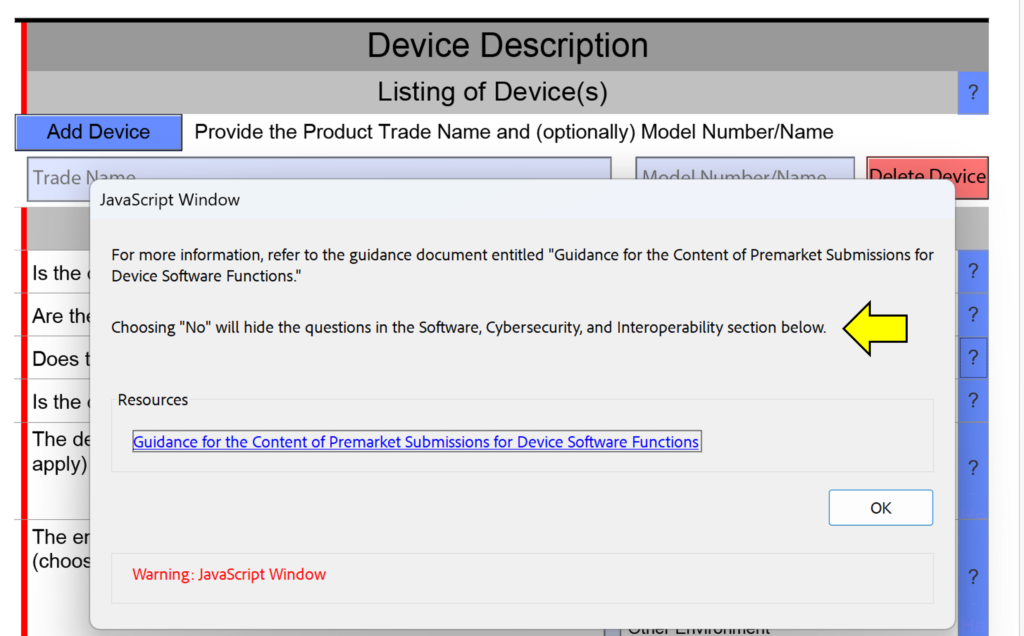
¿Qué es un recordatorio de cambio de sección transversal?
Uno de los cambios menores realizados en esta versión FDA eSTAR es la adición de "recordatorios de cambios de sección transversal" al texto de ayuda en la sección de descripción del dispositivo. Esto no pretende ayudarlo a evitar responder preguntas en su envío, porque si le falta una sección del envío porque respondió “No” en lugar de “Sí”, el revisor de la FDA identificará este error durante el proceso de Revisión Técnica. Esto hará que su envío quede en espera y el reloj de revisión se restablecerá a cero días cuando vuelva a enviarlo con las correcciones realizadas. La captura de pantalla a continuación muestra un ejemplo de uno de estos recordatorios de cambio de sección transversal.
¿Qué cambios se realizaron en la sección de pruebas clínicas del eSTAR de la FDA?
La sección de pruebas clínicas ahora se mostrará cuando se use PDF-XChange Editor, pero recomendamos utilizar únicamente Adobe Acrobat Pro para editar el FDA eSTAR. Este cambio es una corrección de errores y es específico del nIVD eSTAR. Tanto el IVD eSTAR como el nIVD eSTAR incluyen una sección de pruebas clínicas dentro de la sección de pruebas de rendimiento, pero la sección de pruebas de rendimiento se encuentra en el FDA eSTAR. antes la sección de pruebas de seguridad eléctrica y EMC, mientras que la sección de pruebas de rendimiento se encuentra después de la sección de seguridad eléctrica y pruebas EMC. Si su empresa planea enviar datos clínicos en una futura presentación a la FDA, tenemos las siguientes recomendaciones:
- mira el Seminarios web de aprendizaje de CDRH sobre el tema de 21 CFR 812
- Realizar una teleconferencia previa a la presentación para hacer preguntas sobre el protocolo de su estudio clínico antes de la presentación al IRB o a la junta de revisión ética.
- Antes de enviar la solicitud de reunión previa a la subreunión, observe qué información clínica general desea la FDA para una presentación De Novo o PMA en el eSTAR de la FDA.

Nota: La sección clínica que se muestra arriba solo se encuentra en FDA eSTAR si selecciona una presentación De Novo o PMA. Si envía un envío 510k con datos clínicos, la sección clínica se abreviará como se muestra a continuación.

- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- Fuente: https://medicaldeviceacademy.com/fda-estar/



