Los controles de diseño pueden ser abrumadores, pero puede aprender el proceso utilizando esta guía paso a paso para implementar controles de diseño. Implementación de controles de diseño
Implementación de controles de diseño
Puede implementar controles de diseño en cualquier momento durante el proceso de desarrollo, pero cuanto antes implemente su proceso de diseño, más útiles serán los controles de diseño. El primer paso para implementar controles de diseño es crear y procedimiento de controles de diseño. También necesitará al menos dos de los siguientes adicionales procedimientos del sistema de calidad:
- Procedimiento de Gestión de Riesgos (SYS-010)
- Desarrollo y Validación de Software (SYS-044)
- Procedimiento de Usabilidad (SYS-048)
- Instrucción Laboral de Ciberseguridad (WI-007)
A expediente de gestión de riesgos (de acuerdo con ISO 14971:2019) es obligatorio para todos los dispositivos médicos y la ingeniería de usabilidad o ingeniería de factores humanos (de acuerdo con IEC-62366 1) es obligatorio para todos los dispositivos médicos. Los procedimientos de software y ciberseguridad enumerados anteriormente solo son necesarios para productos con 1) software y/o firmware, y 2) funcionalidad inalámbrica o un punto de acceso para medios extraíbles (por ejemplo, una unidad flash USB o una tarjeta SD).
Paso 2: Capacitación en controles de diseño
Aunque el requisito de controles de diseño existe desde hace más de 25 años, todavía hay demasiados equipos de diseño que luchan por comprender estos requisitos. Las regulaciones sobre dispositivos médicos son complejas, pero los controles de diseño son el proceso más complejo en cualquier sistema de calidad. La razón de esto es que cada una de las siete subcláusulas representa un miniproceso que es equivalente en complejidad al análisis de causa raíz CAPA. Muchas empresas optan por crear instrucciones de trabajo independientes para cada subcláusula.
La filosofía de capacitación de Medical Device Academy es resumir los procesos en pasos discretos que puedan absorberse e implementarse rápidamente. Utilizamos formularios independientes para respaldar cada paso y desarrollamos cursos de capacitación con ejemplos prácticos, en lugar de escribir procedimientos detallados. El enfoque que enseñamos elimina la complejidad de su procedimiento de control de diseño (SYS-008). En cambio, confiamos en la estructura de formularios paso a paso completados en cada etapa del proceso de diseño.
Si está interesado en la capacitación en control de diseño, Rob Packard será el anfitrión de la tercera edición de nuestro Seminario web de capacitación sobre controles de diseño on Viernes 11 de agosto de 2023 a las 9:30 a. m.EDT.
Paso 3: Recopilación de datos de vigilancia poscomercialización
Actualmente, la FDA no exige la vigilancia posterior a la comercialización en 21 CFR 820, pero sí lo exige la norma ISO 13485:2016 en la Cláusula 7.3.3c) (es decir, “[los insumos del diseño y desarrollo] deben incluir… resultados aplicables de gestión de riesgos"). Se espera que la FDA publique los planes para la transición a ISO 13485 en el año fiscal 2024, pero la mayoría de las empresas piensan erróneamente que la FDA no exige la consideración de la vigilancia posterior a la comercialización cuando diseñan nuevos dispositivos. Esto no es correcto. Hay tres formas en que la FDA espera que se considere la vigilancia posterior a la comercialización cuando se desarrolla un nuevo dispositivo:
- Las quejas y eventos adversos asociados con versiones anteriores del dispositivo y los dispositivos de la competencia deben identificarse como entrada al proceso de gestión de riesgos para la identificación de peligros.
- Si el dispositivo incorpora software, las vulnerabilidades existentes del software disponible (incluidos los sistemas operativos) deben identificarse como parte del proceso de evaluación de riesgos de ciberseguridad.
- Durante el proceso de factores humanos, debe buscar errores de uso conocidos asociados con versiones anteriores del dispositivo y dispositivos de la competencia; Los riesgos conocidos relacionados con el uso también deben incluir cualquier error de uso potencial identificado durante las pruebas formativas.
Aunque actualmente la FDA no exige el cumplimiento de la norma ISO 13485, sí reconoce la norma ISO 14971:2019, y la vigilancia poscomercialización se identifica como un aporte al proceso de gestión de riesgos en la Cláusula 4.2 (ver nota 2), Cláusula 10.4 y Anexo A.2.10.
Paso 4: crear un plan de diseño
Debe actualizar su plan de diseño a medida que avanza el proyecto de desarrollo. La mayoría de los proyectos de diseño y desarrollo tardan un año antes de que la empresa esté lista para presentar una solicitud de 510k a la FDA. Por lo tanto, no te preocupes por que tu primera versión del plan sea perfecta. Tienes un año para realizar muchas mejoras en tu plan de diseño. Como mínimo, debe actualizar su plan de diseño durante cada revisión de diseño. Sin embargo, una cosa que es importante capturar en su primera versión es la vía regulatoria correcta para sus mercados previstos. Si no está seguro de en qué mercados planea lanzar, puede seleccionar un mercado y agregar más más tarde, o puede seleccionar algunos y eliminar uno o más más tarde. Su plan de diseño debe identificar los recursos necesarios para el proyecto de desarrollo y debe estimar cuándo espera realizar cada una de sus revisiones de diseño.
Contenido de su plan de diseño.
El requisito para los planos de diseño se establece tanto en la Cláusula 7.3.1 de las Normas ISO como en la Sección 21 CFR 820.30b del FDA QSR. Puede hacer que su plan sea tan detallado como necesite, pero le recomiendo comenzar de manera simple y agregar detalles. Su primera versión de un plan de diseño debe incluir las siguientes tareas:
- Identificación de la vía regulatoria en función de la clasificación de riesgo del dispositivo y las normas armonizadas aplicables.
- Desarrollo de un plan de gestión de riesgos.
- Aprobación de su plan de diseño (1st revisión de diseño)
- Identificación inicial de peligros
- Documentación y aprobación de las necesidades del usuario y aportes de diseño (2nd revisión de diseño)
- Análisis de opciones de control de riesgos.
- Desarrollo reiterativo del diseño del producto.
- El análisis de riesgos
- Documentación y aprobación de los resultados del diseño, implementación de medidas de control de riesgos (3rd revisión de diseño)
- Verificación del diseño y verificación de la eficacia de las medidas de control de riesgos (4th revisión de diseño)
- Validación del diseño y verificación de la eficacia de las medidas de control de riesgos que no se pueden verificar únicamente con pruebas de verificación.
- Evaluación clínica y análisis beneficio/riesgo (5th revisión de diseño)
- Desarrollo de un plan de vigilancia poscomercialización con un plan de gestión de riesgos poscomercialización.
- Desarrollo de un borrador del índice de registro maestro de dispositivos/archivo técnico (DMR/TF)
- Aprobación regulatoria (por ejemplo, autorización 510k) y cierre del Archivo de Historial de Diseño (DHF)
- Lanzamiento comercial (6th y revisión del diseño final)
- Revisar las lecciones aprendidas e iniciar acciones para mejorar el proceso de diseño.
Paso 5: cree un plan de prueba detallado
Su plan de pruebas debe indicar qué estándares reconocidos planea cumplir, y cualquier requisito que no sea aplicable debe identificarse y documentarse con una justificación de la no aplicabilidad. La versión inicial de su plan de prueba será una versión temprana de sus necesidades de usuario y entradas de diseño. Sin embargo, debe esperar que las entradas de diseño cambien varias veces. Después de recibir comentarios de los reguladores, es posible que deba realizar cambios en los insumos del diseño. Es posible que también deba realizar cambios cuando no pase las pruebas (es decir, pruebas preliminares, pruebas de verificación o pruebas de validación). Si su empresa sigue “El inicio magra”Metodología, su versión inicial de los insumos de diseño será para un producto mínimo viable (es decir, MVP). A medida que avanzas en tu proceso de desarrollo iterativo, agregará y eliminará entradas de diseño según los comentarios de los clientes y las pruebas preliminares. Su objetivo debe ser fallar temprano y rápido porque no quiere llegar a las pruebas de verificación y fallar. Es por eso que llevamos a cabo una “congelación del diseño” antes de comenzar las pruebas de verificación del diseño y las actividades de transferencia del diseño.
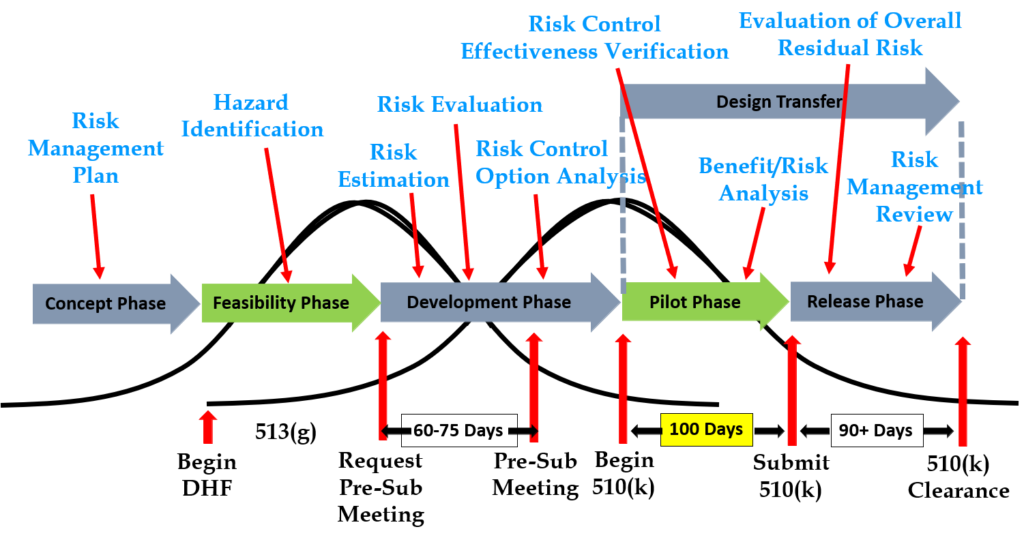
Paso 6: Solicite una reunión previa a la presentación con la FDA
Las entradas de diseño deben ser requisitos verificados mediante el uso de un protocolo de verificación. Si identifica estándares externos para cada entrada de diseño, le resultará más fácil completar las actividades de verificación, porque las pruebas de verificación serán más fáciles de identificar. Algunas normas no incluyen requisitos de prueba y hay requisitos que no corresponden a una norma externa. Por ejemplo, IEC 62366-1 es un estándar internacional para ingeniería de usabilidad, pero el estándar no incluye requisitos de prueba específicos. Por lo tanto, los fabricantes deben desarrollar su propio protocolo de prueba para validar los controles de ingeniería de usabilidad implementados. Si su empresa está desarrollando un proceso de esterilización novedoso (por ejemplo, esterilización UV), también necesitará desarrollar sus propios protocolos de prueba de verificación. En estos casos, debe enviar los protocolos preliminares a la FDA (junto con la documentación de análisis de riesgos asociada) para obtener comentarios y estar de acuerdo con su plan de pruebas. El método para obtener comentarios por escrito y estar de acuerdo con un plan de prueba propuesto es enviar una solicitud de reunión previa a la presentación a la FDA (es decir, PreSTAR).
Paso 7: El desarrollo iterativo es cómo realmente funcionan los controles de diseño
Los controles de diseño se convirtieron en un requisito legal en los EE. UU. en 1996, cuando la FDA actualizó las regulaciones del sistema de calidad. En ese momento, el "diagrama V" era bastante nuevo y se limitaba al desarrollo de software. Por lo tanto, la FDA solicitó permiso a Health Canada para reimprimir el "Diagrama de cascada" en la guía de control de diseño que publicó la FDA. Ambos diagramas son modelos. No representan las mejores prácticas y no pretenden representar cómo se realiza el proceso de diseño en la mayoría de las empresas. La información principal que comunica el “Diagrama en cascada” es que las necesidades del usuario se validan mientras se verifican los aportes del diseño. El diagrama no pretende comunicar que el proceso de diseño es lineal o que debe partir de las necesidades del usuario, diseñar las entradas y luego diseñar las salidas. El "diagrama V" pretende comunicar que se producen múltiples niveles de pruebas de verificación y validación, y que el proceso de desarrollo es iterativo a medida que se identifican errores de software. Ambos modelos ayudan a enseñar conceptos de diseño y desarrollo, pero ninguno pretende implicar requisitos legales. Una de las mejores lecciones para enseñar a los equipos de diseño y desarrollo es que es necesario desarrollar pruebas simples para evaluar los conceptos de diseño, de modo que puedan fallar temprano y rápidamente, antes de que el diseño se congele. Este proceso se denomina “análisis de opciones de control de riesgos” y se requiere en la cláusula 7.1 de la norma ISO 14971:2019.
Paso 8: "Congelar diseño"
Los resultados del diseño son dibujos y especificaciones. Asegúrate de mantenerlos actualizados y controlar los cambios. Cuando finalmente aprueba el diseño, se trata de la aprobación de los resultados de su diseño (es decir, la selección de opciones de control de riesgos). La selección final de los resultados del diseño o las medidas de control de riesgos a menudo se lleva a cabo como una reunión formal de revisión del diseño. La razón de esto es que el costo de la verificación del diseño es significativo. No existe ningún requisito reglamentario o legal para una “congelación del diseño”. De hecho, hay muchos ejemplos en los que se anticipan cambios pero el equipo decide continuar con las pruebas de verificación de todos modos. La mejor práctica desarrollada por la industria de dispositivos médicos es realizar una "congelación del diseño". Los resultados del diseño están "congelados" y no se permiten más cambios. El acto de congelar el diseño simplemente tiene como objetivo reducir el riesgo empresarial de gastar dinero en pruebas de verificación dos veces porque los resultados del diseño se cambiaron durante el proceso de prueba. Si un dispositivo no supera las pruebas, será necesario cambiar el diseño y repetir las pruebas, pero si todas las personas del equipo de diseño están de acuerdo en que la necesidad de cambios es remota y la empresa debería comenzar a realizar pruebas, es menos probable que se realicen cambios. después de que comience la prueba.
Paso 9: comience el proceso de transferencia del diseño
La transferencia de diseño no es un evento único en el tiempo. La transferencia comienza con la publicación de su primer dibujo o especificación para la compra y finaliza con la publicación comercial del producto. El ejemplo más común de una actividad de transferencia de diseño es la aprobación de dibujos prototipo como dibujo final publicado. Esto es común en piezas moldeadas. Se pueden evaluar varias iteraciones de la pieza de plástico utilizando piezas impresas en 3D y piezas mecanizadas, pero para fabricar de manera consistente el componente al costo objetivo, generalmente se necesita un molde de inyección. El coste del molde puede ser de 40 a 100 dólares, pero es difícil cambiar el diseño una vez construido el molde. El plazo de entrega de los moldes de inyección suele ser de 10 a 14 semanas. Por lo tanto, un equipo de diseño puede comenzar el proceso de transferencia de diseño para piezas moldeadas antes de realizar una congelación del diseño. Otro componente que puede lanzarse antes como diseño final es una placa de circuito impreso (PCB). Los componentes electrónicos como resistencias, condensadores y circuitos integrados (CI) pueden estar disponibles en el mercado, pero la PCB sin procesar tiene un plazo de entrega más largo y está personalizada para su dispositivo.
Paso 10: Verificación de los controles de diseño
Las pruebas de verificación del diseño requieren protocolos aprobados previamente y criterios de aceptación predefinidos. Siempre que sea posible, los protocolos de verificación del diseño deben estandarizarse en lugar de ser específicos del proyecto. La información relativa a la trazabilidad hasta la identificación del equipo calibrado y los métodos de prueba debe incluirse como una variable que se ingresa manualmente en un espacio en blanco cuando se ejecuta el protocolo. La filosofía detrás de este enfoque es crear un protocolo una vez y repetirlo para siempre. Esto da como resultado un proceso de verificación que es consistente y predecible, pero también elimina la necesidad de revisar y aprobar el protocolo para cada nuevo proyecto. Los protocolos estandarizados no necesitan especificar un proveedor o fechas para las pruebas, pero podría considerar documentar los proveedores y la duración de las pruebas en sus entradas de diseño para ayudar con la gestión y planificación del proyecto. Es posible que también desee utilizar una plantilla estandarizada para el formato y contenido de su protocolo e informe. La FDA proporciona una documento de guía específicamente para el formato y el contenido del informe para pruebas de rendimiento no clínicas.
Paso 11: Validación de los controles de diseño
Se requiere validación del diseño para demostrar que el dispositivo satisface las necesidades del usuario y del paciente. Las necesidades del usuario suelen ser las indicaciones de uso, incluidos los requisitos de seguridad y rendimiento. La validación del diseño debe ser más que una prueba en banco. Asegúrese de que se consideren modelos animales, modelos anatómicos simulados, análisis de elementos finitos y estudios clínicos en humanos. Uno de los propósitos de la validación del diseño es demostrar el desempeño para las indicaciones de uso, pero también es importante validar que los controles de riesgo implementados sean efectivos para prevenir los riesgos relacionados con el uso. Por lo tanto, las pruebas de validación sumativa de factores humanos son un tipo de validación de diseño. Las pruebas de factores humanos normalmente implicarán un uso simulado con la versión final del dispositivo y los usuarios previstos. Las pruebas de validación generalmente requieren pruebas de rendimiento no clínicas en paralelo con un dispositivo predicado para una presentación de 510k, mientras que las presentaciones de Marcado CE generalmente requieren datos clínicos humanos para demostrar la seguridad y el rendimiento.
Paso 12: Presentación FDA 510k
La notificación previa a la comercialización de la FDA, o presentación 510k, es el tipo de aprobación regulatoria más común requerida para dispositivos médicos en los EE. UU. Las presentaciones a la FDA generalmente se pueden presentar antes que otros países, porque la FDA no requiere certificación del sistema de calidad ni documentos técnicos resumidos, y los datos de las pruebas de rendimiento generalmente son pruebas de laboratorio no clínicas. Las presentaciones FDA 510k tampoco requieren la presentación de una validación del proceso para la fabricación. Por lo tanto, la mayor parte de la verificación y validación se realiza en "equivalentes de producción" que se fabricaron en pequeños volúmenes antes de que se validara el proceso de fabricación comercial. La validación del sistema de calidad y del proceso de fabricación puede completarse durante la revisión FDA 510k.
Paso 13: La revisión del diseño final
Las revisiones de diseño deberían tener resultados definidos. Recomendamos diseñar un formulario para documentar la revisión del diseño, que identifique los entregables para cada revisión del diseño. El formulario también debe definir el mínimo de asistentes requeridos por función. Otros asistentes a la revisión del diseño deben identificarse como opcionales, en lugar de revisores y aprobadores obligatorios. Si su proceso de revisión de diseño requiere demasiadas personas, esto tendrá un impacto a largo plazo en la revisión y aprobación de los cambios de diseño.
La única revisión de diseño requerida es una revisión de diseño final para aprobar el lanzamiento comercial de su producto. No mantenga abierto el DHF después del lanzamiento comercial. Todos los cambios posteriores a ese punto deben estar bajo controles de producción y los cambios deben documentarse en el (DMR)/Archivo técnico (TF). Si las modificaciones del dispositivo requieren un nuevo envío de 510k, entonces debe crear un nuevo proyecto de diseño y DHF para la modificación del dispositivo. Es posible que el nuevo DHF no tenga cambios en las necesidades del usuario ni en los aportes de diseño, pero es posible que tenga cambios menores (por ejemplo, un cambio en el método de esterilización requiere pruebas de los aportes de diseño revisados).
Paso 14: Registro de la FDA
Dentro de los 30 días posteriores a la distribución inicial del producto en los EE. UU., debe registrar su establecimiento ante la FDA. El registro debe renovarse anualmente entre el 1 de octubre y el 31 de diciembre, y se requiere registro para cada instalación. Si su empresa está ubicada fuera de EE. UU., necesitará un importador inicial que esté registrado y deberá registrarse antes de poder enviar el producto a EE. UU. Las empresas no estadounidenses también deben designar un Agente de EE. UU. que reside en EE.UU. En el momento del registro de la FDA, se espera que su empresa cumpla con todas las regulaciones para el Sistema de calidad, UDI, informes de dispositivos médicosy correcciones/eliminaciones.
Paso 15: La vigilancia posterior a la comercialización es el insumo de control del diseño para el próximo proyecto de diseño.
Uno de los resultados requeridos de su revisión de diseño final es su índice DMR. El índice DMR debería desempeñar una doble función al cumplir también con los requisitos de documentación técnica de otros países, como Canadá y Europa. Sin embargo, un índice de archivos técnicos incluye documentos adicionales que no son requeridos en los EE. UU. Uno de esos documentos es su plan de vigilancia poscomercialización y los resultados de la vigilancia poscomercialización. Esa vigilancia posterior a la comercialización es un aporte a su proceso de diseño para la próxima generación de productos. Cualquier error de uso, error de software o sugerencia de nueva funcionalidad debe documentarse como vigilancia posterior a la comercialización y considerarse como aportes potenciales al proceso de diseño para futuros proyectos de diseño.
Paso 16: Monitorear su proceso de controles de diseño
Audite su proceso de controles de diseño para identificar oportunidades de mejora y acciones preventivas. Las auditorías deben incluir una revisión de las métricas del proceso de diseño y se puede considerar establecer objetivos de calidad para mejorar el proceso de diseño. Este último paso, y la estandarización de los protocolos de verificación del diseño en el paso cinco (5), se analizan con más detalle en otro blog por la Academia de Dispositivos Médicos.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Automoción / vehículos eléctricos, Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- ChartPrime. Eleve su juego comercial con ChartPrime. Accede Aquí.
- Desplazamientos de bloque. Modernización de la propiedad de compensaciones ambientales. Accede Aquí.
- Fuente: https://medicaldeviceacademy.com/design-controls-implementation/



